
- •Реакции полимеризации и сополимеризации олефинов. Натуральный и синтетический каучуки понятие о высокомолекулярных соединениях.
- •Классификация карбоновых кислот. Предельные одноосновные кислоты. Гомологический ряд. Изомерия. Номенклатура. Ацильные радикалы. Физические и химические свойства. Высшие жирные кислоты. Мыла.
- •Непредельные одноосновные кислоты. Понятие о двухосновных кислотах и кислотах с несколькими двойными связями.
- •Важнейшие представители: муравьиная, уксусная, капроновая, энантовая, акриловая, щавелевая, олеиновая, стеариновая, сорбиновая кислоты. Реакция поликонденсации.
- •Жиры и масла. Получение, гидролиз и гидрогенизация жиров. Саломас, маргарин.
- •Карбоновые кислоты ароматического ряда. Бензойная кислота. Фталевые кислоты. Понятие об окси-кислотах (молочная, лимонная, винная кислоты).
- •Амины. Классификация, изомерия, номенклатура, получение. Физические и химические свойства (основность, алкилирование, ацилирование, действие азотистой кислоты). Понятие о диаминах.
- •3. Цветные (качественные) реакции на белки:
Органическая химия - химия соединений углерода. Состав органических соединений, элементы органогены (С, Н, О, Р, N, S). Многообразие соединений углерода, их роль в природе и практической деятельности человека. Сырьевые источники получения органических соединений.
Органическая химия - химия соединений углерода, точнее - химия углеводородов и их производных, в состав которых могут входить практически все остальные элементы периодической системы. Выделение органической химии в самостоятельную научную дисциплину обусловлено большим числом и многообразием органических соединений углерода, которых в настоящее время известно более 10 миллионов, наличием специфических свойств, отличающих их от соединений других элементов, и, наконец, их основополагающей ролью в жизни на Земле. Органическая химия изучает более высокооганизованную материю, чем неорганическая, органические соединения появились во вселенной позже неорганических, они являются носителями жизнедеятельности живых организмов. Превращения органических соединений управляются общими химическими закономерностями, но в то же время имеется ряд специфических особенностей, присущих только органическим соединениям: они термически менее устойчивы по сравнению с неоганическими, легче окисляются (горят), в подавляющем большинстве органических соединений связи между атомами ковалентные, органические вещества обладают значительно более низкими температурами плавления и кипения по сравнению с неорганическими.
Органогены — химические элементы, играющие ту или иную роль в жизни организмов. К органогенам относится 21 элемент, среди которых Б. Б. Полынов (1968) выделил абсолютные органогены (кислород, водород, углерод, азот, марганец, калий, сера), без которых невозможно существование жизни, и специальные органогены (кремний, натрий, кальций, железо, фтор, магний, стронций, бор, цинк, медь, бром, йод), которые необходимы многим, но не всем организмам. Элементы-органогены, главнейшие четыре элемента, участвующие в построении химич. соединений, входящих в состав организма, а именно: углерод, водород, кислород и азот. Углерод и водород входят во все органические соединения, встречающиеся в организме; в важнейшие соединения, как жиры, углеводы, входит еще кислород, а в белковые вещества кроме того азот.
Атомы углерода способны связываться друг с другом, образуя устойчивые цепочки и циклы, что делает количество соединений углерода в принципе бесконечным. Углерод способен образовывать не только одинарные, но и двойные и тройные связи, и способен образовывать устойчивые связи с другими элементами. Это определяет огромное разнообразие органических соединений. Соединения углерода имеют очень большое значение. Органическая химия – основа биологической химии, молекулярной биологии и фармакологии, и теоретическая основа для производства средств защиты растений, моющих средств, красителей, полимеров, различных нефтепродуктов и т.д. Современную цивилизацию без достижений органической химии представить невозможно.
Сырьевыми источниками органических соединений служат нефть и природный газ, каменный и бурый угли, горючие сланцы, торф, продукты сельского и лесного хозяйства.
Основные положения теории химического строения органических соединений А.М. Бутлерова. Структурные принципы в органической химии. Понятие об углеродном скелете, радикале и функциональной группе.
Многообразие органических соединений и их строения объясняется теорией строения, которую предложил Бутлеров. Суть этой теории состоит из 7 основных положений:
1.Атомы входящие в состав молекул органического вещества, не находятся в беспорядочном состоянии, а соединены между собой в определенной последовательности химическими связями. Порядок и последовательность соединения атомов в молекуле Бутлеров назвал химическим строением.
2.Соединения атомов в молекуле происходит в соответствии с их валентностью. Свободных валентностей у атомов в молекуле нет.
3.Свойства вещества зависят не только от того какие атомы и сколько их входит в состав молекулы, но и от того в какой последовательности они соединены между собой в молекуле.
4.Атомы и группы атомов входящие в молекулы оказывают влияние на химическое поведение друг друга. Особенно заметно такое влияние в тех случаях, когда эти атомы или группы атомов связаны непосредственно.
5.Зная свойства вещества можно установить его строение и наоборот: химическое строение органических соединения может много сказать о его свойствах.
6.Атомы углерода способны соединятся друг с другом с образованием углеродных связей различных видов. Эти цепи могут быть открытыми или замкнутыми. Цепи могут содержать одинарные, двойные и тройные связи.
7.Строение молекулы можно выразить при помощи структурной формулы, которая для данного органического соединения является единственно возможной.
Углеродный скелет молекулы — последовательность химически связанных атомов углерода, составляющая основу молекулы. Кроме атомов углерода в состав скелета могут входить и другие атомы, например, кислород, сера, азот, если они связаны, по меньшей мере, с двумя атомами углерода. Некоторые атомы углерода в углеродном скелете могут быть соединены с тремя или даже четырьмя другими атомами углерода, такой углеродный скелет называют разветвлённым.
Типы углеродных скелетов
—ациклические (не содержащие циклов);
—циклические;
—гетероциклические.
В гетероциклическом скелете в углеродный цикл включается одни или несколько атомов, отличных от углерода.
Углеводородный радикал в химии — группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но радикал и сам может содержать функциональные группы, поэтому с его «неизменностью» нужно быть осторожным: например, аминокислота аспарагиновая кислота содержит в той части молекулы, которая в общем виде рассматривается как остаток аминокислоты, ещё одну карбоксильную группу. Часто углеводородный радикал называют просто радикал, что может вызвать путаницу с таким понятием как свободный радикал. Некоторые углеводородные радикалы могут также являться функциональными группами, например, фенил (−C6H5), винил (−C2H3) и пр. Углеводородными радикалами обычно являются остатки углеводородов, которые входят в состав многих органических соединений.
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), определяющий её химические свойства. Функциональные группы определяют класс органических соединений.
Функциональные группы, входящие в состав различных молекул обычно ведут себя одинаково в одной и той же химической реакции, однако их химическая активность будет различной.
Известно более 100 функциональных групп.
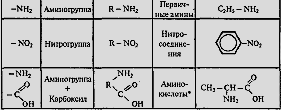
—Функциональные группы, содержащие атом кислорода: гидроксильная –ОН, карбонильная >С=O, карбоксильная –COOH и др.
—Функциональные группы, содержащие атом азота: аминогруппа –NH2, нитрогруппа –NO2, нитрильная группа или цианогруппа –CN и др.
—Функциональные группы, содержащие атом серы: сульфгидрильная (тиольная) –SH, сульфидная >S, дисульфидная –S–S–, сульфоксидная >S=O и др.
—Функциональные группы, содержащие ненасыщенные углерод-углеродные связи: двойные и тройные связи (в том числе сопряжённые диеновые системы), ароматические фрагменты и др.
—Функциональные группы, содержащие прочие атомы: атомы металлов, атомы галогенов и др.
Молекулы, в состав которых входит больше чем одна функциональныая группа называются полифункциональными.
При построении названия органического соединения, согласно номенклатуры ИЮПАК, отталкиваются от наличия в данном соединении функциональных групп.
Классификация органических соединений по углеродному скелету и функциональным группам. Гомология и гомологические ряды в органической химии. Понятие и виды изомерии. Принципы химической номенклатуры ИЮПАК.
Классификация органических веществ по строению углеводородного радикала:
—Ациклические (нециклические):
Предельные (атомы углерода связаны друг с другом только одинарными ϭ-связями)
Непредельные (молекулы этих соединений содержат двойные или тройные связи между атомами углерода)
—Циклические:
Карбоциклические (в состав циклов входят только атомы углерода)
Гетероциклические (в состав циклов кроме атомов углерода входят атомы других элементов)
Классификация органических веществ по функциональным группам (X)

Гомологический ряд — это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу СН2. Сходные по химическим свойствам соединения, образующие гомологический ряд, называются гомологами. Группа СН2 называется гомологической раз Состав всех членов гомологического ряда может быть выражен общей формулой.
Изомеры — это вещества, которые имеют одинаковый состав, но разное строение молекул и различные свойства. Изомерия — явление существования изомеров.
Изомеры имеют одинаковую эмпирическую формулу и разные структурные формулы. С увеличением числа атомов углерода в молекуле число изомеров резко возрастает.
Типы изомерии:
1.Структурная изомерия:
-изомерия цепи;
-изомерия положения кратной связи;
-изомерия положения функциональной группы.
2.Пространственная изомерия (геометрическая изомерия, цис-транс- изомерия)
Порядок
соединения атомов в этих изомерах
одинаковый, но расположение атомов в
пространстве различно.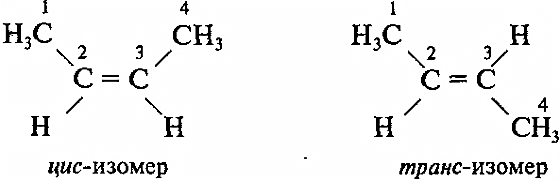
3.Межклассовая изомерия – изомерия веществ, принадлежащих к разным классам органических соединений:
-алкены и циклоаканы (CnH2n);
-алкины и алкадиены (CnH2n-2);
-алканолы и простые эфиры (CnH2n+2О);
-одноосновные карбоновые кислоты и сложные эфиры карбоновых кислот (CnH2nО2);
-альдегиды и кетоны (CnH2nО).
Химическая номенклатура — совокупность названий индивидуальных химических веществ, их групп и классов, а также правила составления этих названий.
Углеводороды. Классификация. Углеводороды с открытой цепью (алифатические): насыщенные, или предельные (парафины, алканы), ненасыщенные, или этиленовые (олефины, алкены), ненасыщенные, или ацетиленовые (алкины), углеводороды с двумя двойными связями (алкадиены). Гомологические ряды. Общие формулы. Изомерия и номенклатура ИЮПАК. Нахождение в природе. Физические свойства. Закономерности изменения физических свойств в гомологических рядах. Химические свойства.
Углеводороды — органические соединения, состоящие исключительно из атомов углерода и водорода.
Классификация:
—Насыщенные УВ (алканы, циклоалканы);
—Ненасыщенные УВ (алкены, алкадиены, алкины);
—Ароматические УВ (арены).
АЛКАНЫ (предельные или насыщенные УВ, парафины) CnH2n+2, n≥1
Алканы — это нециклические УВ, в молекулах которых все атомы углерода находятся в состоянии sp3-гибридизации и связаны друг с другом только ϭ-связями.
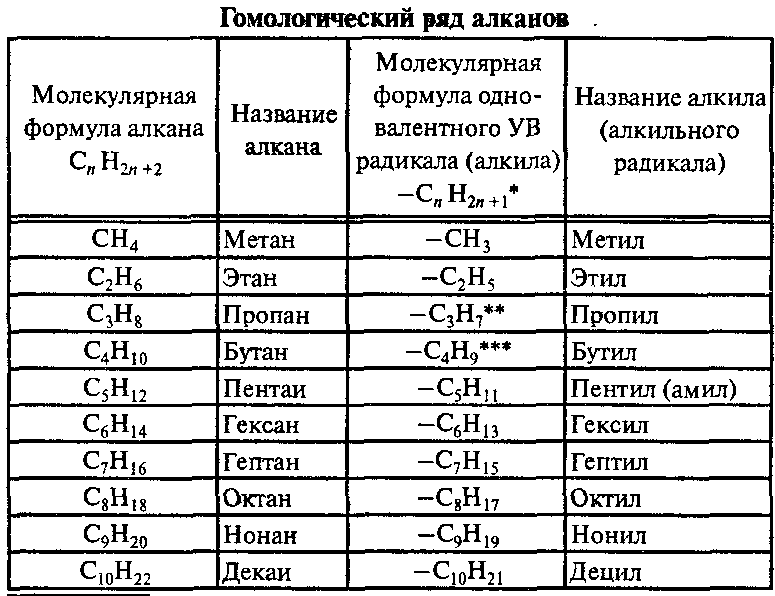
Изомерия и номенклатура алканов
Возможна только изомерия цепи. Первые три члена гомологического ряда алканов (СН4, С2Н6, С3Н8) изомеров не имеют. Согласно международной номенклатуре изомеры с разветвленной цепью углеродных атомов следует рассматривать как производные алкана с самой длинной неразветвленной углеродной цепью.
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Физические свойства:
Алканы
— бесцветные вещества, легче воды, плохо
растворяются в воде.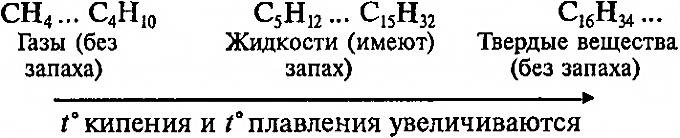
Химические свойства:
Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С—С и С—Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода.
1.Реакции замещения (разрыв связей С—Н) RH + XY → RX + HY
— Галогенирование (замещение атома водорода атомом галогена — F, Cl, Вг с образованием галогеналкана RHal);
—Нитрование (замещение атома водорода нитрогруппой — N02 с образованием нитроалканов R—N02). Нитрующий реагент - азотная кислота HN03(HO—N02)
— Сульфирование (замещение атома водорода сульфо-группой — S03H с образованием алкансульфокнслот RSO3H). Сульфирующий реагент — серная кислота H2S04 (HO-S03H). Сульфирование алканов происходит при действии очень концентрированной H2S04 при небольшом нагревании.
2. Реакции окисления. При обычных условиях алканы устойчивы к действию окислителей (КМnO4, К2Сг2O7).
-Окисление кислородом воздуха при высоких температурах (горение):
а) полное окисление (избыток O2) с образованием углекислого газа и воды: СН4 +202→ С02+ 2Н2O
б) неполное окисление (недостаток 02): СН4 +202→ СO+ 4Н2O
СН4 +202→ С+ 2Н2O
-Окисление кислородом воздуха при невысоких температурах в присутствии катализаторов (неполное каталитическое окисление). В результате могут образоваться альдегиды, кетоны, спирты, карбоновые кислоты. Неполное окисление может происходить без разрыва углеродной цепи и с разрывом углеродной цепи.
3. Термические превращения алканов:
—Крекинг — это разрыв связей С—С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
—Дегидрирование — отщепление водорода; происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах.
—Дегидроциклизация — ароматизация, дегидрирование алканов с образованием ароматических соединений.
—Изомеризация — превращение химического соединения в его изомер.
Нахождение в природе: Основные источники алканов – нефть и природный газ. Метан составляет основную массу природного газа, в нем присутствуют также в небольших количествах этан, пропан и бутан. Метан содержится в выделениях болот и угольных пластов. Наряду с легкими гомологами метан присутствует в попутных нефтяных газах. Эти газы растворены в нефти под давлением и находятся также над ней. Алканы составляют значительную часть продуктов переработки нефти. Содержатся в нефти и циклоалканы – они называются нафтенами. В природе широко распространены также газовые гидраты алканов, в основном метана, они залегают в осадочных породах на материках и на дне океанов.
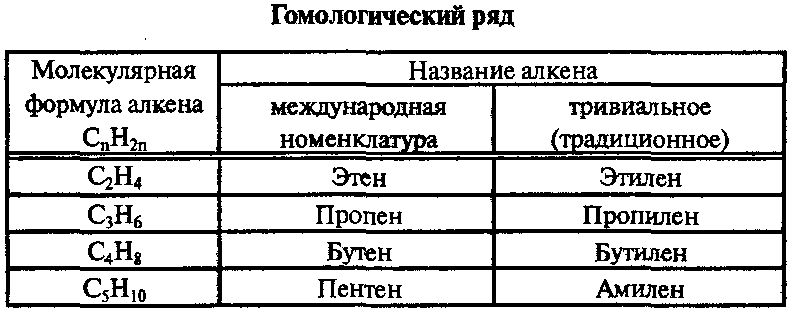
АЛКЕНЫ (олефины, этиленовые УВ) CnH2n, n≥2
Алкены — это нециклические УВ, в молекулах которых два атома углерода находятся в состоянии sp2-гибридизации и связаны друг с другом двойной связью.
Изомерия и номенклатура
Для алкенов возможны 3 типа изомерии: изомерия углеродной цепи, изомерия положения двойной связи, цис-транс-изомерия. Первые 2 члена гомологического ряда — этен и пропен — изомеров, относящихся к классу алкенов, не имеют.
По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2— «аллил».
Физические свойства:
Плохо
растворимы в воде.![]()
Химические свойства:
Алкены обладают большей реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи.
1.Реакции присоединения:
—Присоединение водорода (+H2) — гидрирование, образуются алканы.
—Присоединение галогенов — галогенирование, образуются дигалогеналканы.
—Присоединение галогеноводородов (+ННа1) — гидрога-логенирование, образуются моногалогеналканы.
—Присоединение воды (+Н20) — гидратация, образуются предельные одноатомные спирты алканолы.
2. Реакции окисления.
—Горение:
а) полное окисление (избыток O2): С2Н4 +302→2С02+ 2Н2O
б) неполное окисление (недостаток 02): С2Н4 +202→ 2СO+ 2Н2O
С2Н4 +02→2С+ 2Н2O
—Взаимодействие с 02в присутствии катализатора (образуются эпоксиды).
—Неполное окисление под действием окислителей типа КМnO4, К2Сг2O7. При действии разбавленного водного раствора КМnO4 в щелочной среде происходит гидроксидирование алкенов (введение гидроксогруппы) с образованием диолов (реакция Е. Е. Вагнера).
3.Реакции полимеризации
Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием высокомолекулярного соединения (полимера).
nСН2 = СН2 → (—СН2-СН2—)n, где n — степень полимеризации (число молекул мономера)
Нахождение в природе: В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений — этилен (C2H4) — является гормоном для растений и в незначительном количестве в них синтезируется.
АЛКАДИЕНЫ (диеновые УВ) — это УВ, в молекулах которых между атомами углерода имеются две двойные связи. Общая формула: CnH2n-2, n≥3
Изомерия и номенклатура:
Структурная изомерия цепи, структурная изомерия взаимного положения двойных связей, пространственная изомерия, межклассовая изомерия
Химические свойства
1. Реакции присоединения: например, присоединение галогенов:
2.Реакция полимеризации
Нахождение в природе:
АЛКИНЫ (ацетиленовые УВ) CnH2n-2, n≥2
Алкины
— это углеводороды, в молекулах которых
два атома углерода находятся в состоянии
sp-гибридизации
и связаны друг с другом тройной связью.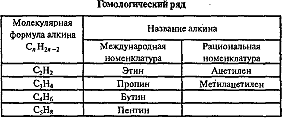
Изомерия н номенклатура
Существует 2 типа изомерии алкинов: изомерия положения тройной связи и изомерия цепи. Первые два члена гомологического ряда — этин и пропин — изомеров не имеют. По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами. Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Физические
свойства![]()
Химические свойства
Алкины во многих реакциях обладают большей реакционной способностью, чем алкены.
1.Реакции присоединения:
—Присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени — алканы
—Присоединение галогенов (галогенирование). На I ступени образуются дигалогеналкены, на II — тетрагалогеналканы.
Реакция алкинов с бромной водой — качественная реакция на алкины. Бромная вода обесцвечивается.
—Присоединение галогеноводородов (гидрогалогенирование). На I ступени образуются моногалогеналкены, на II —дигалогеналканы.
—Присоединение воды (гидратация). Происходит по правилу Марковникова. Ацетилен образует альдегид, его гомологи — кетоны (реакция М.Г. Кучерова):
2.Реакции окисления
—Горение (полное окисление)
2С2Н2 + 5О2 →4СО2 + 2Н2О
—Неполное окисление (под действием окислителей типа КМnO4, К2Сг2O7)
При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сг2O7 в кислой среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена). Конечным продуктом реакции являются карбоновые кислоты.
Реакция с КМnO4 является качественной реакцией на алкины. Раствор КМnO4 обесцвечивается.
3.Реакции полимеризации
Алкины могут образовывать линейные димеры, тримеры и полимеры, циклические тримеры.
4.Реакции замещения атомов «Н», связанных с sp-гибридизованными атомами углерода
Атомы водорода, связанные с sp-гибридизованными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется поляризацией связи ≡С—Н. В связи с этим данные атомы водорода могут замешаться атомами металлов, в результате чего образуются ацетилениды. Способность к таким реакциям отличает алкины от других непредельных углеводородов.
Нахождение в природе: В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Реакции полимеризации и сополимеризации олефинов. Натуральный и синтетический каучуки понятие о высокомолекулярных соединениях.
Реакции полимеризации. Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием высокомолекулярного соединения (полимера).
nСН2 = СН2 → (—СН2-СН2—)n, где n — степень полимеризации (число молекул мономера)
Реакция сополимеризации — процесс образования полимеров из двух или нескольких различных мономеров
Каучуки — природные или синтетические продукты полимеризации некоторых диеновых углеводородов с сопряженными связями. Важнейшими физическими свойствами каучуков являются: эластичность (т. е. способность восстанавливать форму); непроницаемость для воды и газов.
Природный каучук.
Высокомолекулярный углеводород (C5H8)n, цис- полимер изопрена; содержится в млечном соке (латексе) гевеи, кок-сагыза (разновидности одуванчика) и других растений. Растворим в углеводородах и их производных (бензине, бензоле, хлороформе, сероуглероде и т. д.). В воде, спирте, ацетоне натуральный каучук практически не набухает и не растворяется. Уже при комнатной температуре натуральный каучук присоединяет кислород, происходит окислительная деструкция (старение каучука), при этом уменьшается его прочность и эластичность. При температуре выше 200 °C натуральный каучук разлагается с образованием низкомолекулярных углеводородов. При взаимодействии натурального каучука с серой, хлористой серой, органическими пероксидами (вулканизация) происходит соединение через атомы серы длинных макромолекулярных связей с образованием сетчатых структур. Это придает каучуку высокую эластичность в широком интервале температур. Натуральный каучук перерабатывают в резину. В сыром виде применяют не более 1 % добываемого натурального каучука (резиновый клей). Более 60 % натурального каучука используют для изготовления автомобильных шин. В промышленных масштабах натуральный каучук производится в Индонезии, Малайзии, Вьетнаме.
Синтетические каучуки
Первым синтетическим каучуком, имевшим промышленное значение, был полибутадиеновый (дивиниловый) каучук, производившийся синтезом по методу С. В. Лебедева (анионная полимеризация жидкого бутадиена в присутствии натрия), однако из-за невысоких механических качеств нашёл ограниченное применение.
В Германии бутадиен-натриевый каучук нашёл довольно широкое применение под названием «Буна».
Изопреновые каучуки — синтетические каучуки, получаемые полимеризацией изопрена в присутствии катализаторов — металлического лития, перекисных соединений. В отличие от других синтетических каучуков изопреновые каучуки, подобно натуральному каучуку, обладают высокой клейкостью и незначительно уступают ему в эластичности.
В настоящее время большая часть производимых каучуков является бутадиен-стирольными или бутадиен-стирол-акрилонитрильными сополимерами.
Каучуки с гетероатомами в качестве заместителей или имеющими их в своём составе часто характеризуются высокой стойкостью к действию растворителей, топлив и масел, устойчивостью к действию солнечного света, но обладают худшими механическими свойствами. Наиболее массовым в производстве и применении каучуками с гетерозаместителями являются хлоропреновые каучуки (неопрен) — полимеры 2-хлорбутадиена.
В ограниченном масштабе производятся и используются тиоколы — полисульфидные каучуки, получаемые поликонденсацией дигалогеналканов (1,2-дихлорэтана, 1,2-дихлорпропана) и полисульфидов щелочных металлов.
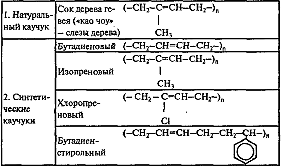
Высокомолекулярные соединения ВМС (полимеры) — неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере (степень полимеризации) должно быть достаточно велико. Во многих случаях количество звеньев может считаться достаточным, чтобы отнести молекулу к полимерам, если при добавлении очередного мономерного звена молекулярные свойства не изменяются. Как правило, полимеры — вещества с молекулярной массой от нескольких тысяч до нескольких миллионов.
Циклоалканы, циклоалкены. циклоалкадиены. Понятие об особенностях строения и химические свойства соединений с большими и малыми циклами. Нахождение в природе и промышленное значение. Терпены, каротиноиды, ликопин, каротин, витамины А и Д.
Циклоалканы — это насыщенные углеводороды, содержащие цикл нз 3, 4, 5, 6 н более атомов углерода. CnH2n, n≥3
Физические свойства
Циклопропан, циклобутан — газообразные вещества. Циклопентан, циклогексан — жидкие вещества, высшие циклоалканы — твердые вещества. Все циклоалканы плохо растворимы в воде.
Химические свойства
Для циклоалканов характерны все химические свойства насыщенных углеводородов: реакции замещения, отщепления (дегидрирование), разложения и окисления. В отличие от алканов для циклоалканов возможны реакции присоединения
Получение: из нефти (входят в состав нафтеновых нефтей), дегалогенирование
Br-СН2-СН2-СН2-Br + Mg = циклопропан + MgBr2
Гидрирование ароматических углеводородов (катализатор, давление, температура)
С6Н6 +3Н2 = С6Н12.
Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены. Из циклопарафинов практическое значение имеют циклогексан, митилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды — в бензол, толуол и другие вещества, которые широко используют для синтеза красителей, медикаментов и т.д. Циклопропан применяют для наркоза.
Терпены — класс углеводородов — продуктов биосинтеза общей формулы (C5H8)n, с углеродным скелетом, формально являющихся производным изопрена СН2=С(СН3)-СН=СН2. В больших количествах терпены содержатся в растениях семейства хвойные, во многих эфирных маслах. Терпены — основной компонент смол и бальзамов, так, скипидар получают из живицы. Название «Терпены» происходит от лат. Oleum Terebinthinae — скипидар. Низшие терпены — прозрачные летучие жидкости, обладающие индивидуальными запахами, липофильные и мало растворимые в воде. Терпены — лабильные вещества, склонны к изомерии и окислению, в том числе кислородом воздуха.
Каротиноиды — тетратерпены и тетратерпеноиды, формально являющиеся производными — продуктами гидрирования, дегидрирования, циклизации, окисления либо их комбинации ациклического предшественника — Ψ,Ψ-каротина (ликопина); ретиноиды к каротиноидам не относятся. К каротиноидам также относят каротины, ксантофиллы и некоторые продукты циклизации и потери части углеродного скелета ликопина. Каротиноидами являются природные органические пигменты, синтезируемые бактериями, грибами, водорослями, высшими растениями и коралловыми полипами, окрашеные в жёлтый, оранжевый или красный цвета.
Ликопин — каротиноидный пигмент, определяющий окраску плодов некоторых растений, например томатов, гуавы, арбуза. Не растворим в воде. Молекулярная формула: C40H56. Ликопин содержится во многих красно-оранжевых частях растений, это главный компонент, определяющий красный цвет плодов томатов. Ликопин является нециклическим изомером бета-каротина. Защищает части растения от солнечного света и окислительного стресса. В клетках растений ликопин выступает как предшественник всех остальных каротиноидов, включая бета-каротин.
Каротин — жёлто-оранжевый пигмент, непредельный углеводород из группы каротиноидов.
Эмпирическая формула С40H56. Нерастворим в воде, но растворяется в органических растворителях. Содержится в листьях всех растений, а также в корне моркови, плодах шиповника и др. Является провитамином витамина А.
Ретинол (истинный витамин A) — жирорастворимый витамин, антиоксидант. В чистом виде нестабилен, встречается, как в растительных продуктах, так и в животных источниках. Поэтому производится и используется в формах ретинола ацетата и ретинола пальмитата. Также может быть синтезирован организмом из бета-каротина. Необходим для зрения и костей, а также здоровья кожи, волос и работы иммунной системы.
Витамин D — группа биологически активных веществ (в том числе эргокальциферол и холекальциферол). Витамины группы D являются незаменимой частью пищевого рациона человека. Суточная потребность: 10-25 мкг.
Растворим в жирах. Состоит из феролов, приобретающих активность при ультрафиолетовом облучении.
Витамин D регулирует усвоение минералов кальция и фосфора, уровень содержания их в крови и поступление их в костную ткань и зубы.
Арены. Современные представления о строении бензола. Понятие об ароматическом характере. Гомологический ряд бензола. Изомерия, номенклатура. Источники получения. Физические свойства бензола и его гомологов. Химические свойства. Понятие о многоядерных углеводородах. Канцерогенные вещества.
Ароматические УВ (АРЕНЫ) — это УВ, молекулы которых содержат одно или несколько бензольных колец. CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода. Атомы углерода в бензоле находятся в состоянии sp2-гибридизации. Каждый атом «С» образует три ϭ-связи (две с атомами углерода и одну с атомом водорода). Все ϭ-связи находятся в одной плоскости. Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости ϭ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система. Сочетание шести ϭ-связей с единой π-системой называется ароматической связью. Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром. В соответствии с современными представляениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:
Н
|

I
Ароматический характер бензола определяется химическими свойствами, зависящими от его химического строения. Таким образом, ароматический характер бензола выражается в том, что это соединение, по составу являясь непредельным, в целом ряде химических реакций проявляет себя как предельное соединение; для него характерны химическая устойчивость, трудность реакций присоединения. Только в особых условиях (катализаторы, облучение) бензол ведет себя так, как будто в его молекуле имеются три двойные связи.
Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 — метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5-С2Н5 — этилбензол и т.д.
Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими.
Ароматические одновалентные радикалы имеют общее название "арил". Из них наиболее распространены в номенклатуре органических соединений два: C6H5- (фенил) и C6H5CH2- (бензил).
Изомерия (структурная):
1) положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы);
2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода:
3) изомерия заместителей R, начиная с R = С2Н5.
Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; tпл=5,5°С, tкип=80°С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства
1.Реакции замещения
—Галогенирование
—Нитрование. Реакцию осуществляют смесью концентрированных азотной HN03 и серной H2S04 кислот (нитрующая смесь):
—Сульфирование
—Алкилирование (замещение атома «Н» на алкильную группу) — реакции Фриделя—Крафтеа, образуются гомологи бензола. Вместо галогеналканов можно использовать алкены (в присутствии катализатора — А1С13 или неорганической кислоты).
2.Реакции присоединения
—Гидрирование
—Присоединение хлора
3.Реакции окисления
—Горение
С6Н6 + 15О2 →12СО2 + 6Н2О
—Неполное окисление (КМnO4 или К2Сг2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
1. В промышленности:
-переработка нефти и угля;
-дегидрирование циклогексана;
-дегидроциклизация (ароматизация) гексана;
-тримеризация ацетилена
2. В лаборатории
Сплавление солей бензойной кислоты с щелочами:
Ароматические соединения, содержащие в своих молекулах несколько бензольных ядер, называют многоядерными. В зависимости от способа соединения этих ядер между собой различают соединения с неконденсированными и конденсированными бензольными ядрами.
Канцерогенные вещества — бластомогенные вещества, канцерогены, карциногены, химические соединения, способные при воздействии на организм вызывать рак. Известно несколько канцерогенных веществ, принадлежащих к разным классам химических соединений. Так, к сильным канцерогенным веществам относятся некоторые полициклические углеводороды с группировкой фенантрена в молекуле, азокрасители, ароматические амины, нитрозамины и др. алкилирующие соединения. К. в. найдены в составе некоторых промышленных продуктов, в воздухе, загрязнённом промышленными выбросами, в табачном дыме и др.
Гетероциклические соединения. Классификация, ароматические и неароматические гетероциклы. Понятие о строении, свойствах и биологической активности гетероциклов (пиррол, тиофен, фуран, пиридин). Понятие о гетероцикле с несколькими гетероатомами (имидазол, пиримидин, пурин) и об алкалоидах (никотин).
Гетероциклические соединения (гетероциклы) — органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов.
Ароматические гетероциклы представляют собой плоские циклические системы, содержащие вместо одного или нескольких атомов углерода, атомы кислорода, серы, азота.
Среди ароматических гетероциклических соединений наиболее широко распространены и, соответственно, представляют наибольший интерес, пяти- и шести-членные гетероциклы, включающие в своем составе азот, серу и кислород, а также эти же системы, конденсированные с бензольным кольцом. К пятичленным циклическим системам с одним гетероатомом относятся: пиррол, фуран и тиофен:
Пиррол — ароматический пятичленный азотистый гетероцикл, обладает слабыми основными свойствами. Содержится в костном масле (которое получают при сухой перегонке костей), а также в каменноугольной смоле. Пиррольные кольца входят в состав порфиринов — хлорофилла растений, гема гемоглобинов и цитохромов и ряда других биологически важных соединений. Пиррол представляет собой бесцветную жидкость, напоминающую по запаху хлороформ, медленно темнеющую при стоянии на воздухе. Он слегка гигроскопичен, немного растворим в воде и хорошо растворим в большинстве органических растворителей. Химическая формула C4H5N.
Тиофен (тиофуран) — ароматический пятичленный гетероцикл, содержащий один атом серы в цикле, бесцветная жидкость с запахом бензола. Химическая формула C4H4S.
Фуран — органическое соединение с формулой C4H4O. Пятичленный гетероцикл с одним атомом кислорода. Представляет собой бесцветную жидкость с характерным запахом. Родоначальник большой группы органических соединений, многие из которых имеют практическое значение.
Пиридин — шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения. Химическая формула C5H5N.
Имидазол — органическое соединение класса гетероциклов, пятичленный цикл с двумя атомами азота и тремя атомами углерода в цикле, изомерен пиразолу. Химическая формула C3H4N2
Пиримидин (C4N2H4, 1,3- или м-диазин, миазин) — гетероциклическое соединение, имеющее плоскую молекулу, простейший представитель 1,3-диазинов. Пиримидин — бесцветные кристаллы с характерным запахом.
Пурин (C5N4H4, Purine) — гетероциклическое соединение, простейший представитель имидазо[4,5-d]пиримидинов. Производные пурина играют важную роль в химии природных соединений (пуриновые основания ДНК и РНК; кофермент NAD; алкалоиды, кофеин, теофиллин и теобромин; токсины, сакситоксин и родственные соединения; мочевая кислота) и, благодаря этому, в фармацевтике.
Никотин — алкалоид, содержащийся в растениях семейства паслёновых, преимущественно в табаке и, в меньших количествах, в томатах, картофеле, баклажанах, зелёном перце. Никотиновые алкалоиды также присутствуют в листьях коки. Никотин составляет от 0,3 до 5 % от массы табака в сухом виде, биосинтез никотина происходит в корнях, накапливание никотина — в листьях. Никотин — сильнодействующий нейротоксин и кардиотоксин, особенно действующий на насекомых; вследствие этого никотин раньше широко использовался как инсектицид, а в настоящее время в том же качестве продолжают использоваться производные никотина — такие, как, например, имидаклоприд. формула C10H14N2
Галогенопроизводные, классификация, изомерия и номенклатура. Общая характеристика физических и химических свойств. Промышленное использование галогенопроизводных. Фреоны. Проблема сохранения озонового слоя Земли. Понятие о хлорсодержащих пестицидах.
Галогенопроизводные — соединения, содержащие в составе один или несколько атомов галогена, кроме углерода и водорода. Общая формула ГП: R–Hal, где Hal – F,Cl,Br,J.
Классификация галогенопроизводных:
—Моногалогенопроизводное (Если в составе соединения один галоген, например C2H5Cl)
—Полигалогенопроизводное (Если в составе соединения два и более галогена, например C2H4Cl2,CCl4)
Номенклатура, изомерия
Для галогенпроизводных характерна изомерия положения углеродной цепи и изомерия положения галогена
По рациональной номенклатуре название галогенопроизводных образуют из названия углеводородного радикала и галогена, в необходимых случаях указывают положение последнего.

По систематической номенклатуре положение атома галогена указывают цифрой, которая вместе с его названием располагается перед названием радикала. Нумерацию атомов углерода начинают с того конца молекулы, к которому ближе расположен атом галогена.

Физические свойства
Галогенопроизводные - бесцветные вещества, нерастворимые в воде, но растворимые в большинстве органических растворителей. Алкилгалогениды обладают анестезирующим действием, в больших концентрациях они токсичны. Бензилгалогениды являются слезоточивыми веществами (лакриматорами).
Химические свойства
Галогенопроизводные широко используются в органическом синтезе. В этой связи следует выделить три основные группы реакций: реакции нуклеофильного замещения, реакции элиминирования (отщепления) и реакции с участием металлов.
1.Реакции нуклеофильного замещения атома галогена. Реакции нуклеофильного замещения атома галогена в галогенопроизводных могут быть представлены следующими схемами:
R - X + Y→ R - Y + X или R - X + Y→ R - Y + X
где R — углеводородный остаток; X = F, Cl, Br, I; Y — нуклеофил.
Нуклеофилом может быть как анион OH RO RS Hal CN, так и нейтральная молекула, имеющая неподеленную электронную пару: HOH, ROH, NH3, HHal, RNH2, RSH
Обозначаются реакции нуклеофильного замещения символом SN, где S- замещение и N- нуклеофильное.
По современным представлениям реакции нуклеофильного замещения могут протекать по двум механизмам: мономолекулярному SN1 и бимолекулярному SN2.
Механизм SN2
Этот механизм характерен для первичных алкилгалогенидов.
Реакция замещения происходит в результате постепенного вытеснения старой группы новой группой. Образование новой и разрыв старой связи происходит одновременно.
Механизм SN1
Мономолекулярный механизм характерен для первичных алкилгалогенидов и галогенидов аллильного и бензильного типа.
При мономолекулярном механизме сначала происходит ионизация связи углерод - галоген, а затем нуклеофил быстро взаимодействует с карбкатионом.
Соединения с вторичными радикалами могут реагировать по двум механизмам.
Фреоны — галогеноалканы, фтор- и хлорсодержащие производные насыщенных углеводородов (главным образом метана и этана), используемые как хладагенты в холодильных машинах (например, в кондиционерах). Кроме атомов фтора, в молекулах фреонов содержатся обычно атомы хлора, реже — брома. Известно более 40 различных фреонов; большинство из них выпускается промышленностью. Фреоны — бесцветные газы или жидкости, без запаха. Хорошо растворимы в неполярных органических растворителях, очень плохо — в воде и полярных растворителях. Фреоны очень инертны в химическом отношении, поэтому они не горят на воздухе, невзрывоопасны даже при контакте с открытым пламенем. Однако при нагревании фреонов свыше 250 °C образуются весьма ядовитые продукты, например фосген COCl2, который в годы первой мировой войны использовался как боевое отравляющее вещество. Устойчивы к действию кислот и щелочей.
Второй (после потепления климата) глобальной экологической проблемой, связанной с антропогенным загрязнением атмосферы является истощение озонового слоя Земли. Доля озона в атмосфере крайне мала - всего несколько десятимиллионных долей от объема атмосферы, но он играет защитную роль, поглощая опасное для всего живого жесткое ультрафиолетовое излучение Солнца. Озоносфера представляет собой слой озона в пределах стратосферы (на высоте 10-50 км), отличающийся повышенным содержанием озона, причем его максимальная концентрация наблюдается на высоте 20-25 км, где озона в 10 раз больше, чем у земной поверхности. Наиболее опасными для человека последствиями истощения озонового слоя является увеличение числа заболеваний раком кожи и катарактой глаз. Истощение озонового слоя ведет к усилению парникового эффекта, снижению урожайности, деградации почв, общему загрязнению окружающей среды. Основным антропогенным фактором, разрушающим озон, в настоящее время считают фреоны (хладоны). К ним относятся хлорфторуглероды, широко используемые как газы-носители (пропилленты) в различного рода баллончиках, холодильных установках и т. п. Благодаря своей высокой устойчивости (живут более 100 лет) фреоны оказались способными достигать озонового слоя и высвобождать там атомы хлора. Один атом хлора как катализатор способен разрушить до 100 тысяч атомов озона.
Спирты, классификация, гомологические ряды одно- и многоатомных спиртов. Изомерия. Номенклатура. Способы получения. Физические свойства. Водородная связь. Химические свойства. Понятие о предельных спиртах и спиртах высшей атомности.
СПИРТЫ (алкоголи) — это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп — ОН у насыщенных атомов углерода. R(OH)m, m≥1
Классификация спиртов по строению УВ радикала:
—Предельные (алканолы)
—Непредельные (алкенолы, алкинолы)
—Ароматические
Классификация спиртов по атомности:
—Одноатомные (олы)
—Многатомные: двухатомные (диолы), трехатомные (триолы)
Предельные одноатомные спирты (алканолы) СnН2n+1ОН, n≥1
Гомологический ряд
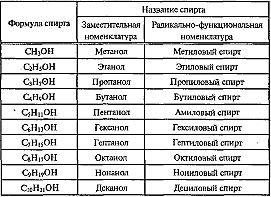
Изомерия и номенклатура
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Первые два члена гомологического ряда — СН3ОН и С2Н5ОН — не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
— изомерия цепи (углеродного скелета);
— изомерия положения функциональной группы —ОН
Спирты изомерны другому классу соединений — простым эфирам (R-O-R'):
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов. Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностью (О, N, F, О) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои не поделенные электронные пары, тем легче образуется водородная связь и тем она прочнее.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О—Н, С—О, С—Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
1. Реакции замещения
—Замещение атома водорода гидроксильной группы вследствие разрыва связи 0—Н.
а) Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов. Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются.
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации). Реакции этерификации являются обратимыми реакциями.
—Замещение гидроксильной группы вследствие разрыва связи С—О.
а) Взаимодействие с галогеноводородами с образованием галогеналканов.
б) Взаимодействие с аммиаком с образованием аминов.
2. Реакции отщепления
—Дегидратация, т. е. отщепление воды.
Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—О—R'. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов.
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта.
—Дегидрирование (разрыв связей О—Н и С—Н)
а) При дегидрировании первичных спиртов образуются альдегиды;
б) При дегидрировании вторичных спиртов образуются кетоны.
в) Третичные спирты не дегидрируются.
3. Реакции окисления
—Горение (полное окисление). Спирты горят на воздухе с выделением большого количества тепла (на этом основано использование спиртовок).
—Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов. Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
Предельные многоатомные спирты
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта — глицерина, или пропантриола-1,2,3
Физические свойства
Глицерин — вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с Гкип = 290DC. Смешивается с водой во всех отношениях.
Химические свойства
1. Замещение атомов водорода гидроксильных групп
Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами; при этом могут образовываться моно-, ди- и тризамещенные продукты.
2. Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов. Продуктами этих реакций являются внутри комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Me—О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи за счет неподеленных электронных пар атомов кислорода других ОН-групп.
3. Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
2. Замещение гидроксильных групп
Наиболее известными реакциями этого типа является взаимодействие многоатомных спиртов с галогеноводородами.
Фенолы. Классификация. Одноатомные фенолы: физические свойства и общая характеристика химических свойств. Фенол и гидрохинон, применение их в промышленности. Реакции поликонденсации. Фенолоформальдегидные полимеры.
ФЕНОЛЫ — это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца.
Фенолы:
— Одноатомные (аренолы АгОН, где Аг — арил, т. е. одновалентный радикал ароматического УВ)
— Двухатомные (арендиолы)
— Трехатомные (арентриолы)
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол С6Н5ОН (карболовая кислота) — бесцветное кристаллическое вещество, tпл= 43°С, tкип = 182°С, на воздухе окисляется и становится розовым, при обычной тем пературе ограниченно растворим в воде, выше 66° С смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы — ОН и бензольного кольца.
1.Реакции с участием гидроксильной группы
Кислотные свойства
1.Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода.
2.Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
3.Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров фенола.
2.Реакции с участием бензольного кольца
Реакции замещения
Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
1) Галогенирование
2) Нитрование
3) Сульфирование
Применение фенола
- Синтетические смолы и пластмассы
- Красители
- Взрывчатые вещества
- Антисептик — 3—5%-й раствор используется для дезинфекции
- Синтез лекарственных препаратов
Применение гидрохинона:
Применяется в фотографии как проявляющее вещество, в синтезе органических красителей как антиоксидант и др.
В косметических препаратах ранее использовался как компонент для отбеливания кожи, но в последние годы практически всюду запрещён из-за высокой опасности для кожи.
Поликонденсация — процесс синтеза полимеров из полифункциональных (чаще всего бифункциональных) соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды, спиртов и т. п.) при взаимодействии функциональных групп.
Фенолформальдегидные полимеры — первые синтетические полимеры, нашедшие практическое применение (1906—1910 гг); получают поликонденсацией фенола и формальдегида в виде олигомерного продукта (вязкой жидкости или легкоплавкой смолы), способного необратимо отверждаться при нагревании. Применяют фенолформальдегидные полимеры для получения слоистых пластиков (бумопласт, текстолит), минераловатных и электрических изделий, водостойких лаков и клеев для деревянных конструкций.
Оксосоединения (карбонильные соединения). Гомологические ряды предельных альдегидов и кетонов. Изомерия и номенклатура ИЮПАК. Строение карбонильной группы. Физические и химические свойства. Формальдегид, ацетальдегид, ацетон, бензальдегид. Понятие об ароматических и непредельных альдегидах и кетонах.
Карбонильные соединения (ОКСОСОЕДИНЕНИЯ) — это производные УВ, содержащие в молекуле карбонильную группу >С=О
Оксосоединения:
-Альдегиды
r
—
предельные, непредельные или
ароматические УВ
радикалы
(как исключение: атом водорода -н).![]()
-Кетоны
r,r'
—
предельные, непредельные
или ароматические УВ
радикалы)![]()
Альдегиды — это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
Кетоны — это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Среди других карбонильных соединений, наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Гомологический ряд

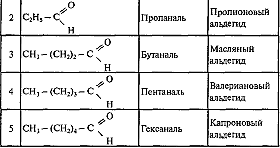
Номенклатура н изомерия
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания -аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
В пределах класса альдегидов возможен только один вид изомерии — изомерия углеродной цепи.
Альдегиды изомерны кетонам
Название кетона по ИЮПАК образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания -он. Кетон – изомерия углеродной цепочки, функциональной группы, межклассовая изомерия с альдегидом.
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O. Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод 3σ-связи (одна из них связь С–О). Одна из трех sp2-орбиталей кислорода участвует в σ-связи С–О, две другие содержат неподеленнные электронные пары. Связь С=О сильно полярна. Ее дипольный момент значительно выше, чем у связи С–О в спиртах. Электроны кратной связи С=О смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
Физические свойства
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8—12 атомов «С», — душистые вещества. Альдегиды с 1—3 атомами «С» хорошо растворяются в воде; с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях. Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых отношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько большую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой.
Химические свойства
1.Реакции присоединения
—Гидрирование (восстановление) с образованием первичных спиртов RCH2OH
— Присоединение
спиртов
с
образованием полуацеталей
![]()
— Присоединение гидросульфита натрия NaHS03 с образованием гидросульфитных производных альдегидов
2.Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: 02 воздуха, подкисленный раствор К2Сг207 или КМn04; слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.). Реакции с аммиачным раствором оксида серебра (I) и щелочным раствором сульфата меди (II) являются качественными реакциями на альдегиды.
3.Реакции полимеризации (характерны для низших альдегидов)
—Линейная полимеризация
—Циклическая полимеризация (тримеризация, тетрамеризация)
4.Реакции поликонденсацин — это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н20, HCI, NH3 и т. д.
Формальдегид — муравьиный альдегид, CH2O, первый член гомологического ряда алифатических альдегидов; бесцветный газ с резким запахом, хорошо растворимый в воде и спирте, tкип = 19 °С. В промышленности Ф. получают окислением метилового спирта или метана кислородом воздуха. Ф. легко полимеризуется (особенно при температурах до 100 °С), поэтому его хранят, транспортируют и используют главным образом в виде формалина и твёрдых низкомолекулярных полимеров – триоксана и параформа.
Ацетальдегид (уксусный альдегид, этаналь, метилформальдегид) — органическое соединение класса альдегидов с химической формулой CH3-CHO. Это один из наиболее важных альдегидов, широко встречающийся в природе и производящийся в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями, как результат их метаболизма. Также производится окислением этанола.
Ацетон (диметилкетон, систематическое наименование: пропан-2-он) — простейший представитель кетонов. Формула: CH3-C(O)-CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом.
Бензойный альдегид (бензальдегид) C6H5CHO — простейший альдегид ароматического ряда, бесцветная жидкость с характерным запахом горького миндаля, желтеющая при хранении и окисляющаяся кислородом воздуха до перекиси бензоила (взрывоопасна), в дальнейшем превращающейся в бензойную кислоту.
Ароматические альдегиды — это ароматические УВ, содержащие альдегидную группу, связанную с углеводородным радикалом.
Непредельные альдегиды, содержащие в радикалах двойные и тройные связи.
