
- •Энергетика и направленность химических процессов
- •4.2. Основные понятия химической термодинамики
- •4.3. Внутренняя энергия системы. Первый закон термодинамики
- •4.4. Термохимия
- •4.4.1. Тепловой эффект химической реакции. Энтальпия
- •4.4.2. Термохимические законы. Термохимические расчеты
- •Стандартные энтальпии образования и стандартные энтальпии сгорания некоторых веществ
- •4.5. Направление течения химических процессов
- •4.5.1. Самопроизвольные процессы
- •4.5.2 Энтропия
- •4.5.3. Расчет изменений энтропии
- •4.5.4. Направление химических реакций в изолированных системах. Второй закон термодинамики
- •4.5.5. Направление химических реакций в неизолированных системах. Энтальпийный и энтропийный факторы химических реакций. Энергия гиббса
- •4.5.6. Расчет величины g
- •4.5.7. Энергия гиббса и температура
Стандартные энтальпии образования и стандартные энтальпии сгорания некоторых веществ
|
Вещество |
fH(298 K), кДж/моль |
cH(298 K), кДж/моль |
|
H2(г) |
0 |
-285,8 |
|
C(графит) |
0 |
-393,5 |
|
CO2(г) |
-393,5 |
0 |
|
H2O(ж) |
-285,8 |
0 |
|
H2O(г) |
-241,8 |
0 |
|
CH4(г) |
-74,8 |
-890,2 |
|
C2H6(г) |
-84,7 |
-1559,7 |
|
C2H5OH(ж) |
-227,6 |
-1366,9 |
|
C6H12O6(т) |
-1274 |
-2816,0 |
Закон Гесса распространяется не только на химические реакции, но и на различные физико-химические процессы, сопровождающиеся энергетическими эффектами: растворение, сольватацию (гидратацию), фазовые превращения (плавление, испарение, возгонка, затвердевание (кристаллизация), конденсация, сублимация) (рис. 4.4).
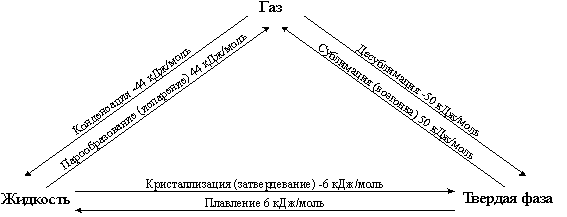
Рис. 4. 4. Схема перехода вещества из одного фазового состояния в другое. Приведены численные значения стандартных энтальпий фазовых переходов для воды.
Закон Гесса и его следствия справедливы и используются также для расчета энергии химической связи, энергии кристаллической решетки, энергии межмолекулярного взаимодействия, энтальпии растворения и сольватации (гидратации) и т.д. Закон Гесса справедлив для тех взаимодействий, которые протекают при постоянном объеме или при постоянном давлении, а единственным видом совершаемой работы является работа против сил внешнего давления. Тепловые эффекты реакций, в результате которых совершается другая работа, например, электрическая работа, не могут быть вычислены по закону Гесса, так как их теплоты являются функциями пути.
4.5. Направление течения химических процессов
При изучении химических процессов прежде всего необходимо установить их принципиальную осуществимость, оценить возможность или невозможность их самопроизвольного протекания при заданных условиях.
4.5.1. Самопроизвольные процессы
Самопроизвольным называется процесс, который осуществляется без затраты работы (энергии) извне. Так, самопроизвольно камни скатываются с горы, теплота передается от более нагретого тела к менее нагретому, а химические реакции достигают состояния равновесия. В обратном направлении самопроизвольный процесс идти не может.
По-видимому, протекание рассмотренных и других процессов определяется какой-то причиной или, как принято говорить, движущей силой. Одной из составляющих (причем наиболее значимой) движущей силы всех (в том числе и химических) самопроизвольно идущих процессов являетсятенденция к понижению энергии системы. При падении камень теряет свою потенциальную энергию, которая в итоге (в момент его удара о землю) превращается в тепловую энергию окружающей среды. Экзотермические реакции, при протекании которых выделяется теплота, сопровождаются уменьшением химической потенциальной энергии. Экзотермические реакции, как правило, идут самопроизвольно.
Однако тенденция к достижению минимальной энергии не является единственным фактором, определяющим направление самопроизвольного процесса. На это указывает возможность самопроизвольного протекания не только экзотермических, но и эндотермических реакций. Так, например, самопроизвольно идут следующие эндотермические процессы:
- растворение хлорида калия в воде:
KCl(т)![]() KCl(р);H(298
К) = 19 кДж/моль;
KCl(р);H(298
К) = 19 кДж/моль;
- плавление льда при комнатной температуре:
H2O(т)= H2O(ж);H(298 K) = 6 кДж/моль;
- испарение воды:
H2O(ж)= H2O(г);H(298 K) = 44 кДж/моль
и другие. В то же время в стандартных условиях невозможно осуществить экзотермический процесс синтеза, например, н-гептана C7H16, протекающего по уравнению:
7C(графит)+ 8H2(г)= C7H16(ж);H(298 K) = -224,39 кДж.
Таким образом, тепловой эффект реакции не является критерием направления течения процесса. Другими словами, первый закон термодинамики не позволяет судить о способности химических процессов к самопроизвольному протеканию.
