
Экспериментальные основы квантовой механики
.pdf
31
Ханс Гейгер1 и Эрнест Марсден были студентами Резерфорда. В 1910 – 1911 гг. они проводили эксперименты, в которых бомбардировали тонкие листки золотой фольги пучком α - частиц (рис. 10). Одни α - частицы проходили первоначального направления (линия В). К всеобщему удивлению, приблизительно 1 из 20 000 частиц отклонялась назад (линия С). «Это было почти столь же невероятно, - рассказывал Резерфорд впоследствии,— как если бы вы стреляли 15-дюймовым снарядом по куску папиросной бумаги, а снаряд рикошетом вернулся назад и попал в вас».
В 1911 г. Э. Резерфорд вывел формулу для эффективного поперечного
Рис. 10. Эксперимент Гейгера и Марсдена:
а – рассеяние α - частиц после пропускания через листок тонкой золотой фольги. Большинство частиц проходят сквозь фольгу без отклонений, но отдельные частицы рикошетируют обратно, по направлению к источнику; б - согласно предположению Резерфорда, рикошетирующие
частицы испытывают столкновение с сердцевиной атома - его ядром. Это наблюдение заставило Резерфорда выдвинуть новую модель строения атома.
1ГЕЙГЕР Ханс (1882-1945), немецкий физик. Изобрел (совместно с Э. Резерфордом, 1908) прибор для регистрации отдельных заряженных частиц (гейгеровский счетчик). Установил (1911) т. н. закон Гейгера — Неттолла — зависимость между вероятностью aльфа-распада и энергией aльфа-частиц.
32
сечения рассеяния нерелятивистских заряженных точечных частиц, взаимодействующих по закону Кулона. Эта формула была получена в системе центра инерции (системе, в которой полный импульс сталкивающихся частиц равен нулю):
|
dσ |
|
Z Z |
e2 |
2 |
1 |
|
|
|
|||||
|
|
|
= |
|
1 |
2 |
|
|
|
|
|
|
, |
( 6-1) |
|
|
|
|
|
|
|
2 |
|
|
|
|
|||
|
|
|
|
|
|
|
4 θ |
|||||||
|
dΩ |
|
|
2mv |
|
|
sin |
|
|
|||||
|
|
|
|
|
|
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где dσ/dΩ - сечение рассеяния в единичный телесный угол, |
|
|||||||||||||
θ - |
угол рассеяния, |
|
|
|
||||||||||
m = m1m2/(m1 + m2) - приведённая масса; |
|
|||||||||||||
m1 |
и m2 - массы сталкивающихся частиц; |
|
||||||||||||
v - |
относительная скорость (разность скоростей частиц); |
|
||||||||||||
Z1e и Z2e - |
электрические заряды частиц, |
|
||||||||||||
е - |
|
элементарный электрический заряд. |
|
|||||||||||
Формула (6-1) была использована Резерфордом при интерпретации опытов по рассеянию α-частиц тонкими металлическими пластинками на большие углы ( > 90°). В результате проведенных опытов Резерфорд пришёл к выводу, что почти вся масса атома сконцентрирована в малом положительно заряженном ядре. Этим открытием были заложены основы современных представлений о строении атома. Необходимо отметить, что формула Резерфорда справедлива не только в классической, но и в квантовой теориях.
На основании результатов этого опыта Э. Резерфорд сделал следующие выводы:
1.В центре атома находится положительно заряженное ядро;
2.Практически вся масса атома сосредоточена в ядре;
3.Размеры ядра очень малы по сравнению с размерами самого атома.
После этого Резерфорд предсказал существование протона и показал, что его масса более чем в 1800 раз должна превышать массу электрона.
В 1911 г. в результате анализа результатов своего опыта Э. Резерфорд предложил свою знаменитую планетарную модель строения атома. Согласно этой модели строение атома можно уподобить строению Солнечной системы. В центре атома находится малое по размерам положительное ядро, в котором сосредоточена практически вся масса атома. Вокруг ядра по круговым орбитам на достаточно большом расстоянии вращаются отрицательно заряженные электроны. Атом в целом электрически нейтрален, поскольку суммарный заряд электронов компенсирует положительный заряд атомного ядра.
33
7.Модель строения атома по Н. Бору
В1913 г. Н. Бор применил идею квантования энергии к теории строения атома, планетарная модель которого следовала из результатов опытов Э. Резерфорда. Рассмотрение такого движения на основе классических представлений приводило к парадоксальному результату — невозможности стабильного существования атомов, поскольку согласно классической электродинамике, электрон не может устойчиво двигаться по орбите, поскольку вращающийся электрический заряд должен излучать электромагнитные волны и, следовательно, терять энергию. Следовательно, радиус его орбиты должен уменьшаться, и за время порядка 10−8 сек электрон должен упасть на ядро. Это означало, что законы классической физики неприменимы к движению электронов в атоме, т.к. атомы существуют и чрезвычайно устойчивы.
Основные положения своей теории Н. Бор сформулировал в виде постулатов:
1- ый постулат Бора.
Электрон в атоме может находиться только в стационарных или квантовых состояниях с дискретными значениями энергии En, в которых атом не излучает энергии. Для стационарных состояний момент количества движения электрона равен целому кратному постоянной Планка:
M = nħ = n (h/2π) |
(7-1) |
2- ой постулат Бора.
При переходе из одного стационарного состояния в другое атом испускает или поглощает квант энергии, частота которого определяется соотношением:
En − Em = hν = ħω |
(7-2) |
Для объяснения устойчивости атомов Н. Бор предположил, что из всех орбит, допускаемых классической механикой для движения электрона в электрическом поле атомного ядра, реально осуществляются лишь те, которые удовлетворяют определённым условиям квантования (рис. 11). Т. е. в атоме существуют (как в осцилляторе) дискретные уровни энергии. Эти уровни подчиняются определённой закономерности, выведенной Бором на основе комбинации законов механики Ньютона с условиями квантования, требующими, чтобы величина действия для классической орбиты была целым кратным постоянной Планка. Бор постулировал, что, находясь на определённом уровне энергии (т. е. совершая допускаемое условиями квантования орбитальное движение), электрон не излучает световых волн. Излучение происходит лишь при переходе электрона с одной орбиты на

34
Рис. 11. Модель строения атома Бора – Зоммерфельда. Иллюстрация из нобелевского доклада Н. Бора. 1922 г.
другую, т. е. с одного уровня энергии En, на другой с меньшей энергией Em, при этом рождается квант света с энергией, равной разности энергий уровней, между которыми осуществляется переход.
Н. Бор применил свою теорию для объяснения строения самого простого из атомов – атома водорода. Он показал, что скорость и, следовательно, кинетическая энергия электрона обратно пропорциональна номеру боровской орбиты n:
v = ω/ħ = e2Z/nħ |
(7-3) |
При этом радиус дозволенной стационарной орбиты оказался прямо пропорционален n2:
r = ħ2n2/m0e2Z
Энергия электрона может быть описана выражением:
E = −m0e4Z 2
2=2n2
Н. Бор получил правильную формулу для частот спектральных линий атома водорода (и водородоподобных атомов), охватывающую совокупность открытых ранее эмпирических формул (см. п. 5 Атомный спектр испускания).
Значение работ Н. Бора чрезвычайно велико. Ему первому из ученых принадлежит поразительно гениальная догадка о том, что поведение субатомных частиц (объектов микромира) не может быть описано законами классической физики, справедливыми для объектов макромира. Это отличие, в первую очередь, состоит в том, что свойства макроскопических систем могут

35
изменяться непрерывно, в то время параметры микроскопических объектов могут претерпевать только скачкообразные изменения. После работ Н. Бора планетарная модель атома – детище безумного эксперимента и могучей интуиции – навсегда утвердилась на квантовом основании. С этого момента началось общепризнанное лидерство Н. Бора в квантовой физике микромира, ставшей философией современного естествознания.
8. Опыт Франка - Герца
Прерывность состояний, свойственная микросистемам, была убедительно доказана Джеймсом Франком1 и Густавом Герцем2 в 1913 - 1916 гг. в результате опыта, явившегося экспериментальным доказательством дискретности внутренней энергии атома. Эти ученые планировали провести эксперимент по измерению потенциалов ионизации атомов ртути, а в результате дали первое опытное подтверждение постулатов Бора, о которых они в то время не имели ни малейшего представления. Используемый в данном опыте прибор (рис. 12) представлял собой электронную лампу с четырьмя электродами (катод K, анод A и две сетки C1 и C2). Испускаемые катодом электроны ускорялись под действием разности потенциалов U в пространстве между C1 и C2. Приложенное к C2 и А запирающее напряжение позволяло попадать на анод лишь электронам с энергией выше 0,5 эВ. Пропуская поток электронов через пары ртути, Дж. Франк и Г. Герц обнаружили, что в зависимости от энергии электронов протекающий ток имеет максимумы и минимумы (рис. 13). Первоначально, пока энергия электронов не превышала 4,9 эВ, сила тока увеличивалась с ростом напряжения, поскольку поток электронов проходил через пары ртути, практически не теряя энергии.
1ФРАНК (Franck) Джеймс (1882-1964), немецкий физик, иностранный членкорреспондент АН СССР (1927). С 1935 г. работал в США. Автор (совместно с Г. Герцем) классических исследований столкновений электронов с атомами (опыт Франка — Герца, 1913). Труды по молекулярной спектроскопии, фотосинтезу. Выступал против применения ядерного оружия. Нобелевская премия (1925, совместно с Г. Герцем).
2ГЕРЦ Густав (1887-1975), немецкий физик, иностранный член АН СССР
(1958). В 1945-1954 гг. работал в СССР. Племянник Генриха Герца. Исследовал столкновения электронов с атомами (опыт Франка — Герца, 1913). Разработал диффузионный метод разделения изотопов. Нобелевская премия (1925, совместно с Дж. Франком), Государственная премия СССР (1951).

36
Рис. 12. Схема опыта Франка — Герца: в сосуде Л находятся пары ртути при давлении 1 мм рт. ст.; К — накаливаемый катод; С1 и С2 — ускоряющая и замедляющая сетки; А — анод; ток регистрируется гальванометром Г.
При достижении значения U = 4,9 В (и кратных ему величин 9,8 В и 14,7 В) наблюдались резкие спады тока (рис. 13). Первоначально Франк и Герц неправильно истолковали результаты своего эксперимента. Они полагали, что при энергии электронов, меньшей критического значения 4,9 эВ, происходят упругие столкновения, при которых не наблюдается ионизации атомов. Ионизация атомов начинается, когда энергия электронов превышает
Рис. 13. Зависимость силы тока от величины ускоряющего потенциала I = f (U) в опыте Франка — Герца.
37
критический уровень. Такая интерпретация не позволяла объяснить прекращения ионизации при дальнейшем возрастании энергии электронов.
Экспериментаторы сделали вывод, что потенциал ионизации атомов ртути кратен 4,9 эВ. Однако тщательный анализ показал, что никаких ионов ртути в трубе не содержится.
Иное толкование результатов этого опыта дал Н. Бор. При бомбардировке электронами с энергией, кратной 4,9 эВ, атомы Hg переходят из основного энергетического состояния в возбужденное, с более высокой энергией. Это определённым образом указывало на то, что при этих значениях U соударения электронов с атомами носят неупругий характер, т. е. энергия электронов достаточна для возбуждения атомов Hg. При кратных 4,9 эВ значениях энергии электроны могут испытывать неупругие столкновения несколько раз. Таким образом, было доказано, что энергия атома изменяется не непрерывным образом, а скачкообразно и E = 4,9 эВ – наименьшая порция энергии, которая может быть поглощена атомом Hg, находящимся в основном состоянии. Этот факт доказывал прерывность возможных значений внутренней энергии электронов в атомах ртути.
Согласно теории Н. Бора, при возвращении возбужденных атомов Hg в исходное устойчивое состояние должно происходить излучение квантов света с большой частотой. Действительно, последующие исследования позволили обнаружить, что при воздействии электронов на атомы ртути возникает ультрафиолетовое излучение с длиной волны λ = 2520 нм.
Таким образом, опыт Франка – Герца явился первым экспериментом, подтверждающим справедливость первого постулата Бора о существовании стабильных дискретных энергетических состояний электрона в изолированном атоме.
9. Дифракция электронов. Опыт Дэвиссона — Джермера
Как известно, дифракция рентгеновских лучей в кристаллах осуществляется при помощи трех различных методов – Лауэ, Брэгга и Дебая – Шерера. Метод Лауэ, при помощи которого исторически впервые была осуществлена дифракция рентгеновских лучей в кристаллах, заключается в том, что узкий пучок рентгеновских лучей, имеющих сплошной спектр, пропускается через кристалл. Однако в случае дифракции электронов получение пучка с набором скоростей, распределенных непрерывным образом, экспериментально невозможно. Частицы, вылетающие из электронной пушки, имеют практически одну и ту же скорость. Точнее говоря, обладают распределением скоростей в узких пределах. Направляя такой поток

38
электронов на кристалл, вообще говоря, не удовлетворяются условия, необходимые для осуществления интерференции Лауэ.
Практически эксперимент с дифракцией электронов, аналогичный опыту Лауэ, в 1927 г. был поставлен американскими физиками К. Дж. Дэвиссоном1 и Л. Х. Джермером2 . При этом им пришлось шаг за шагом отыскивать условия, при которых возникает максимум, соответствующий определенному интерференционному пучку, непрерывно меняя скорость электронов (величину ускоряющего потенциала) и положение коллектора, регистрирующего отраженные от кристалла электроны.
Монокристалл никеля, структура которого принадлежит к кубической сингонии, был сошлифован, как показано на рис. 14. Плоскость шлифовки была
Рис. 14. Схема опыта Дэвиссона — Джермера: К — монокристалл никеля; А — источник электронов; В — приёмник электронов; θ - угол отклонения электронных пучков. Пучок электронов падает перпендикулярно отшлифованной плоскости кристалла S. При поворотах кристалла вокруг оси О гальванометр, присоединённый к приёмнику В, даёт периодически возникающие максимумы.
31ДЭВИССОН (Дейвиссон) (Davisson) Клинтон Джозеф (1881-1958), американский физик. Открыл (1927, совместно с американским физиком Л. Джермером и независимо от Дж. П. Томсона) дифракцию электронов на кристалле никеля (опыт Дэвиссона и Джермера). Нобелевская премия (1937, совместно с Дж. П. Томсоном).
32ДЖЕРМЕР (Germer) Лестер Халберт (1896), американский физик. Окончил Корнеллский университет (1917). В 1927 г. совместно с К. Дэвиссоном открыл явление дифракции электронов на монокристалле никеля.
39
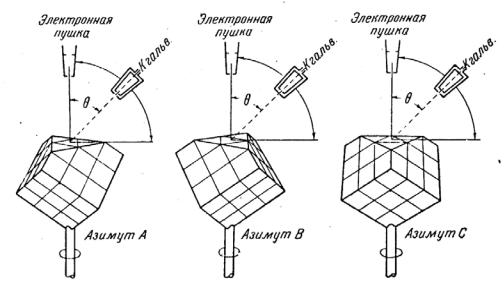
расположена параллельно кристаллографической плоскости с индексами (111). На рис. 15 показаны характерные азимутальные положения сошлифованного монокристалла никеля. При одном из таких положений (азимут А) плоскость, проходящая через пучок и ось коллектора, проходит через одну из вершин
треугольника. В другом случае (азимут В) – она делит сторону треугольника пополам. При третьем положении (азимут С) – она параллельна стороне треугольника.
Рис. 15. Схема, демонстрирующая расположение плоскости шлифа относительно электронного пучка и коллектора отраженных электронов.
Различия между условиями опыта в трех этих опытах иллюстрирует рис. 16. Сошлифованная поверхность монокристалла Ni состоит из правильных рядов атомов. Ее можно представить в виде двумерной сетки атомов: при этом период идентичности в различных азимутах неодинаков. Например, при азимуте А расстояние между узлами решетки равно 0,215 нм, а при азимуте С – 0,124 нм. Экспериментальная установка позволяла вращать кристалл никеля вокруг вертикальной оси и, кроме того, перемещать коллектор в любое положение около вертикальной оси.
Поскольку кинетическая энергия сравнительно медленно движущейся частицы равна:
E = |
mv2 |
(9-1) |
||
2 |
||||
|
|
|
||
можно выразить длину волны: |
|
|||
λ = |
|
2πv |
(9-2) |
|
|
ω |
|||
|
|
|
||

40
Рис. 16. Расположение атомов никеля в монокристалле никеля при различных проекциях.
если учесть, что скорость и импульс равны, соответственно: |
|
|||||
v = |
2E |
|
|
(9-3) |
||
|
m |
|
|
|
||
и |
|
|
|
|
|
|
p = mv = |
h |
|
= |
2π= |
(9-4) |
|
λ |
λ |
|||||
|
|
|
||||
Или |
v = |
2π= |
= |
2E |
(9-5) |
|
|
mλ |
|
m |
|
Если ускорять электроны электрическим полем с напряжением U, то они приобретут кинетическую энергию E = eU, (е — заряд электрона), что после
подстановки в равенство |
|
|||
λ = |
2π= |
|
(9-6) |
|
2mE |
||||
|
|
|||
числовых значений даёт: |
|
|||
λ =12,26/ U , |
(9-7) |
|||
где U измеряется в вольтах (В),
а λ — в ангстремах (1 А = 10-8 см).
При напряжениях U порядка 100 В, которые использовались в этих опытах, получаются так называемые «медленные» электроны с λ порядка 0,1 нм. Эта величина близка к межатомным расстояниям d в кристаллах, которые
