
- •2. Связь состава структуры стр матеоиалов
- •6.Химические свойства
- •7. Закон створа и конгрузиции
- •8. Долговечность строительных материалов ее принципы
- •9. Связь строения и свойства строительных материалов
- •10. Виды акустических свойств с м
- •11.Общие физ. Свойства см
- •13. Структура строительных материалов
- •14. Закон гетерогенного равновесия Гиббса смеси
- •15. Гидрофизические свойства строительных материалов
- •16.Система стандартизации строит. Материалов и изделий
- •17 Физические-химические свойства строительных материалов
- •18.Виды деформации. Понятие о прочности строительных материалов
- •Гост 23.224-86 Обеспечение износостойкости изделий. Методы оценки износостойкости восстановленных деталей
- •1. Приборы и материалы
- •2. Подготовка к испытаниям
- •3. Проведение испытаний
- •4. Обработка результатов испытаний
- •20. Закон прочности и диформативности искусственного строительного конгломерата оптимальной структуры
- •21Три временных элемента долговечности
- •27. Классификация черных металлов
- •32. Легированные стали. Маркировка.
- •33. Технология производства конструкционных изделий из металла.
- •34. Прокат. Его сущность. Получение прокатом конструкционных материалов.
- •1. Применение проката из конструкционной легированной стали в сфере производства и потребления
- •2. Классификация проката из конструкционной легированной стали
- •Раздел XV. Недрагоценные металлы и изделия из них.
- •Раздел 27. Основные металлы.
- •3. Потребительские свойства Проката из конструкционной легированной стали
- •4. Технология производства проката из конструкционной легированной стали и ее технико-экономическая оценка
- •Зона сплавления
- •38.Электрическая сварка сопротивлением (контактная)
- •39. Электрически и газовые сварки под слоем флюса.
- •41. Термическая обработка стали. Ее виды.
- •Отжиг I рода
- •Отжиг II рода (фазовая перекристаллизация)
- •Закалка
- •Поверхностная закалка
- •Дифференциальная термообработка
- •Обработка холодом
- •42. Химико-термическая обработка. Ее виды.
- •Цементация стали
- •Азотация
- •Нитроцементация
- •Цианирование
- •Борирование
- •Силицирование
- •Диффузионное насыщение металлами
21Три временных элемента долговечности
Независимо от способа оценки — по изменению свойств или по отклонению структурных параметров от оптимальных — полный период долговечности начинается от момента вступления материала к выполнению своих функций в конструкции до предельно допустимого (критического) уровня соответствующего изменения свойств или структуры.
Целый период долговечности условно можно разделить на три этапа или временных элемента (рис. 4.1). Как отмечалось, до начала первого этапа имеется еще предэксплуатационныи период, который в основном характеризуется набором и формированием структурных элементов и свойств в технологическом процессе. Однако он относительно кратковременный, хотя при длительном хранении готовой продукции в складских помещениях и, тем более, на открытых площадках строительных объектов, возможны изменения приобретенных в технологический период показателей свойств и структуры. При особо неблагоприятных условиях хранения отдельных изделий потребуется внести коррективы в первоначальную оценку качества или структуры перед отправлением их по назначению.

Рис. 4.1. Схема чередования временных элементов долговечности в эксплуатационный период: 1 — уровень предельных (критических) значений ключевого структурного параметра; 2 — предэксплуатационныи уровень ключевых структурных параметров; 3 — увеличение продолжительности -С5 торможением деструкции до тю
Первый этап долговечности характеризуется упрочнением структуры или улучшением показателей свойств; второй — их относительной стабильностью; третий — деструкцией, т. е. медленным или быстрым нарушением структуры вплоть до ее критического состояния или даже до полного разрушения. У отдельных материалов тот или иной этап в периоде долговечности может отсутствовать, или его продолжительность практически приниматься равной нулю. Может, например, полностью отсутствовать временной элемент упрочнения структуры или ее стабильного состояния. Что же касается этапа деструкции, то он почти неизбежен, хотя и не всегда наблюдается визуально.4 Гораздо реже деструкция протекает с огромной интенсивностью, когда временной элемент становится равным нулю.
Задача технологов и строителей заключается в том, чтобы всемерно увеличить долговечность конструкции и, следовательно, образующего ее конгломерата. Эта задача адекватна продлению продолжительности каждого из трех взаимосвязанных временных элементов, особенно этапов упрочнения и стабильности структуры, добиваясь вместе с тем эффективного торможения и удлинения срока деструктивных процессов.
Сущность упрочнения структуры на первом этапе Долговечности заключается в том, что под влиянием внешней среды, нагрузок, инверсии фаз и т. п. в эксплуатационный период в материале, особенно в вяжущей части, а также в контактных зонах, возникают вначале на микроуровне, а со временем укрупняются новые (вторичные) структурные центры. Совместно с теми, которые возникли на ранней стадии формирования структуры (первичными), они участвуют в дополнительном процессе уплотнения структуры с увеличением концентрации той части твердой фазы, которая является основным носителем эффекта упрочнения. В результате не только наблюдается упрочнение структуры и рост прочности материала по отношению к механическим нагрузкам, но и улучшение некоторых других его свойств. Примером материала с упрочнением структуры в эксплуатационный период может служить цементный бетон и его вяжущая (матричная) часть в виде цементного камня при контакте с водной средой и тем более с щавелевой кислотой. Последняя, проникая в поры, образует малорастворимые соли и плотные продукты с очень Низкой диффузионной проницаемостью. Особенно часто эффект упрочнения наблюдается в связи с уплотнением новообразований при взаимодействии углекислого газа с известью в материале; переходом аморфного вещества в кристаллическое. Однако упрочнение структуры в эксплуатационный период может составить только тогда положительный эффект, если оно не явилось следствием так называемого «старения». Под последним понимается нередко наблюдаемое явление охрупчивания конгломератов на основе полимеров за счет химических реакций, или при рекристаллизации с увеличением в объеме новообразований. Старение переводит материал в состояние хрупкого микротрещинообразования и, в конечном итоге, резкого сокращения долговечности.
Второй этап — стабилизация структуры — характеризуется сравнительно неизменной концентрацией структурных элементов в единице объема материала и относительным постоянством показателей свойств. Уровень этих показателей имеет колебания за счет местных процессов упрочнения и деструкции, например за счет кристаллизационных напряжений или агрессии внешней среды. Однако в целом сохраняется их сбалансированность на некотором среднем, стабильном уровне (см. рис. 4.1). Впрочем, явления деструкции распространяются и на первый этап упрочнения, но тогда силы разупрочнения сравнительно малы и суммарный эффект остается позитивным.
Третий этап долговечности — деструкция г— самый типичный процесс эксплуатационного периода. Он может начаться с первого же этапа эксплуатации конструкции, но может следовать также за упрочнением и стабилизацией структуры.Третий этап характеризуется нарушением структуры с возможной потерей ее сплошности, постепенным накоплением разрывов межатомных связей. Разрывы возникают под влиянием ускорения теплового движения атомов и молекул, развития механических, усадочных, осмотических и иных. напряжений. Установлено, что процесс постепенного повреждения структуры сопутствует каждой, даже самой малой упругой деформации.
Кроме физических, в период деструкции протекают химические и физико-химические процессы, которые именуют как коррозионные. В широком смысле коррозия означает разъедание металла или другого материала под влиянием контакта с внешней агрессивной средой, проникания ее в поры и капилляры. Процессы коррозии усиливаются при одновременном воздействии физических факторов, если, например, материал находится в напряженном состоянии под влиянием растягивающих или сжимающих усилий, или если вместе с агрессивной средой, например жидкой, материал подвержен воздействию отрицательных температур с циклическим замерзанием и оттаиванием жидкой среды в порах. На заключительной стадии деструкция переходит в интенсивный и даже лавинный процесс образования опасных микро- и макротрещин, завершается частичным или полным разрушением конгломерата.
Определение и изучение долговечности и составляющих ее временных элементов производится на разных уровнях структуры — от молекулярной и надмолекулярной до макроскопической, причем всегда целесообразно начинать с характеристики структуры, а затем переходить к показателям свойств. Но они тесно взаимозависимые, а при оптимальных структурах между ними имеются закономерные связи.
При изучении состояния структур во времени обычно выбирают наиболее значимые (ключевые) характеристики. Количественной оценкой структур занимается стереология; ее методы используют и Для изучения долговечности ИСК. Эти методы позволяют по плоскостным микрофотоснимкам или другим данным структурного анадиза определять объемное содержание изучаемых элементов и количественные изменения в эксплуатационный период: размер и объем пор, величину внутренней удельной поверхности твердой фазы, размер твердых частиц, толщину прослоек жидкой среды, соотношения объемов или масс кристаллической и аморфной (стекловатой) частей в вяжущем, однородность в расположении ключевых частиц в определенных объемах и т. п.
22. Металлы. Особенность металла как строительного материала. Положительные и отрицательные свойства.
В строительстве наряду с лесными и каменными материалами широко применяют металлы и изделия из них. Этому способствует ряд положительных технических свойств металлов: высокая прочность, пластичность, сравнительная простота обработки, возможности изготовления изделий разнообразных профилей и соединения их в конструкции сваркой, на болтах и заклепках. Отрицательными свойствами металлов являются их большая объемная масса, подверженность коррозии во влажной и агрессивной средах, значительные деформации при повышенных температурах и высокая стоимость.
Наша страна по объему производства металла занимает первое место в мире. Основными направлениями развития народного хозяйства СССР на 1976—1980 гг. предусмотрено обеспечить в 1980 г. производство стали в количестве 160—170 млн. т и готового проката — 115—120 млн. т. Несмотря на это, важным условием использования металлов в строительстве является его экономное расходование.
Механические свойства металлов характеризуются прочностью, упругостью, пластичностью, хрупкостью и выносливостью. Первые три свойства определяют при испытании образцов металла на разрыв (рис. 1).
На диаграмме по вертикальной оси откладывают величину растягивающей нагрузки, а по горизонтальной оси — соответствующее приращение длины образца. До определенного значения нагрузки Р1 сохраняется прямая пропорциональность между удлинением образца и приложенной нагрузкой. На диаграмме растяжения это условие сохраняется на участке от начала координат до точки (участок 0—1). На этом участке сохраняются упругие деформации или упругость материала.
Упругостью называют свойство материала восстанавливать свою первоначальную форму после снятия внешней нагрузки.
При незначительном повышении нагрузки до значения Р2 образец начинает удлиняться, при постоянной величине нагрузки — сталь «течет», что соответствует на диаграмме горизонтальной площадке 2—3. Материал приобретает свойство пластичности.
Хрупкому разрушению стали способствуют: низкие температуры, динамический эффект нагрузки, усталость, наклеп и старение металла.
Выносливость металла — это способность сопротивляться разрушению под воздействием переменных величин напряжений при многократной их повторяемости. Пределом выносливости сЕ б называют наибольшее напряжение, при котором материал выдерживает без разрушения заданное число циклов нагрузки.
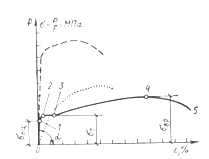
Рис. 1. Диаграмма растяжения стали стадии работы стали: 0—1 — упругая; 2—3 — пластическая (текучесть); 3—4 — самоупрочнение; 5 — точка, соответствующая разрыву образца
Коррозия металлов и меры защиты от нее. Коррозией называют разрушение металлов, вызванное химическим или электрохими ческим воздействием на них окружающей среды. В результате коррозии безвозвратно теряется около 10—12% ежегодного выпуска черных металлов. Поэтому необходимо уделять особое внимание, защите металлов от коррозии. Для защиты чаще всего применяют окраску лаками натуральными и синтетическими, нитроэмалью, масляными красками. В последнее время для антикоррозионной защиты металлов используют такие способы, как оцинкование, покрытие пластмассами, а также напыление тонкого слоя алюминия, цинка — металлизация. Наиболее надежный способ защиты металлов от коррозии— легирование, когда в сплавы металлов вводят специальные добавки.
23. Атомно-кристалические строения металлов и сплавов. Типы кристаллических решеток.
Жидкости и твердые тела относятся к конденсированному состоянию в-ва, это значит что атомы расположены близко к друг другу, что приводит к их сильному взаимодействию и, как следствие этого, жидкости и твердые тела имеют постоянный объем. Атомы в твердом теле совершают только малые колебания около своих равновесных положений. Это приводит к правильному чередованию атомов на одинаковых расстояниях для сколь угодно далеко удаленных атомов. Такое правильное, регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях, образует кристаллическую решетку. Между атомами образующими кристаллическое твердое тело, существую силы притяжения, кот-ые уравновешиваются силами отталкивания. Связь в металлах обусловлена взаимодействием положительных ионов с коллективизированными электронами. Свободные электроны проводимости, находясь между ионами, как бы «стягивают» их, компенсируя силы отталкивания.
Типы кристаллических решеток.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объёма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры рёбер элементарной ячейки. a, b, c – периоды решётки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определёнными.
- углы между осями ().
- координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
- базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
- плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74)

Рис.1.1. Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
- примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный – атомы занимают вершины ячеек и ее центр;
-
гранецентрированный – атомы занимают
вершины ячейки и центры всех шести
граней
Рис. 1.2. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических решёток являются:
- Объемно - центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, )
- Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au, )
- Гексагональная, в основании которой лежит шестиугольник:
- простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
- плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
24. Структурные состовляющие железноуглеродистых сплавов.
Основными компонентами, от которых зависит структура и свойства железоуглеродистых сплавов, являются железо и углерод. Чистое железо - металл серебристо-белого цвета; температура плавления 1539°С. Железо имеет две полиморфные модификации: α и γ. Модификация α существует при температурах ниже 911°С и выше 1392°С; γ-железо — при 911-1392°С.
В зависимости от температуры и концентрации углерода железоуглеродистые сплавы имеют следующие структурные составляющие.
1. Феррит (Ф) - твердый раствор внедрения углерода в α-железе. Растворимость углерода в α-железе при комнатной температуре до 0,005%; наибольшая растворимость - 0,02% при 727°С. Феррит имеет незначительную твердость (НВ 80-100) и прочность (σв=250 МПа), но высокую пластичность (δ=50%; ψ=80%).
2. Аустенит (А) - твердый раствор внедрения углерода в γ-железе. В железоуглеродистых сплавах он может существовать только при высоких температурах. Предельная растворимость углерода в γ-железе 2,14% при температуре 1147°С и 0,8% - при 727°С. Эта температура является нижней границей устойчивого существования аустенита в железоуглеродистых сплавах. Аустенит имеет твердостьНВ 160-200 и весьма пластичен (δ =40-50%).
3. Цементит (Ц) - химическое соединение железа с углеродом (карбид железа Fe3C). В цементите содержится 6,67% углерода. Температура плавления цементита около 1600°С. Он очень тверд (НВ-800), хрупок и практически не обладает пластичностью. Цементит неустойчив и в определенных условиях распадается, выделяя свободный углерод в виде графита по реакции Fe3C→3Fe+C.
4. Графит - это свободный углерод, мягок (НВ-3) и обладает низкой прочностью. В чугунах и графитизированной стали содержится в виде включений различных форм (пластинчатой, шаровидной и др.). С изменением формы графитовых включений меняются механические и технологические свойства сплава.
5. Перлит (П) - механическая смесь (эвтектоид, т.е. подобный эвтектике, но образующийся из твердой фазы) феррита и цементита, содержащая 0,8% углерода. Перлит может быть пластинчатым и зернистым (глобулярным), что зависит от формы цементита (пластинки или зерна) и определяет механические свойства перлита. При комнатной температуре зернистый перлит имеет предел прочности σв =800МПа; относительное удлинение δ =15%; твердость НВ 160. Перлит образуется следующим образом. Пластинка (глобула) цементита начинает расти или от границы зерна аустенита, или центром кристаллизации является неметаллическое включение. При этом соседние области объединяются углеродом и в них образуется феррит. Этот процесс приводит к образованию зерна перлита, состоящего из параллельных пластинок или глобулей цементита и феррита. Чем грубее и крупнее выделения цементита, тем хуже механические свойства перлита.
6. Ледебурит
(Л) - механическая
смесь (эвтектика) аустенита и цементита,
содержащая 4,3% углерода. Ледебурит
образуется при затвердевании жидкого
расплава при 1147°С. Ледебурит имеет
твердостьНВ 600-700 и большую хрупкость.
Поскольку при температуре 727°С аустенит
превращается в перлит, то это
превращение охватывает и аустенит,
входящий в состав ледебурита. Вследствие
этого при температуре 
Диаграмма состояния железо — цементит (в упрощенном виде):
А — аустенит, П — перлит, Л — ледебурит, Ф — феррит, Ц — цементит
ниже 727"С ледебурит представляет собой уже не смесь аустенита с цементом, а смесь перлита с цементитом.
Помимо перечисленных структурных составляющих в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: окислы, нитриды, сульфиды, фосфиды — соединения с кислородом, азотом, серой и фосфором. На их основе могут образовываться новые структурные составляющие, например фосфидная эвтектика (Fe+Fe3P+Fe3C) с температурой плавления 950°С. Она образуется при больших содержаниях фосфора в чугуне. При содержании фосфора около 0,5—0,7% фосфидная эвтектика в виде сплошной сетки выделяется по границам зерен и повышает хрупкость чугуна.
Диаграмма состояния железо - цементит. В диаграмме состояния железо — цементит (Fe—Fe3C) рассматриваются процессы кристаллизации железоуглеродистых сплавов (стали и чугуна) и превращения в их структурах при медленном охлаждении от жидкого расплава до комнатной температуры. Диаграмма (рис. 14) показывает фазовый состав и структуру сплавов с концентрацией от чистого железа до цементита (6,67% С). Сплавы с содержанием углерода до 2,14% называют сталью, а от 2,14до 6,67% — чугуном.
Диаграмма состояния Fe—Fe3C представлена в упрощенном виде. Первичная кристаллизация, т.е. затвердевание жидкого сплава начинается при температурах, соответствующих линии ликвидуса ACD. Точка А на этой диаграмме соответствует температуре 1539° плавления (затвердевания) железа, точка D - температуре ~ 1600°С плавления (затвердевания) цементита. Линия солидуса АЕСР соответствует температурам конца затвердевания. При температурах, соответствующих линии АС, из жидкого сплава кристаллизуется аустенит, а линии CD — цементит, называемый первичным цементитом. В точке С при 1147° С и содержании углерода 4,3% из жидкого сплава одновременно кристаллизуется аустенит и цементит (первичный), образуя эвтектику — ледебурит. При температурах, соответствующих линии солидуса АЕ, сплавы с содержанием углерода до 2,14% окончательно затвердевают с образованием аустенита. На линии солидуса ECF сплавы с содержанием углерода от 2,14 до 6,67% окончательно затвердевают с образованием эвтектики (ледебурита) и структур, образовавшихся ранее из жидкого сплава, а именно: в интервале 2,14—4,3% С — аустенита, а в интервале 4,3—6,67% С цементита первичного (см.рис. 14).
В результате первичной кристаллизации во всех сплавах с содержанием углерода до 2,14%, т.е. в сталях, образуется однофазная структура — аустенит. В сплавах с содержанием углерода более 2,14%, т.е. в чугунах, при первичной кристаллизации образуется эвтектика ледебурита.
Вторичная кристаллизация (превращение в твердом состоянии) происходит при температурах, соответствующих линиям GSE, PSK и ОРО. Превращения в твердом состоянии происходят вследствие перехода железа из одной аллотропической модификации в другую (у в а) и в связи с изменением растворимости углерода в аустените и феррите. С понижением температуры растворимость уменьшается. Избыток углерода выделяется из твердых растворов в виде цементита.
В
области диаграммы AGSE находится аустенит.
При охлаждении сплавов аустенит
распадается с выделением феррита при
температурах, соответствующих линии
GS, и цементита, называемого вторичным,
при температурах, соответствующих
лини и SE. Вторичным называют цементит,
выделяющийся из твердого раствора
аустенита, в отличие от первичного
цементита, выделявшегося из жидкого
расплава. В области диаграммы GSP находится
смесь феррита и распадающегося аустенита.
Ниже линии GР существует только
феррит. При дальнейшем охлаждении до
температур, соответствующих линии
PQ , из феррита выделяется цементит
(третичный). Линия PQ показывает, что с
понижением температуры 
Микроструктура:
а - доэвтектоидная сталь - феррит (светлые участки) и перлит (темные участки) при 500х увеличении, б — эвтектоидная сталь — перлит (1000'), в — заэвтектоидная сталь - перлит и цементит в виде сетки (200')
растворимость углерода в феррите уменьшается от 0,02% при 727°С до 0,005% при комнатной температуре.
В точке S при содержании 0,8% углерода и температуре 727°С весь аустенит распадается и превращается в механическую смесь феррита и цементита—перлит. Сталь, содержащую 0,8% углерода, называют эвтектоидной (рис. 15, б). Стали, содержащие от 0,02 до 0,8% углерода называют доэвтектоидными (рис. 15, а), а от 0,8 до 2,14% углерода -заэвтектоидными (рис. 15, в).
При температурах, соответствующих линии PSK, происходит распад аустенита, оставшегося в любом сплаве системы, с образованием перлита, представляющего собой механическую смесь феррита и цементита. Линию PSK называют линией перлитного превращения.
При температурах, соответствующих линии SE, аустенит насыщен углеродом, и при понижении температуры из него выделяется избыточный углерод в виде цементита (вторичного).
Вертикaль DFKL означает, что цементит имеет неизменный химический состав. Меняется лишь форма и размер его кристаллов, что существенно отражается на свойствах сплавов. Самые крупные кристаллы цементита образуются, когда он выделяется при первичной кристаллизации из жидкости.
Белый чугун, содержащий 4,3% углерода, называют эвтектическим (рис. 16). Белые чугуны, содержащие от 2,14 до 4,3% углерода, называют доэвтектическими, а от 4,3 до 6,67% углерода — заэвтектическими.

Микроструктура белого чугуна при 500х увеличении:
а — доэвтектический чугун — перлит (темные участки) и ледебурит (цементит вторичный в структуре не виден), б—эвтектический чугун —ледебурит (смесь перлита и цементита), в - заэвтектический чугун - цементит (светлые пластины) и ледебурит
По достижении температуры 727°С (линия PSK) аустенит, обедненный углеродом доэвтектоидного состава (0,8% углерода), превращается в перлит. После окончательного охлаждения доэвтектические белые чугуны состоят из перлита, ледебурита (перлит + цементит) и цементита (вторичного). Чем больше в структуре такого чугуна углерода, тем меньше в нем перлита и больше ледебурита.
Белый эвтектический чугун (4,3% углерода) при температурах ниже 727°С состоит только из ледебурита. Белый заэвтектический чугун, содержащий более 4,3% углерода, после окончательного охлаждения состоит из цементита (первичного) и ледебурита. Следует отметить, что при охлаждении ледебурита ниже линии PSK входящий в него аустенит превращается в перлит, т.е. ледебурит при комнатной температуре представляет собой уже смесь цементита и перлита. При этом цементит образует сплошную матрицу, в которой размещены колонии перлита. Такое строение ледебурита является причиной его большой твердости (НВ>600) и хрупкости.
Диаграмма состояния железо — цементит имеет большое практическое значение. Ее применяют для определения тепловых режимов термической обработки и горячей обработки давлением (ковка, горячая штамповка, прокатка) железоуглеродистых сплавов. Ее используют также в литейном производстве для определения температуры плавления, что необходимо для назначения режима заливки жидкого железоуглеродистого сплава в литейные формы.
25. Кривая охлаждения железа. Модификация железа в железоуглеродистых сплавах.
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.

Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры - мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей — сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле — троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.

Рис. 6. Микроструктура закаленной стали:
а — игольчатый мартенсит;
б — сорбит.
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей — и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит—при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250—400° — мартенсит и троостит и при нагреве от 400—650° — троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.

Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной— температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн — образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45—55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Модификации железа — рычаг термической обработки
Температура плавления чистого железа составляет 1536 °С. В твердом состоянии чистое железо обладает тремя аллотропическим модификациями, а именно: — дельта-железо – объемно-центрированная кубическая кристаллическая структура в интервале от 1392 до 1536 °С; — гамма-железо – гранецентрированная кубическая кристаллическая структура в интервале от 911 до 1392 °С; — альфа-железо – объемно-центрированная кубическая кристаллическая структура при температуре до 911 °С.
Среди всех аллотропических превращений самую важную роль играет превращения альфа → гамма и гамма → альфа. Именно эти превращения дают теоретическую базу для большинства процессов термической обработки.
Железо образует твердые растворы со многими неметаллическими элементами. Оно образует растворы замещения с хромом, никелем, кобальтом и ванадием, тогда как с углеродом образует очень важный раствор внедрения.
Углерод и железо
Растворимость углерода в альфа-железе – феррите – очень незначительная – при комнатной температуре только 0,006 %. В гамма-железе – аустените – растворимость железа на несколько порядков выше – 2,06 % при температуре 1147 °С.
Железо образует с углеродом не только твердые растворы, но металлические соединения. Заместительным соединением железа и углерода является карбид железа – цементит – Fe3C. Основным свойством карбида железа является его высокая твердость (твердость по Викерсу около 900) и высокая хрупкость. Карбид железа практически не поддается никакой деформации. Температура плавления карбида железа – 1250 °С. Карбид железа не может считаться равновесной фазой. При определенных условиях он распадается на свои компоненты – железо и углерод. Этот углерод – графит – является уже равновесной фазой.
26. Основные свойства железноуглеродистых сплавов: физические механические технологические
Свойства металлов и сплавов (физические, химические, механические, технологические, служебные): Физические свойства. К физическим свойствам металлов и сплавов относится температура плавления, плотность, температурный коэфициет линейного и обьёмного расширения, электросопротивление и теплопроводность.Эти свойства сплавов обусловлены их составом и структурой. Кхимическимсвойствам относятся способность металлов к химическому взаимодействию с агрессивными средами (коррозия). Технологические свойства. Определяют способность материала подвергатся различным методам горячей и холодной обработки. К ним относятся: литейные свойства, деформируемость, свариваемость и обрабатываемость режущим инструментом.Эксплуатационные или служебныесвойства. К ним относятся: коррозионная стойкость, холодостойкость, жаропрочность, жаростойкость, антифринционность. Механические свойства. К ним относят – прочность, пластичность, эластичность, вязкость (ударная), твёрдость, выносливость, износостойкость, ползучесть. Внешняя нагрузка вызывает в твердом теле напряжение и деформацию. Напряжение – это нагрузка (сила – Р), отнесённая к площади поперечного сечения образца (F),Мпа: (P- нагрузка, Мн; F – площадь поперечного сечения, м2). Напряжение вызывает деформацию. Деформация – изменение формы и размеров тела под воздействием внешних сил или в результате физико-механических процессов, возникающих в самом теле. Деформация может быть упругая (изчезающая после снятия нагрузки) и пластическаяя (остающаяся после снятия нагрузки). При увеличении нагрузки упругая деформация переходит в пластическую; при дальнейшем повышении нагрузки происходит разрушение тела. Прочность – это способность твердого тела сопротивлятся деформации или разрушению под действием статистических или динамических нагрузок. Пластичность – это способность материала получать остаточное изменение формы и размеров без разрушения. Вязкость – свойство материала, которое определяет его способность к поглашению механической энергии при постепенном увеличении пластической деформации вплоть до разрушения материала.
