
- •Сборник задач по общей химии
- •Содержание
- •Предисловие
- •Тема 1. Способы выражения состава раствора Медико-биологическое значение темы
- •Основные параметры, характеризующие состав раствора
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 2. Титриметрические методы количественного анализа Кислотно-основное титрование. Оксидиметрия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 3. Химическая термодинамика. Химическое равновесие Медико-биологическое значение темы
- •Основные параметры, используемые для характеристики термодинамических процессов
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 4. Элементы химической кинетики Медико-биологическое значение темы
- •Основные кинетические параметры, характеризующие кинетические закономерности
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 5. Лигандообменные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 6. Редокс-процессы и редокс-равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 7. Осмотические свойства растворов
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 8. Свойства растворов электролитов Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 9. Гетерогенные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 10. Протолитические процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 11. Буферные растворы и их свойства Медико-биологическое значение темы
- •Задачи для самостоятельного решения
- •Тема 12. Физико-химия поверхностных явлений Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 13. Физико-химия дисперсных систем Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Приложение
- •Использованная литература
Тема 5. Лигандообменные процессы и равновесия Медико-биологическое значение темы
Многие вещества, находящиеся в организме: аминокислоты, протеины, нуклеиновые кислоты, витамины, гормоны, являются активными лигандами. Они взаимодействуют с катионами металлов, образуют комплексные соединения (КС), выполняющие биологические функции. Металлоферменты катализируют важнейшие биохимические процессы: синтез белка, нуклеиновых кислот, окислительно-восстановительные и другие реакции. Железосодержащие КС участвуют в транспорте О2 .
КС используются как лекарственные средства, позволяющие выводить из организма тяжелые металлы, способствуя детоксикации организма. В санитарно-гигиенической практике для качественного и количественного определения ионов металлов используется комплексонометрия. Наиболее устойчивыми КС являются хелаты – комплексы с полидентантными лигандами. Они используются в хелатотерапии для выведения токсичных металлов из организма. Биогенные металлы образуют многообразные КС: гемоглобин, витамин В12, металлоферменты, цитохромы, и другие. Процесс комплексообразвания широко применяется при очистке природных вод от нежелательных ионов.
Таблица 4. Основные параметры, характеризующие лигандообменные процессы и равновесия в растворах
|
Параметр |
Обозначение, единица |
Смысловое значение
|
|
Константа нестойкости |
где: Ме- комплексообразователь (атом, ион), L- лиганд
|
Константа равновесия, описывающая диссоциацию комплексного иона, - количественная характеристика устойчивости внутренней сферы комплексного соединения.
|
|
Константа устойчивости |
КУ
|
Величина, обратная константе нестойкости
|
|
Координационное число |
к.ч. |
Число свободных атомных орбиталей, предоставлямых комплексообразователем, т.е. число химических связей комплексообразова-теля с лигандами. |
|
Дентатность лигандов |
|
Число электронных пар, предоставляемых лигандом для образования связи с комплексообразователем. |
Обучающие задачи с решениями.
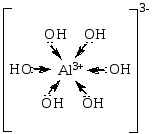
1.Какова роль центрального атома в образовании донорно-акцепторной связи? Объясните на примере K3[Al(OH)6].
Решение:
Al0![]()
1s2 2s2 2p6 3s2 3p1 3d0
Al3+ - акцептор электронных пар (кислота Льюиса). OH- - лиганд, донор электронных пар (основание Льюиса).
sp3d2- гибридизация
Al3+![]()
1s2 2s2 2p6 3s0 3p0 3d0
Al3+ представляет 6 гибридных орбиталей для электронных пар лиганда OH-. Механизм образования связи – донорно-акцепторный. Геометрия комплекса – октаэдр.

2. Приведите молекулярно-ионные уравнения первичной и вторичной диссоциации комплексных соединений: [Ag(NH3)2]Cl, [Pt(NH3)3Cl]Cl, [Pt(NH3)2Cl2]. Назовите КС.
Решение: [Ag(NH3)2]Cl –хлорид диамминосеребра(I),
[Pt(NH3)3Cl]Cl – хлорид хлоротриамминоплатины (II)
[Pt(NH3)2Cl2] – дихлородиамминоплатина(II).
Первичная диссоциация, распад на внутреннюю и внешнюю сферы; [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl—
Вторичная диссоциация (распад внутренней сферы) происходит ступенчато; [Ag(NH3)2]+ ↔ Ag+ + 2NH3

КН количественно характеризует обратимый процесс вторичной диссоциации, прочность комплекса: чем меньше Kн, тем прочнее комплексный ион.
Первичная диссоциация: [Pt(NH3)3Cl]Cl → [Pt(NH3)3Cl]+ + Cl-
Вторичная диссоциация: [Pt(NH3)3Cl]+ ↔ Pt2+ + 3NH3 + Cl-
.

Неэлектролит [Pt(NH3)2Cl2] не имеет внешней сферы, поэтому первичная диссоциация отсутствует.
[Pt(NH3)2Cl2] ↔ Pt2+ + 2NH3 + 2Cl-

3.Сравните устойчивость комплексных ионов [Ag(NO2)2]-, [Ag(CN)2]-, [Ag(NH3)2]+, [AgCl2]-.
Решение: Устойчивость однотипных комплексных ионов можно сравнить путём сравнения величин Kн:
Kн[Ag(NO2)2]- = 1,5. 10-3; Kн[Ag(CN)2]- = 1,4.10-21;
Kн[Ag(NH3)2]+ = 5,9.10-8; Kн[AgCl2]- = 1,76.10-5.
Ответ: наиболее устойчивым комплексным ионом будет [Ag(CN)2]-,
а наименее устойчивым - [Ag(NO2)2]-.
4. Выберите наиболее прочное комплексное соединение из соединений Fe2+ с биолигандами: глицином (1), гистидином (2), лизином (3).
Решение. Прочность комплекса характеризуется величиной Kн: чем меньше константа, тем прочнее комплекс.
Из справочника: K1 = 1,58. 10-8; K2 = 5,01.10-10; K3 = 3,16. 10-5.
Ответ: так как Kн2< Kн1< Kн3,то самое прочное комплексное
соединение Fe2+ с гистидином.
5. Из раствора комплексной соли СdBr2.5NH3 нитрат серебра осаждает половину бромид-ионов в виде бромида серебра. Напишите координационную формулу этой соли, уравнения ее диссоциации, выражение константы нестойкости.
Решение:
Осаждение бромид- иона нитратом серебра означает, что половина брома, входящего в состав комплексной соли входит во внешнюю сферу, а вторая половина во внутреннюю сферу комплексного иона. Следовательно, состав комплексного соединения будет выражаться формулой: [Cd(NH3)5Br]Br -бромид бромопентаамминкадмия (II).
Первичная диссоциация: [Cd(NH3)5Br]Br → [Cd(NH3)5Br]+ + Br -
Вторичная диссоциация: [Cd(NH3)5Br]+ ↔ Cd2+ + 5NH3 + Br -.
Выражение константы нестойкости

6. Произойдет ли взаимодействие [Co(NH3)4]CI2 c глицином? Ответ поясните.
Решение:
Взаимодействие предполагает реакцию:
[Co(NH3)2]Cl2 + Гли ↔ [Co(Гли)2] + 4NH3 + 2HCl
Объект конкуренции Со+2 , конкурирующие частицы NH3 и глицин. Взаимодействие произойдет в том случае, если произойдет разрушение аммиачного комплекса кобальта и равновесие сместится вправо. Этого можно достигнуть связыванием комплексообразователя в более прочный комплексный ион. Сравним константы нестойкости двух комплексных ионов:
Кн= [Co(NH3)2]2+ = 1.10-5
Кн= [Co(Гли)2 ] = 3,3.10-9 , более прочный комплекс.
Так как константа нестойкости хелатного комплекса с глицином меньше, чем аммиачного комплекса, следовательно, он прочнее, взаимодействие произойдет. Равновесие сместится в сторону более полного связывания иона кобальта, т.е. в сторону продуктов реакции.
Ответ: образование комплекса с глицином произойдет
7. При отравлении соединениями кобальта и меди в медицинской практике применяют трилон Б. В какой последовательности будут выводиться данные металлы из организма?
Решение:
Токсичность катионов металлов связана с устойчивостью образуемых ими биокомплексов. Если устойчивость комплексного соединения с токсическим катионом выше, чем прочность биокомплекса с биокатином в составе организма, то при его поступление идет вытеснение последнего из биокомплекса. В этом состоит сущность токсикоза. Антидотная терапия при токсикозах основана также на образовании металлами-токсикантами прочных комплексов со специальными лигандами. Поэтому первым будет выводиться металл, образующий более прочный комплекс. Сравним константы нестойкости комплексов меди и кобальта с трилоном Б.
Кн [Cu.Tp] = 1,6.10-19
Кн [Co.Tp] = 1,6.10-6
Более устойчивым является комплекс меди, он и будет выводиться из организма в первую очередь.
Ответ: в первую очередь будет выводиться из организма в виде комплекса с трилоном Б ион меди.
