
- •Сборник задач по общей химии
- •Содержание
- •Предисловие
- •Тема 1. Способы выражения состава раствора Медико-биологическое значение темы
- •Основные параметры, характеризующие состав раствора
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 2. Титриметрические методы количественного анализа Кислотно-основное титрование. Оксидиметрия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 3. Химическая термодинамика. Химическое равновесие Медико-биологическое значение темы
- •Основные параметры, используемые для характеристики термодинамических процессов
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 4. Элементы химической кинетики Медико-биологическое значение темы
- •Основные кинетические параметры, характеризующие кинетические закономерности
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 5. Лигандообменные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 6. Редокс-процессы и редокс-равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 7. Осмотические свойства растворов
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 8. Свойства растворов электролитов Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 9. Гетерогенные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 10. Протолитические процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 11. Буферные растворы и их свойства Медико-биологическое значение темы
- •Задачи для самостоятельного решения
- •Тема 12. Физико-химия поверхностных явлений Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 13. Физико-химия дисперсных систем Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Приложение
- •Использованная литература
Обучающие задачи с решениями
1. Константа скорости распада пенициллина при 36°С равна 6 ∙ 10–6c–1 а при 41 оС – 1,2 ∙ 10–5с–1. Вычислите температурный коэффициент реакции.
Решение:
по
правилу Вант-Гоффа
![]() ,
отсюда:
,
отсюда:
|
|
|
γ0,5 = 2
|
γ = 4
|
Ответ: температурный коэффициент реакции равен 4.
2. Во сколько раз увеличится скорость реакции СО + 3 Н2 → СН4 + Н2О при увеличении давления в 3 раза:
Решение. Согласно закону действующих масс,
V1 = k · C(CO) · C3(H2)
При увеличении давления в 3 раза увеличивается концентрация газообразных веществ в 3 раза, следовательно:
![]()
V2
= 3 .
27
.
k
.
C
(CO)
.
С3(![]() )
)
![]()
Ответ: скорость реакции увеличится в 81 раз.
3. Период полураспада радиоактивного изотопа 32Si равен 6 ч. Рассчитайте время, по истечении которого останется нераспавшимся 20 % исходного вещества.
Решение.
Константа
скорости реакции распада кремния, исходя
из того, что данная реакция является
реакцией первого порядка, рассчитывается
по формуле:
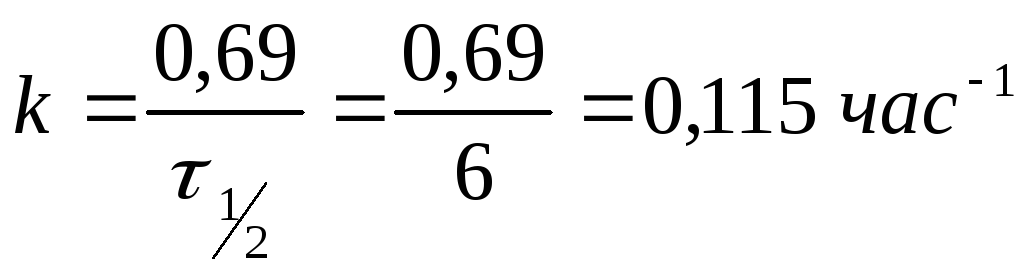 .
Находим,
через какой период останется 20 %
исходного вещества, то есть распадется
100–20 = 80 % вещества:
.
Находим,
через какой период останется 20 %
исходного вещества, то есть распадется
100–20 = 80 % вещества:
![]() ,
,
![]() .
Следовательно,
.
Следовательно,
![]() .
.
Ответ: через 14 ч останется 20 % исходного изотопа 32Si.
4.
При авариях на АЭС появляется радиоактивный
изотоп йода 131I.
За какое время этот изотоп распадается
на 99%? (![]() )
)
Решение: Константа скорости радиоактивного распада, протекающей по первому порядку, определяется по формуле:
 ,
тогда
,
тогда
![]()
Концентрация исходного вещества (С) 100%, следовательно:
С0 – х = 100% - 99% = 1%
![]() ,
из
чего следует, что
,
из
чего следует, что
![]()
Ответ: изотоп 131I распадается на 99% через 53,5 сут.
5. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации (Eа) уменьшить на 4 кДж/моль?
Решение: Из уравнения Аррениуса следует
![]()
![]()
Ответ: скорость реакции увеличится в 5 раз
6. Константы скорости реакции перегруппировки метилизонитрила при различных температурах следующие k1= 2,52 . 10-5 t01 = 1890C
k2 = 3,168 . 10-3 t02 = 2510C
Вычислите энергию активации данной реакции.
Решение:
Из
уравнения Аррениуса следует:
![]()
![]()
![]()
![]()
Ответ: энергия активации равна 156,533 кДж/моль
7. Вычислите константу равновесия реакции 2NO + O2 ↔ 2NO2 и исходные концентрации веществ NO и O2, если равновесные концентрации равны
С(NO) = 0,06 моль/л, С(О2) = 0,14 моль/л, С(NO2) = 0,206 моль/л
Решение:
Константа равновесия выражается уравнением:

Исходные концентрации веществ, исходя из того, что из двух молей NO и одного моля О2 образуется два моля NO2 , равны:
C(NO) = 0,206 моль + 0,06 моль = 0,266 моль
С(O2) = 0,206 : 2 моль + 0,14 моль = 0,552 моль
Ответ: 0,206 моль; 0,552 моль
Задачи для самостоятельного решения
Задача 1. Как изменится скорость прямой реакции
![]() при
увеличении давления в 2 раза?
при
увеличении давления в 2 раза?
Ответ: увеличится в 8 раз.
Задача
2.
Рассчитайте константу равновесия для
обратимой реакции
![]() ,
если в состоянии равновесия [NO]
= 0,056 моль/л; [
,
если в состоянии равновесия [NO]
= 0,056 моль/л; [![]() ]
= 0,02 моль/л; [
]
= 0,02 моль/л; [![]() ]
= 0,044 моль/л.
]
= 0,044 моль/л.
Ответ: Кс = 30,87.
Задача
3.
Для реакции
![]()
![]() =
14 кДж/моль. В каком направлении реакция
идет самопроизвольно при стандартных
условиях? Каково значение константы
равновесия?
=
14 кДж/моль. В каком направлении реакция
идет самопроизвольно при стандартных
условиях? Каково значение константы
равновесия?
Ответ:
Кс = 3,48![]() реакция самопроизвольно идет в обратном
направлении.
реакция самопроизвольно идет в обратном
направлении.
Задача 4. Вычислите энергию активации реакции спиртового брожения глюкозы в растворе в интервале 30÷700С при температурном коэффициенте, равном 2,0. Ответ: 57,3 кДж.
Задача 5. Во сколько раз возрастет скорость реакции при повышении температуры от 25 до 850С, если энергия активации равна 100 кДж/моль? Рассчитайте температурный коэффициент этой реакции.
Ответ:
в 876 раз;
![]() =
3,09.
=
3,09.
Задача 6. Период полураспада радиактивного изотопа 32Р равен 14,3 дня. Вычислите скорость данного процесса.
Ответ: υ =0,04825 день-1
Задача
7.
Рассчитайте, во сколько раз возрастет
скорость реакции разложения угольной
кислоты при 310К при использовании
катализатора (без катализатора Е![]() = 86 кДж/моль, в присутствии фермента
карбоангидразы Е
= 86 кДж/моль, в присутствии фермента
карбоангидразы Е![]() = 49 кДж/моль).
= 49 кДж/моль).
Ответ:
в 1,73![]() раз.
раз.
Задача
8.
В печени протекает ферментативный
обратимый процесс: глюкозо-1-фосфат![]() глюкозо-6-фосфат.
При 370С
равновесная концентрация глюкозо-1-фосфата
равна 0,001 моль/л, а глюкозо-6-фосфата –
0,019 моль/л. Рассчитайте Кравн.
глюкозо-6-фосфат.
При 370С
равновесная концентрация глюкозо-1-фосфата
равна 0,001 моль/л, а глюкозо-6-фосфата –
0,019 моль/л. Рассчитайте Кравн.
Ответ: Кс = 19.
Задача 9. Энергия активации реакции кислотного гидролиза сахарозы при 370С равна 102 кДж/моль, а в присутствии фермента энергия активации снижается до 35 кДж/моль. Во сколько раз быстрее протекает реакция гидролиза сахарозы в присутствии фермента?
Ответ:
в присутствии фермента скорость реакции
гидролиза сахарозы возросла в 1,97![]() раз.
раз.
Задача 10. Рассчитайте, за какое время в организме останется 10% введённого в кровяное русло изотопа 51Cr , если период полураспада изотопа равен 22,7 сут.
Ответ: 76,7 дней
