
- •Сборник задач по общей химии
- •Содержание
- •Предисловие
- •Тема 1. Способы выражения состава раствора Медико-биологическое значение темы
- •Основные параметры, характеризующие состав раствора
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 2. Титриметрические методы количественного анализа Кислотно-основное титрование. Оксидиметрия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 3. Химическая термодинамика. Химическое равновесие Медико-биологическое значение темы
- •Основные параметры, используемые для характеристики термодинамических процессов
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 4. Элементы химической кинетики Медико-биологическое значение темы
- •Основные кинетические параметры, характеризующие кинетические закономерности
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 5. Лигандообменные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 6. Редокс-процессы и редокс-равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 7. Осмотические свойства растворов
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 8. Свойства растворов электролитов Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 9. Гетерогенные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 10. Протолитические процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 11. Буферные растворы и их свойства Медико-биологическое значение темы
- •Задачи для самостоятельного решения
- •Тема 12. Физико-химия поверхностных явлений Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 13. Физико-химия дисперсных систем Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Приложение
- •Использованная литература
Обучающие задачи с решениями.
Рассчитайте потенциал цинкового электрода, опущенного в раствор с концентрацией ZnSO4, равной 0,001 моль/л, Т = 298 К.
Решение: Величина потенциала, возникающая на границе металл-раствор, определяется по уравнению Нернста:
φ(Zn2+/Zn)
= φо(Zn2+/Zn)
+ ![]() ln a(Zn2+),
ln a(Zn2+),
где, φ(Zn2+/Zn) – потенциал, возникающий на границе металл-раствор;
φо(Zn2+/Zn) – стандартный потенциал цинкового электрода (справочная величина), φо(Zn2+/Zn) = - 0,763 В;
R – газовая постоянная, 8,31 Дж/(моль.К);
Т – температура (К), влияющая на величину электродного потенциала;
z – число электронов в электронной реакции Zn2+ + 2е- ↔ Zn0 (z = 2);
F – число Фарадея, 96 500 Кл/моль, а(Zn2+) – активная концентрация ионов цинка равная произведению коэффициента активности на аналитическую концентрацию: а = f.С.
При больших разведениях (С = 10-3 и меньше) f =1; С = а.
φ(Zn2+/Zn)
= - 0,763 + ![]() ln 0,001 = - 0,852 В.
ln 0,001 = - 0,852 В.
Ответ: потенциал цинкового электрода равен - 0,852 В.
Рассчитайте величину потенциала окислительно-восстановительного электрода Pt//(Fe3+, Fe2+), если активные концентрации FeCl3 и FeCl2 равны соответственно 0,05 моль/л и 0,85 моль/л; Т = 298 К.
Решение: Окислительно-восстановительный электрод – это система, состоящая из инертного металла (Pt), погружённого в раствор, содержащий одновременно окисленную и восстановленную формы вещества. Потенциал такого электрода зависит от природы окислительно-восстановительной пары, температуры, отношения активностей окисленной и восстановительной форм веществ и рассчитывается по уравнению Нернста – Петерса:
φ(Fe3+/
Fe2+)
= φо(Fe3+/
Fe2+)
+ ![]() ln
ln ![]() ;
;
φо(Fe3+/ Fe2+) = 0,77 В (табличные данные); n = 1, число электронов участвующих в ОВ – реакции.
Отсюда
φо(Fe3+/
Fe2+)
= 0,77 + ![]() ∙ ln
∙ ln ![]()
Ответ: потенциал окислительно-восстановительного электрода равен 0,697В.
Составьте схему гальванического элемента из медного и цинкового электродов, погружённых в 1моль/л растворы солей этих металлов. Рассчитайте ЭДС этого элемента.
Решение: Запишем табличные значения стандартного электродного потенциала меди и цинка:: φо (Cu2+/ Cu) = + 0,35 В;
φо(Zn2+/Zn) = - 0,76 В.
Так как, φо (Cu2+/ Cu) > φо(Zn2+/Zn), то на медном электроде идёт процесс восстановления – это катод, а на цинковом – процесс окисления, это – анод. Катод: Cu2+ + 2е- → Cu0
Анод: Zn0 – 2е- → Zn2+
При работе такого элемента протекает реакция
Cu2+ + Zn0 → Zn2+ + Cu0
ЭДС медно-цинкового гальванического элемента определим по формуле
Ео = φо(катода) - φо(анода) Ео = 0,35 – (-0,76) = 1,11 В.
Схема гальванического элемента:

Анод катод
Ответ: ЭДС = 1,11В
В каком направлении данная ОВР самопроизвольна при с.у.:
Н2SО4 + НCl ↔ Cl2 + Н2SО3 + Н2О?
Рассчитайте ЭДС этой реакции, если φо(Cl2/2 Cl-) = 1,36 В;
φо(SO4²-)/ SO3²-) = 0,22 В.
Решение: Окислённая форма ОВ – пары (Cl2 + 2е- → 2 Cl -), имеющей большее положительное значение потенциала, является окислителем, а восстановленная форма ОВ – пары (SO4²- + 2Н+ + 2е- → SO3²- + Н2О), имеющей меньшее значение потенциала - восстановителем. Следовательно, Cl2 – окислитель, а SO3²- – восстановитель. При с.у. самопроизвольно идёт реакция Cl2 + Н2SО3 + Н2О → Н2SО4 + 2НCl
ЭДС реакции Ео = φо(ок-ля) - φо(вос-ля) = 1,36 – 0,22 = 1,14 В > 0.
Ответ: ОВР протекает самопроизвольно при с.у. справа налево,
Е0р-ции = 1,14 В > 0.
В состав лекарственных препаратов, рекомендуемых для лечения железодефицитной анемии, входят соли железа (II), которые легко окисляются даже на воздухе. Определите с помощью расчётов, может ли добавляемая в состав лекарственных препаратов аскорбиновая кислота препятствовать их окислению, если φ0(Fe3+/ Fe2+) = 0,77 В, а
φ0(дегидроаскорб. к-та / аскорб.к-та) = 0,14 В.
Решение:
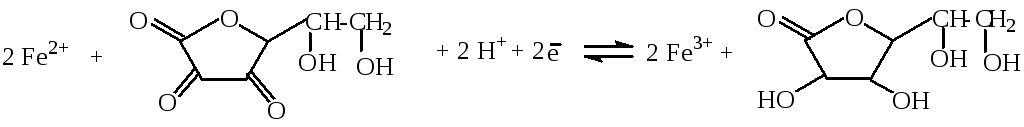
φ0(Fe3+ / Fe2+) > φо (дегидроаскорб.к-та / аскорб.к-та), поэтому окислителем является Fe3+, а восстановителем - аскорбиновая кислота.
Ео = φо(ок-ля) - φо(вос-ля) = 0,77 – 0,14 = 0,63 В.
Следовательно, реакция протекает справа налево.
Ответ: аскорбиновая кислота препятствует окислению Fe(II).
Фермент лактатдегидрогеназа (ЛДГ) катализирует реакцию:
Пируват + НАД(Н) +Н+ ↔ лактат + НАД+
окисл.форма восст.форма
Рассчитайте константу равновесия данной реакции.
Решение: Связь между ЭДС и Кравн выражается отношением –
nFE0
= -2,3 ∙ RTlgКравн;
а lgКравн
= ![]() ;
;
Для нахождения Е0 надо выделить две полуреакции:
пируват + 2Н+ +2е- ↔ лактат, φ01 = - 0,19 В
НАД+ + 2Н+ +2е- ↔ НАД(Н) +Н+, φ02 = - 0,32 В
(φ01 и φ02 – справочные данные).
E0 = φ01 (ок-ля) - φ01 (вос-ля) = - 0,19 – (-0,32) = 0,13 В.
Рассчитаем Кравн:
lgКравн
= ![]() = - 4,4; Кравн
= 3,98 ∙ 10-5.
= - 4,4; Кравн
= 3,98 ∙ 10-5.
Ответ: Кравн = 3,98 ∙ 10-5, равновесие смещено влево (Кравн < 1).
Определите какая из реакций пойдёт в первую очередь при добавлении Cl2 к смеси КВr и KI, если φ0 (Cl2/2Cl-) = 1,36 В;
φ0 = (Вr2/Вr-) = 1,07 В; φ0 = ( I2/ 2I-) = 0,54 В.
Решение: 2КВr + Сl2 → Вr2 + 2КСl
2КI + Сl2 → I2 + 2КСl
Е1 = φ0(Cl2/2 Cl-) - φ0 (Вr2/Вr-) = 1,36 – 1,07 = + 0,27 В.
Е2 = φ0(Cl2/2 Cl-) - φ0 ( I2/ 2I-) = 1,36 – 0,54 = + 0,82 В.
Ответ: так как Е2 > Е1, в первую очередь пойдёт реакция (2).
