
Теоретический курс_ХБАС_ЛЕЧ
.pdf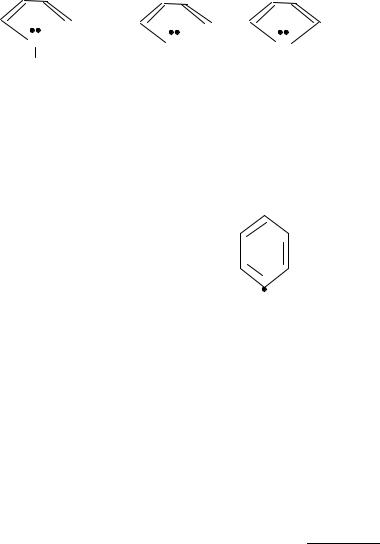
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Пяти- и шестичленные ненасыщенные гетероциклические соединения содержащие О, N, S, соответствуют критериям Хюккеля. Однако, наличие гетероатома приводит к неравномерному распределению электронной плотности в молекуле.
Для пятичленных гетероциклов характерно p,π-сопряжение. Ароматическая система у них образуется при взаимодействии четырех негибридизированных p-орбиталей атомов углерода, содержащих по одному электрону, и одной p-орбитали гетероатома с неподеленной электронной парой. При этом шестиэлектронное облако делокализуется на пяти атомах цикла. Такие системы называются электроноизбыточными. К ним относятся пиррол, фуран, тиофен:
N O
O  S H
S H
Для шестичленных циклов с одним или несколькими гетероатомами характерно π,π-сопряжение. Простейшим их представителем является пиридин. Его ароматическая система содержит 6 π-электронов. Она образуется при перекрывании пяти негибридизированных p-орбиталей атомов углерода и одной p-орбитали атома азота. При этом все орбитали поставляют в цепь сопряжения по одному электрону:
N
Хотя шестиэлектронное облако в пиридине делокализовано на шести атомах цикла, оно смещено в сторону более электроотрицательного атома азота. Поэтому система обеднена π-электронами и называется электронодифицитной.
К ароматическим также относятся пиримидин, пурин – соединения, содержащие два и более атомов азота.
Перечисленные гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью и поэтому служат структурными единицами важнейших биологически активных соединений. Так, пиридин, пиримидин, пурин – структурные компоненты нуклеиновых кислот. Четыре пиррольных ядра образуют порфин, который является основой гемоглобина и хлорофилла.
Таким образом,
1.Соединение ароматично, если оно имеет плоский замкнутый цикл и сопряженную π-электронную систему, охватывающую все атомы цикла и содержащую (4n+2) π-электронов.
11

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
2.Сопряжение – это явление выравнивания длин связей и делокализации плотности в реальной молекуле (частице) по сравнению с идеальной, но не существующей структурой.
Тема 2 Электронные эффекты заместителей. Пространственное строение
органических молекул
Ключевые слова и понятия: индуктивный эффект, мезомерный эффект, электроакцепторный заместитель, электродонорный заместитель, конформация, конфигурация
Реакционная способность органических соединений в значительной степени зависит от распределения электронной плотности в молекулах до начала химического взаимодействия. При этом характер распределения электронной плотности определяется действием электронных эффектов заместителей. Различают индуктивный / I -/ и мезомерный / M -/ эффекты.
Индуктивный эффект – это передача электронного влияния заместителя по цепи δ-связи. При этом заместитель вызывает поляризацию не только своей δ- связи с атомом углерода, но передаёт влияние /оказывает эффект/ по цепи, что ведёт к появлению и на других углеродных атомах частичных зарядов /δ/. Вследствие слабой поляризуемости δ-связи индуктивный эффект максимально проявляется на двух ближайших к заместителю атомах углерода и затухает в цепи через 3-4 часа δ-связи.
Заместители, смещающие электронную плотность по цепи δ – связей на себя, т.е. уменьшают ее в системе, проявляют отрицательный индуктивный /-I/- эффект и называются электроноакцепторными /ЭА/. Это галогены и группы атомов более отрицательные, чем атом водорода, индуктивный эффект которого принят за ноль.
Заместители, смещающие электронную плотность на себя, т.е. увеличивающие ее в цепи δ-связей, проявляют положительный индуктивный /+I /-эффект и называются электронодонорными /ЭД/. К ним относятся атомы металлов и алкильные группы.
Графически индуктивный эффект изображается стрелкой, совпадающей с δ–
связью и направленной к более электроотрицательному атому:
-I- эффект: R→ CH2+δ→CH2++δ→X-δ; X=-OH,-NH2,-NO2, NI, –COOH.
I эффект = 0: R- CH2 – CH2 - H
+I – эффект: R←CH2-δ← CH2--δ←Y+δ;Y= CH3,-C2H5, атомы металлов.
Мезомерный М-эффект или эффект сопряжения – это передача электронного влияния заместителя по системе π–связей. Т.е. перераспределение электронной плотности в сопряженной системе под влиянием заместителя, являющегося ее участником. Чтобы заместитель входил в сопряженную систему, он должен иметь либо двойную связь /ππсопряжение /, либо гетероатом с неподеленной парой электронов / pπсопряжение /. В отличии от индуктивного мезомерный
12
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
эффект передается по цепи сопряженных связей без затухания и на значительно большие расстояния. Графически он изображается изогнутыми стрелками, начало которых показывает какие – π или p-электроны смещаются, а конец – связь или атом, к которым смещаются эти электроны. При этом на концевых атомах сопряженной цепи указывают образующиеся частичные заряды / δ /.
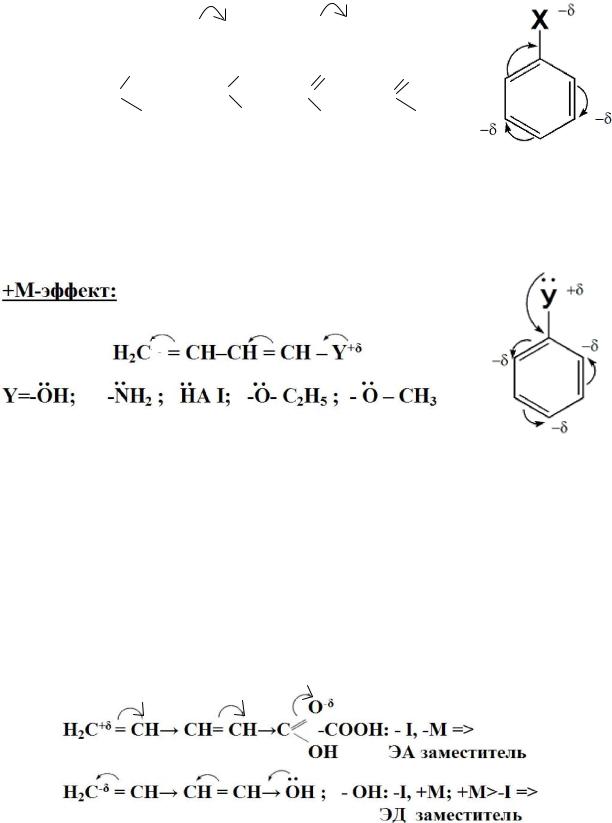
Заместители, смещающие электронную плотность на себя и уменьшающие ее в сопряженной системе, проявляются отрицательный мезомерный –М-эффект. Это положительно заряженные частицы или группы атомов, содержащие кратные связи:
- М-эффект: Н2С+δ = СН – СН = С-δН – Х-δ
О |
О |
O |
O |
Х= - С |
; -С |
; - S – OH ; - N |
|
ОН |
Н |
O |
O |
Заместители, смещающие электронную плотность от себя и повышающие ее в сопряженной системе, проявляют положительный мезомерный +М-эффект. К ним относятся гетероатомы или группы, включающие гетероатом, с неподеленной электронной парой или целым отрицательным зарядом:
-δ
Поскольку двойные связи содержат как π-, так и δ-связи, то при оценке влияния заместителя на распределение электронной плотности в сопряженной системе, необходимо учитывать суммарное действие индуктивного и мезомерного эффектов. Положительный мезомерный +М-эффект преобладает над отрицательным индуктивным –I-эффектом для всех заместителей кроме галогенов. Для них –I > +М. Алкильные группы / радикалы R / не проявляют мезомерного эффекта, для них характерен только + I-эффект. С учетом этого заместители в сопряженных системах также подразделяются на электронодонорные /ЭД/, повышающие электронную плотность, и электроноакцепторные /ЭА/,понижающие электронную плотность в молекуле:
13

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Таким образом, поляризация связей и электронные эффекты заместителей обуславливают неравномерность распределения электронной плотности и возникновение в органических молекулах реакционных центров – мест с частичным положительным и отрицательным зарядом, которые могут подвергаться атаке противоположно заряженных частиц.
Пространственное строение органических молекул
Реакционная способность органических соединений и их биологическая активность зависят также от химического и пространственного строения молекул. Для описания расположения атомов в молекуле используют три основные понятия – химическое строение, конфигурация и конформация. Они характеризуют различные, постепенно усложняющиеся уровни организации
структуры молекулы. |
|
|
|
|
|
Химическое |
строение |
молекулы |
определяется |
природой |
и |
последовательностью связывания атомов, ее составляющих. Оно тесно связано с изомерией. Изомерия заключается в том , что одному и тому же составу и молекулярной форме может соответствовать несколько реально существующих
органических соединений. Различают |
структурные и пространственные |
изомеры. |
|
Структурные изомеры или изомеры строения, имея одинаковый состав, отличаются химическим строением, т.е. природой и последовательностью связей в молекуле. Их делят на группы:
1.изомеры цепи – C4H10 бутан и изобутан;
2.изомеры положения : а) кратных связей – C4H8 бутен-1, бутен-2; б) функциональных групп – C3H8O пропанол-1, пропанол-2;
3.изомеры строения функциональных групп – C3H6O пропаналь, пропанон. Пространственные изомеры или стереомеры, имея одинаковый состав и
химическое строение, отличаются пространственным расположением атомов в молекуле. Их изучает стереохимия – химия соединений в трехмерном пространстве. Различают конфигурационные и конформационные изомеры.
Конфигурация – это пространственное расположение атомов в молекуле без учета различии, возникающих вследствие вращения вокруг одинарных δ– связей. Следовательно, конфигурационные изомеры – это стереомеры с различным расположением в пространстве заместителей / атомов или групп атомов / относительно конкретного атома углерода, а также относительно друг друга. Такие изомеры могут переходить друг в друга только путем разрыва одних и образования других химических связей.
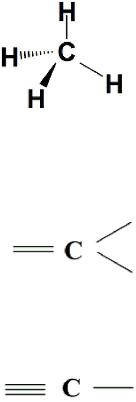
Конфигурация связана с валентным состоянием атома углерода, т.е. типом его гибридизации. Так, атом углерода в состоянии
sp3-гибридизации имеет тетраэдрическую конфигурацию и называется тетраэдрическим. При этом, если все четыре заместителя у него одинаковы /
14
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
CH4 метан, CCl4 тетрахлорметан /, то его пространственная модель – правильный тетраэдр, в центре которого находится атом углерода, а в вершинах располагаются заместители. Валентные углы при этом - 109˚5΄, их называют нормальными. Если же с атомом углерода связаны не одинаковые заместители / CH4Cl хлорметан /, то он сохраняет тетраэдрическую конфигурацию, но валентные углы отклоняются от нормальных и могут принимать значение от 111 до 113˚.
На плоскости тетраэдрическую конфигурацию изображают с помощью стереохимических формул, в которых атом углерода и две δ-связи / их изображают черточками / располагают в плоскости бумаги. Две другие связи не будут находится в данной плоскости. Одну из них, направленную к наблюдателю, обозначают сплошным клином; другую, расположенную за плоскостью, - штрихованным клином. Например, стереохимическая формула метана имеет вид:
Для атома углерода в состоянии sp2-гибридизации / алкены/ характерна плоскостная конфигурация: атом углерода и все три заместителя, с одним из которых двойной связью, располагаются в одной плоскости. Валентные углы при этом близки к 120º.
В spгибридизованном состоянии / алкины / атом углерода имеет линейную конфигурацию с валентными углами, близкими к 180º. При этом оба заместителя находятся с ним в одной плоскости:
Конформация молекулы – это ее пространственная геометрическая форма. Или это один из нескольких возможных способов взаимного расположения в пространстве непосредственно не связанных между собой заместителей, принадлежащих атому углерода, соединенных одинарной C – C δ -связью, причем, каждый из этих углеродных атомов уже характеризуется определенной конфигурацией. Следовательно, конформационные изомеры – это стереоизомеры, различие между которыми вызвано поворотом отдельных участков молокулы вокруг одинарных δ-связей. Такие изомеры переходят друг в друга без нарушения химического строения молекулы, т.е. без разрыва связей и изменения природы и последовательности. Угол поворота δ-связи называется
15

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
торсионным, его минимальная величина 60º. Поэтому при полном обороте на 360º могут образоваться шесть конформаций или конформационных изомеров.Причем, конформации, в которых заместители максимально приближены друг к другу, обладают высокой энергией, большой неустойчивостью и называются заслоненными. В них свободное вращение вокруг δ-связей затруднено из-за наличия двух видов напряжения:
1) торсионного,вызванного взаимодействием связей, когда они находятся друг против друга , и 2) Ван-дер-Ваальсового, обусловленного силами отталкивания между валентно не связеннымя объемными заместителями / типа CH3 /, когда они располагаются на расстоянии, примерно равном сумме их Ван-дер- Ваальсовых радиусов. Только между атомами водорода, имеющими небольшой радиус, силы отталкивания отсутствуют.Конформации, в которых заместители наиболее удалены друг от друга в пространстве, вследствие отсутствия напряжений, обладают высокой устойчивостью, минимальной энергией и называются заторможенными.
Конформация соединений с открытой (незамкнутой) цепью
Вгомологическом ряду предельных углеводородов этан является первым
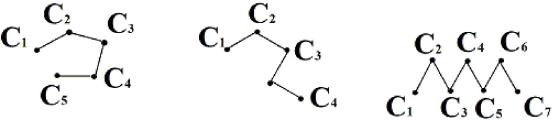
ипростейшим соединением, имеющим конформационные изомеры. Для их изображения используют проекционные формулы Ньюмена, получаемые при проециировании молекулы на плоскость вдоль С-С связи. При этом удаленный атом углерода и три его связи обозначаются кругом с отходящими от него черточками.Ближний углеродный атом и его связи – точкой внутри этого круга с расходящимися от нее черточками. Конформации образуются путем вращения одного атома углерода с его заместителями вокруги С-С δ-связи. Угол каждого поворота - 60º.
Перспективная формула этана:
C2
C1
Конформации этана, изображенные с помощью проекционных формул Ньюмена:
1,3,5- заслоненные конформации; 2,4,6- заторможенные.
16
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
В обычных условиях конформации легко переходят друг в друга, поэтому выделить конформационные изомеры в индивидуальном виде нельзя. Они существуют как равновесная смесь различных изомеров.
Открытые многоуглеродные цепи из-за возможности одновременного вращения вокруг нескольких С-С δ-связей могут находитсься в отном из трех
конформаций : |
|
|
Клешневидной |
Нерегулярной |
Зигзагообразной |
Наиболее устойчива зигзагообразная конформация, т.к. в ней все атомы углерода максимально удалены друг от друга и напряжение, практически, отсутствует. В такой конформации длинноцепочечные жирные кислоты входят в состав липидов клеточных мембран и витаминов / ретинол, ретиналь /. Однако для образования устойчивых биологически активных соединений с пяти- и шестичленными циклами наиболее выгодна клешневидная конформация молекул. В ней сближаются в пространстве атомы углерода С1 и С5, С1 и С6 и их функциональные группы, удаленные в зигзагообразной цепи. Это создает возможность внутримолекулярного взаимодействия функциональных групп. Так образуются циклические формы ангидридов, амидов, моносахаридов.
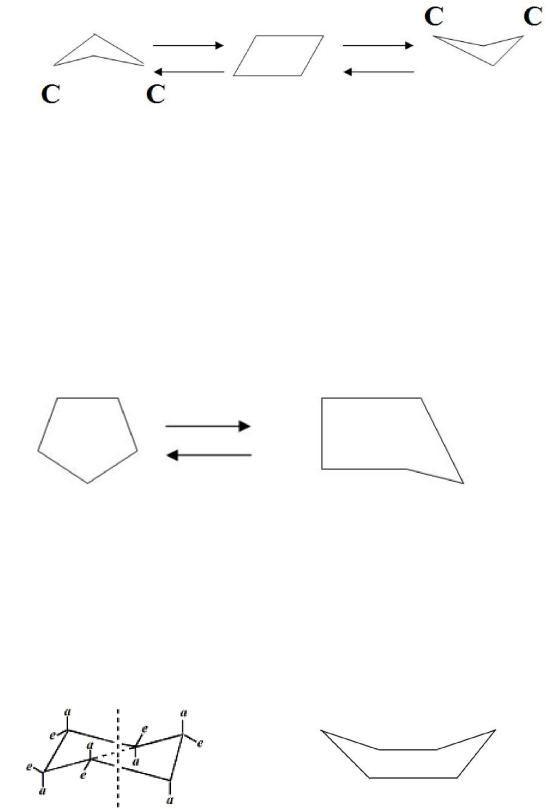
Конформации циклических соединений Для циклоалканов кроме торсионного и Ван-дер-Ваальсова еще
характерно угловое напряжение, обусловленное наличием замкнутой цепи и отклонением валентных углов в цикле от нормального значения 109º5´. Снижение напряжения в таких системах происходит путем их перехода в неплоские конформации. Наиболее устойчивыми и напряженными являются малые – трех- и четырехчленные циклы.
В молекуле циклопропана наблюдается два вида напряжения: торсионное, т.к. все атомы находятся в заслоненном положении, и угловое, т.к. валентные углы много меньше нормального и равны 60º. Однако, несмотря на сильное напряжение, система остается настолько жесткой, что вращение вокруг δ-связей невозможно. Поэтому у циклопропана нет конформационных изомеров. Это единственный плоский цикл. Большое напряжение обуславливает его неустойчивость, поэтому большинство реакций с циклопропаном протекает разрывом цикла.
Плоский четырехчленный цикл – циклобутан испытывает значительное угловое / валентные углы 90º / и торсионное напряжение / все атомы водорода в заслоненном положении /.Это напряжение частично снижается за счет
17
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
поворота мителеновых групп вокруг С-С δ-связи и образования двух неплоских структур, в которых два атома углерода располагаются выше или ниже плоскости, в которой находятся два других углеродных атома:
Напряженный четырехчленный цикл редко встречается в природных соединениях. Однако, важная группа антибиотиков – пенициллины – содержат циклобутановое кольцо с атомом азота.
У пятичленного цикла – циклопентана – в плоской форме угловое напряжение, практически, отсутствует, т.к. валентные углы близки к нормальным и равны 108º. Но проявляется торсионное напряжение, снижающееся при переходе системы в неплоскую конформацию «конверта». При этом один из пяти атомов углерода поочередно выходит из плоскости, в которой расположены остальные четыре. Поэтому цикл находится как бы в постоянном волнообразном движении. Пятичленные циклы термодинамически устойчивы и поэтому являются структурными компонентами нуклеиновых кислот и многих лекарственных веществ.
В шестичленном цикле – циклогексане проявляется крайне сильное угловое / валентные углы много больше нормальных и равны 120º / и торсионное напряжение / все атомы водорода в заслоненном положении /. Поэтому циклогексан и его производные не могут существовать в плоской форме, а за счет поворота атомов углерода вокруг δ-связей переходят в менее напряженные неплоские конформации с валентными углами 109º5´. Из шести возможных наиболее устойчивы для циклогексана и его производных две конформации: «кресло» и «ванна»:
Однако, в конформации «ванны» наблюдается незначительное торсионное напряжение, поэтому наиболее энергитически выгодной и
18

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
устойчивой является конформация «кресла», в которой отсутствуют все три вида напряжений. Вследствие этого при комнатной температуре 99.9% молекул циклогексана существуют в конформации «кресла».
Вкресловидной форме циклогексана шесть связей С-Н расположены параллельно оси симметрии и направлены попеременно вверх и вниз, они называются аксильные / а /. Остальные шесть связей тоже направлены попеременно вверх и вниз, но под углом к оси симметрии в 109º5´, они называются экваториальные / е /. Т. е. У каждого атома углерода в цикле одна связь с атомом водорода – аксильная, другая – экваториальная.
Вмонозамещенных производных циклогексана термодинамически более выгодным является экваториальное располажение заместителя. При наличии большего числа заместителей также наиболее выгоднои их экваториальное расположение, но есть исключения, например, у цис-цикло-гександиола-1,3 ОН-группы располагаются аксильно, что способствует образованию между ними водородной связи, которая стабилизирует молекулу, делая ее более термодинамически устойчивой:
Циклогексановое кольцо – структурный фрагмент многих биологически активных соединений: миоинозита, стрептомицина, стероидов и др. В большинстве случаев оно имеет форму «кресла» и лишь в некоторых соединениях. Например, в камфоре – форму «ванны».
19

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Тема 3 Классификация химических реакций и механизмы их осуществления
Ключевые слова и понятия: реакционная способность, субстрат, реагент, реакционный центр, электрофильный реагент, нуклеофильный реагент, карбокатион, карбанион.
Способность вещества вступать в ту или иную химическую реакцию и реагировать с меньшей или большей скоростью называется его реакционной способностью. Вещество, которое подвергается воздействию и в котором в результате этого воздействия у атома углерода происходит разрыв старой и образование новой связи, является субстратом. Воздействующее соединение - реагентом. Реакционная способность данного субстрата должна рассматриваться только по отношению к его реакционному партнёру, т.е. к конкретному реагенту. Химические реакции сопровождаются перераспределением электронов внешних оболочек атомов реагирующих веществ. В результате образуются новые, более стабильные системы с меньшей свободной энергией. В органических реакциях в ходе превращения обычно затрагивается не вся молекула, а только её часть – реакционный центр.
Реагенты, атакующие реакционный центр, могут быть трёх основных
типов:
1.Радикальные реагенты /радикалы/ - это электронейтральные частицы /атомы или группы атомов/ с неспаренным электроном. Они образуются под воздействием излучения или высоких температур при гомолитическом расщеплении ковалентной связи вследствие симметричного разрыва электронной пары /Cl•, Br•, CH3•/:
А: В hv А• + В•
2.Электорофильные реагенты – это частицы с неполностью заполненным
валентным электронным уровнем. Это нейтральные молекулы /SO3/ и положительно заряженные частицы H+ , Br+ , NO2+. Электрофилы являются электроноакцепторными реагентами, т.к. имея недостаток электронной плотности, новую ковалентную связь образуют за счёт пары электронов атакуемого ими атома углерода в субстрате. Такие реагенты рассматриваются как окислители.
3.Нуклеофильные реагенты – это частицы, имеющие электронную пару на
внешнем электронном уровне. К ним относятся отрицательно заряженные ионы Cl- , Br-, OH-; молекулы с неподелённой парой р-электронов NH3 , H2O, R– OH. А также молекулы, содержащие π-электроны кратных связей H2C= CH2, C6H6. Нуклеофилы являются электронодонорными реагентами, т.к. для образования новой ковалентной связи с атомом углерода в субстрате они предоставляют собственную пару электронов. Эти реагенты относят к восстановителям.
20
