
Теоретический курс_ХБАС_ЛЕЧ
.pdf
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Электрофилы и нуклеофилы образуются при гетеролитическом разрыве ковалентной связи в реагенте. При этом электронная пара остаётся у одной из
образующих частиц: |
|
|
E : Y |
E+ + Y- |
/:Y/ |
реагент |
электрофил |
нуклеофил |
Следует отметить, что одни и те же вещества в зависимости от условий протекания реакции и природы атакующего реагента могут проявлять как нуклеофильные /восстановительные/, так и электрофильные /окислительные/ свойства.
Систематизация реакций позволяет свести многообразие химических превращений к небольшому числу типов. Органические реакции можно классифицировать:
1.по характеру изменения связей в субстрате и реагенте;
2.по направлению реакции с учётом конечного результата;
3.по числу молекул, участвующих в лимитирующей стадии процесса.
В соответствии с природой реагента и характером разрыва связи в субстрате различают:
1. радикальные, гомолитические реакции, в которых действуют радикальные реагенты и происходит гомолитический разрыв связи в субстрате:
-С : Н + •R |
-C• + H:R |
субстрат реагент
2. ионные, гетеролитические реакции, в которых действуют ионные реагенты /нуклеофильные или электрофильные/ и происходит гетеролитический разрыв связи в субстрате:
а/ электрофильные /Е/:
-C : X + E+ -C: E + X+
субстрат реагент
б/ нуклеофильные /N/ :
-C : X + :Y-  -C:Y +:X-
-C:Y +:X-
субстрат реагент Следует отметить, что в гетеролитических реакциях в качестве
промежуточных частиц часто присутствуют карбокатионы и карбанионы, образующиеся при гетеролитическом разрыве ковалентной связи в субстрате. При этом, если электронная пара переходит к атому углерода, то образуется
21

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
карбанион – отрицательно заряженная частица с избытком электронов. Если же электронная пара переходит к атому Х /функциональная группа/, то образуется карбокатион – положительно заряженная частица с недостатком электронов:
-C : X  -C:- + X+
-C:- + X+
субстрат |
карбанион |
|||
|
|
|
||
|
|
|
|
|
-C : X |
-C+ + :X- |
|||
|
|
|
|
|
субстрат |
карбокатион |
|||
3. |
синхронные или согласованные реакции, в которых разрыв старых связей |
|||
и образование новых происходит одновременно и без участия радикальных или ионных /заряженных/ частиц. Такие реакции протекают при облучении или нагревании ; для них теряют смысл понятия “субстрат” и “реагент” :
бутадиен-1, 3 этилен циклогексен
По направлению с учётом конечного результата органические реакции делятся на:
1. |
реакция замещения /S/ : |
1. Радикального |
SR |
|
|
2. Ионного : |
|
|
|
а/ электрофильного |
SE |
|
|
б/ нуклеофильного |
SN |
2. |
реакции присоединения /А/: |
1. Радикального |
AR |
|
|
2. Ионного: |
|
|
|
а/ электрофильного |
AE |
|
|
б/ нуклеофильного |
AN |
3.реакции отщепления или элиминирования /Е/.
4.реакции перегруппировки, при которых происходит переход /миграция/ отдельных атомов или групп атомов от одного участка молекулы к другому. Например, в результате перегруппировки изменяется углеродный скелет молекулы, и пентан превращается в изопентан.
5.реакции окисления и реакции восстановления, пи которых меняется степень окисления атома углерода, являющегося реакционным центром. Степень окисления атома углерода соответствует числу его связей с элементами более электроотрицательными, чем водород.
22

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
По числу молекул, участвующих в лимитирующей стадии, т.е. стадии, определяющей скорость всего суммарного процесса, различают: мономолекулярные, бимолекулярные и тримолекулярные реакции. Последние встречаются крайне редко.
Следует отметить, что деление реагирующих веществ на субстрат и реагент, также, как и приведённая классификация реакции, достаточно условны. Поскольку любую реакцию можно одновременно охарактеризовать и по типу разрыва связи, и по конечному результату, и по количеству молекул, участвующих в лимитирующей стадии процесса.
Реакции радикального замещения у насыщенного атома углерода (SR)
В насыщенных углеводородах /алканы и циклоалканы/ имеются только sp3 – гибридизованные атомы углерода. Для них характерны прочные неполярные С–С и почти полярные С–Н - связи. Эти связи не склонны к гетеролитическому разрыву под действием электрофильных или нуклеофильных реагентов. Поэтому для насыщенных углеводородов характерны реакции радикального замещения /SR/. Они протекают по свободнорадикальному механизму при участии высокоэнергетических радикальных частиц. Так осуществляется галогенирование насыщенных углеводородов при
облучении. Рассмотрим реакцию монохлорирования метана: hv CH3Cl + HCl
Приведённое уравнение отражает суммарный процесс, который включает несколько стадий:
1.инициирование – гомолитический разрыв связи в реагенте под действием
облучения; образование радикалов: Cl : Cl hv Cl• + Cl•
2.рост цепи – атака радикалом молекулы субстрата: гомолитичнский
разрыв связи С–Н в |
субстрате; образование новой молекулы и нового |
радикала: |
|
CH3 : H + • Cl |
CH3• + HCl |
CH3• + Cl : Cl |
CH3Cl + Cl• и т.д. |
На каждой стадии роста цепи образуется продукт реакции и свободный радикал, который атакует новые молекулы, т.е. происходит цепная реакция.
3.обрыв цепи возможен при взаимодействии двух любых радикалов:
Cl• + Cl• = Cl2; CH3• + Cl• = CH3Cl; CH3• + CH3• = C2H6.
В многоуглеродных молекулах алканов последовательность радикальной атаки углерода следующая:
23
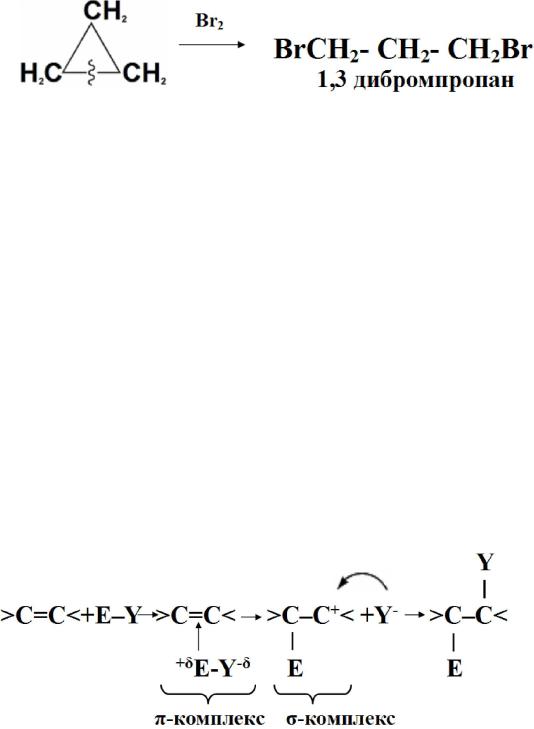
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Предпочтительное протекание реакции по одному из нескольких возможных реакционных центров молекулы называется региоселективностью.
В циклических алканах радикальное замещение происходит аналогично, за исключением циклопропана и циклобутана, для которых характерны реакции присоединения, идущие с разрывом цикла:
Реакции электрофильного присоединения к ненасыщенным соединениям (AE) Ненасыщенные углеводороды – алкены, циклоалкены, алкины проявляют способность к реакциям присоединения, т.к. содержат двойные и тройные связи. Однако, для многих биохимических процессов более важной является двойная связь – её возникновение и превращения. В связи с этим реакции
электрофильного присоединения будут рассмотрены на примере алкенов.
В молекулах алкенов за счёт электронов π- связи имеется область повышенной электронной плотности. Поэтому они являются нуклеофилами и склонны подвергаться атаке электрофильных реагентов. Присоединение происходит по месту разрыва кратной связи. Реакция протекает стадийно через образование π и –комплексов и сопровождается гетеролитическим разрывом связи в реагенте.
Механизм реакции: при сближении реагента с π- связью его молекула поляризуется с образованием активной электрофильной частицы. Эта частица затем атакует π- связь. В результате образуется устойчивый π- комплекс. Далее происходит: 1/ гетеролитический разрыв связи в реагенте; 2/ присоединение электрофила к молекуле; 3/ отщепление нуклеофильной частицы и образованиекомплекса / карбокатиона/. Затем образовавшийся нуклеофил атакует карбокатион и присоединяется в трансположение. Так получается продукт реакции:
По механизму электрофильного присоединения в организме осуществляется реакция гидратации, т.е. присоединение к ненасыщенным молекулам воды в присутствии кислот.
24

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Следует далее отметить, что при взаимодействии реагентов типа Н–Х с несимметричными алкенами водород присоединяется к наиболее гидрогенизированному атому углерода двойной связи, т.е. атому углерода, содержащему большее число атомов водорода (правило Марковникова):
(SE)
над и под плоскостью ароматического цикла, являясь нуклеофилом, также восприимчиво к атаке электрофильных реагентов. Однако, в отличие от алкенов реакция протекает по механизму электрофильного замещения \SE\, при котором не происходит нарушения ароматической системы. Механизм таких реакций включает следующие стадии:
1.генерирование электрофильной частицы с помощью катализатора:
поляризация |
разрыв |
молекулы |
связи |
E–Y ––––––––––> E+δ –> Y-δ ––––––––––> E+ + Y-
2.атака электрофилом бензольного ядра и образование π – комплекса;
3.образование δ- комплекса: электрофил «забирает» два электрона
π –системы и образует δ-связь с обним из атомов углерода бензольного кольца. Ароматичность нарушается, т.к. этот атом углерода переходит в sp3 – гибридизованное состояние;
4.отщепление протона от δ- комплекса, восстановление ароматической системы;
5.связывание отщепившегося протона с нуклеофилом.
Ориентирующее действие заместителей в бензольном ядре.
При взаимодействии бензола с электрофилом равновероятна атака любого из шести углеродных атомов ароматического кольца, что ведёт к образованию единственного монозамещённого продукта. Если же в ароматическом ядре находится какой-либо заместитель, то он оказывает влияние на распределение электронной плотности в системе и направляет следующий заместитель /входящую группу/ в орто-, параили метаположение.
Электронодонорные заместители (заместители I рода) активируют ароматическое кольцо, облегчают электрофильное замещение по сравнению с
25

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
незамещённым бензолом и направляют входящую группу в орто- и параположения. Это группы, проявляющие положительный индуктивный эффект (алкилы –CH3, -C2H5) и положительный мезомерный эффект (OH,O-R, NH2):
Электроноакцепторные заместители (заместители II рода) - это группы, проявляющие отрицательный индуктивный или отрицательный мезомерный эффекты (-COOH, -COH, -CN, -NO2 , -SO3H). Они затрудняют реакции электрофильного замещения по сравнению с незамещённым бензолом. Реакции идут в более жёстких условиях. Входящая группа вступает в мета-положение:
Исключение – галогены. Для галогенов –I >> +М. Они являются ЭА заместителями, но направляют входящую группу в орто- и параположения, т.е. относятся к ориентантам I рода.
Правила ориентации не абсолютны; речь идёт лишь о преимущественном направлении реакции.
26
Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Тема 4 Спирты. Фенолы. Альдегиды. Кетоны
Ключевые слова и понятия: первичный, вторичный, третичный спирт, таутомерия, таутомер.
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
По строению углеводородного радикала спирты подразделяют на
насыщенные, ненасыщенные, циклические, ароматические. По числу гидроксигрупп — на одно—, двух—, трех— и многоатомные.
Алифатические одноатомные спирты имеют общую формулу СnH2n+1OH . Их изомерия связана со строением углеводородного скелета и положением в цепи гидроксильной группы. Если углеродный атом, при котором находится ОН—группа, связан только с одним атомом углерода, спирт является первичным; с двумя углеродными атомами — вторичным; с тремя —
третичным:
|
|
|
|
|
|
| |
|
|
H |
|
H |
|
|
— C — |
|
| |
| |
| |
| |
| |
| |
| |
| |
— С — С — Н |
— C — C — C— |
— C — C — C — |
|||||
| |
| |
| |
| |
| |
| |
| |
| |
|
OH |
|
OH |
|
|
OH |
|
первичный |
вторичный |
третичный |
|||||
Химические реакции, в которые вступают спирты, условно можно разделить на 3 группы:
сразрывом связи RO — H (замещается только атом водорода);
сразрывом связи R — OH (замещается или отщепляется гидроксильная группа);
окислительно—восстановительные (изменяется степень окисления атома углерода, связанного с ОН—группой).
Рассмотрим некоторые реакции из названных групп:
1. При окислении первичных спиртов образуются альдегиды;
вторичных — кетоны: |
|
|
|
|
||
|
|
|||||
H |
|
O |
|
H |
O |
|
| |
|
| |
|
|
|
// |
|
|
|
|
|||
R — C — OH |
[O] |
R— C — |
OH R — C — H + H2O |
|||
|
||||||
| |
|
| |
|
|
|
|
|
|
|
|
|
||
H |
|
H |
|
|||
27

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
H |
|
O H |
O |
| |
|
| |
|| |
R1— C — R2 |
R1 — C — R2 |
R 1— C — R2 + H2O |
|
|
[O] |
|
|
| |
|
| |
|
OH |
|
OH |
|
2. Спирты, практически, не проявляют кислотных свойств. Они не реагируют со щелочами, но при действии металлического натрия
образуют алкоголяты: |
|
2 R — OH + 2Na 2 R — ONa |
+ H2 |
3. Реакции нуклеофильного замещения (SN). В спиртах sp3-
гибридизованный атом углерода связан с кислородом ОН-группы одинарной - связью. Причем, электроны связи смещены к более электроотрицательному атому кислорода. Вследствие этого углеродный атом приобретает частичный положительный заряд + и склонен подвергаться атаке нуклеофильного реагента. При этом нуклеофил предоставляет свою электронную пару для образования новой связи с углеродным атомом субстрата, а уходящая ОН-
группа отщепляется со своей парой электронов: |
|
|||
|
|
|
|
|
|
+ - |
| |
|
|
R—C OH + |
:Y— R—C—Y + :OH— |
|||
| |
|
| |
|
|
|
субстрат |
реагент |
уходящая группа |
|
|
|
|
(нуклеофил) |
|
ОН - плохо уходящая группа, поэтому реакцию проводят в присутствии катализатора — кислоты. Этот механизм, в частности, реализуется при взаимодействии спиртов с галогеноводородами:
H H
|+ - + - R—C OH + H-Br
| 
Н
|
| |
Н |
R— C —Br + H2O |
|
|
|
| |
|
Н |
4. Реакция элиминирования (Е) или отщепления конкурирует с нуклеофильным замещением и сопровождается внутримолекулярным отщеплением молекулы воды и образованием ненасыщенного соединения:
|
Н 2SO4 |
(к) |
R—CН=СН2 + Н2О |
R—C—СH2 |
|||
| |
| |
|
|
Н |
ОН |
|
|
28

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
5. При межмолекулярной дегидратации, когда молекула воды отщепляется от двух молекул спиртов, получаются простые эфиры:
..
R —OH + H O—R Н SO (к) R —O—R + H O
1 2 2 4 1 2 2
6. При взаимодействии спиртов с органическими или минеральными кислотами образуются сложные эфиры:
- |
|
|
|
|
O |
|
O |
|
|
.. |
\\ + |
|
|| |
|
R1 — O H + |
C — R2 |
Н |
— O — C — R2 |
+ H2O |
R1 |
||||
/
НО
Из минеральных наибольшее значение имеет фосфорная кислота, т.к. замещение трудно уходящей спиртовой группы -ОН происходит в организме путем ее превращения в эфиры фосфорной, дифосфорной и трифосфорной кислот:
|
O |
|
O |
|
|
|| |
|
|| |
|
R — O H + HO — P — OH R — O — P — OH + H2O |
||||
|
| |
|
| |
|
|
OH |
|
OH |
|
|
|
|
эфир фосфорной кислоты |
|
O |
O |
O |
O |
O |
|| |
|| |
|| |
|| |
|| |
R — O — P — O — P — OH R — O — P — O — P — O — P — OH |
||||
| |
| |
| |
| |
| |
OH |
OH |
OH |
OH |
OH |
эфир дифосфорной кислоты |
эфир трифосфорной кислоты |
|||
Анионы этих кислот — более легко уходящие группировки по сравнению с ОН—группой:
O |
О |
О |
O |
O |
O |
|| |
|| |
|| |
|| |
|| |
|| |
-O — P — O- -O — P — O — P — O- |
-О — Р — О — Р — О —Р —О- |
||||
| |
| |
| |
| |
| |
| |
O- |
O- |
O- |
O- |
O- |
O- |
фосфат—ион |
дифосфат — ион |
трифосфат—ион |
|
||
29

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Кроме этого, ди- и трифосфорные эфиры составляют основу АДФ и АТФ, которые из—за наличия в них макроэргических связей, являются в организме источниками энергии.
7. Качественной реакцией на многоатомные спирты является их взаимодействие с Сu(ОН)2 с образованием хелатного комплекса синего цвета:
СН2ОН |
+2NaОН |
CH2 — O |
Cu |
O — CH2 |
-2 |
| |
| |
| |
+ 2Na+ |
||
2 СНОН + Cu(OH)2 |
|
СН — О |
|
O — CH |
|
| |
-4Н2О |
| |
|
| |
|
СН2ОН |
|
CH2 — OH |
CH2OH |
|
|
Биологически активные представители спиртов:
Одноатомные:
СН3ОН — метанол — обладает наркотическим действием; крайне токсичен, т.к. в организме преобразуется в яды — формальдегид и муравьиную кислоту. Уже в небольших дозах (10 мл) может вызывать слепоту.
С2Н5ОН — этанол — естественный метаболит. В больших дозах оказывает опьяняющее и наркотическое действие. При этом воздействует на ЦНС вначале возбуждающе, а затем угнетающе, притупляя чувствительность, ослабляя функцию мозга и мышечной системы, ухудшая реакцию. Его длительное употребление приводит к алкоголизму. В медицине используется как антисептик и растворитель лекарственных средств.
CH 3
OH
CH
H3C CH3
— ментол — относится к терпенам. Входит в состав сердечно—со-судистых средств, зубных порошков и паст.
В природе также встречаются первичные спирты с числом углеродных атомов от 6 до 30. Они входят в состав бактерий.
30
