
Теоретический курс_ХБАС_ЛЕЧ
.pdf
Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only.
Многоатомные:
Н2С — СН — СН2
| | |
OH OH OH
|
OH |
HO |
OH |
|
|
HO |
OH |
|
OH |
—глицерин — важнейший биогенный спирт. В виде сложных эфиров высших жирных кислот входит в состав жиров, а также фосфатидной кислоты — родоначальника большинства липидов биологических мембран. В медицине применяется как увлажнитель фармацевтических препаратов.
—миоинозит — шестиатомный спирт циклогексанового ряда. Содержится в почках, печени, мышцах, мозгу. Это—витаминоподобное соединение; является фактором роста, а также структурным компонентом ряда биорегуляторов биохимических процессов.
Наличие гидроксильных групп в молекуле повышает растворимость вещества в воде и увеличивает его токсичность и наркотическое действие. Эти свойства усиливаются с удлинением углеродной цепи, проходя через максимум при С6—С8; с разветвлением цепи, а также при переходе от первичных спиртов к вторичным и третичным. Присутствие галогенов или кратных связей в молекуле спирта тоже усиливает его наркотическое действие. Кроме того, причиной токсичности спиртов в организме могут служить продукты их метаболических превращений.
Ф Е Н О Л Ы.
Производные ароматических углеводородов, содержащие одну или более гидроксильных групп, называются фенолами. В зависимости от числа ОНгрупп различают одно- и многоатомные фенолы (двух, трехатомные).
Фенолы проявляют более выраженные кислотные свойства, чем спирты. Это обусловлено тем, что ОН-группа проявляет +М-эффект и смещает электронную плотность в сторону бензольного ядра. Вследствие этого атом водорода в ОН-группе приобретает большую подвижность. Поэтому фенолы взаимодействуют не только с металлическим натрием, но и с NaOH, образуя
феноляты:
:О Н |
|
ОNa |
||||
|
|
+ NaOH |
|
|
|
+ H2O |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для обнаружения фенолов используют FeCl3. Различные фенолы дают с ним различное окрашивание.
31

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Представители биологически активных фенолов:
ОН
|
—одноатомный фенол — карболовая кислота — антисептик, используется в производстве лекарственных средств.
Антисептические свойства фенола и этанола объясняются их склонностью к образованию водородных связей. Данные соединения способны разрушать гидратную оболочку вокруг белков за счет разрыва существующих и образования новых водородных связей с протоно- и электродонорными группами белков, что и приводит к их денатурации. Однако, пары фенола ядовиты, а его раствор может вызвать ожоги тканей, поэтому карболовая кислота используется для дезинфекции помещений, мебели, посуды и т.д.
Двухатомные фенолы:
ОН
ОН — пирокатехин (ортодигидроксибензол) — структурный компонент катехоламинов (норадреналина и адреналина).
ОН
— резорцин (метадигидроксибензол) в составе примочек и мазей используется для лечения кожных заболеваний.
 ОН
ОН
ОН
—гидрохинон (парадигидроксибензол) — участник
дыхательной цепи переноса электронов:
ОН
ОН |
|
|
О |
|||
|
2е, 2Н |
|
|
|
|
|
|
|
|
|
|
||
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
2е, 2Н |
|
|
|
|
|
|
|
|
|
|
|
|
ОН |
|
|
О |
|||
Фенолы образуются в организме в результате метаболизма ароматических аминокислот. Присутствие ОН-группы в ароматическом ядре обуславливает антисептические свойства, поэтому многие фенолы оказывают бактерицидное действие; применяются как дезинфицирующие средства.
32

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
А Л Ь Д Е Г И Д Ы. К Е Т О Н Ы.
Оксосоединения — альдегиды и кетоны — это производные углеводородов, содержащие карбонильную группу  С=О, называемую также оксогруппой или карбонилом.
С=О, называемую также оксогруппой или карбонилом.
В альдегидах карбонильная группа находится на конце цепи; с ней связаны радикал и атом водорода R-C=О .
Н
Исключение — метаналь, у которого в качестве радикала выступает атом водорода Н-C=О .
Н
В кетонах карбонильная группа располагается в середине углеродной цепи; с ней связаны два радикала R1- C - R2.
||
O
Изомерия альдегидов и кетонов обусловлена строением углеводородных радикалов (насыщенные, ненасыщенные, ароматические, гетероциклические). Для кетонов еще характерна изомерия положения оксогруппы.
Электронное строение карбонильной группы.
В карбонильной группе sp2-гибридизованный атом углерода образует три -связи, лежащие с ним в одной
плоскости, и -связь с кислородом за счет негибридизованной С—О р-орбитали. -связь располагается над и под плоскостью С—О
-связи.
Она сильно поляризована и электронная пара смещена к более электроотрицательному атому кислорода. Вследствие этого на нем возникает частичный отрицательный заряд (- ), а на атоме углерода — частичный положительный (+ ):
+  -
-
 С = О
С = О
Таким образом, электронодефицитный атом углерода является электрофилом. Он склонен подвергаться атаке отрицательно заряженных нуклеофильных реагентов. А поскольку карбонильная группа содержит кратную связь, то для альдегидов и кетонов характерны реакции
нуклеофильного присоединения (АN).
В кетонах наличие двух объемных радикалов пространственно затрудняет атаку нуклеофила. Кроме того, из-за проявляемого ими +I–эффекта, уменьшается величина положительного заряда на атоме углерода карбонильной
33

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
группы, что тоже снижает активность нуклеофильной атаки. Поэтому реакционная способность альдегидов выше, чем кетонов.
Многие реакции нуклеофильного присоединения к карбонильным соединениям являются окислительно-восстановительными, т.к. сопровождаются изменением степени окисления углеродных атомов.
Механизм реакций нуклеофильного присоединения (АN) включает:
атаку атома углерода карбонильной группы нуклеофилом и присоединение электрофила к атому кислорода:
R1 |
|
|
|
R1 |
R1 |
+ | |
- |
+ |
- |
| |
| |
C = О + Е—У У—С—О- |
+ E+ Y — C — OE |
||||
| |
|
|
|
| |
| |
R2 |
|
|
|
R2 |
R2 |
По этому механизму осуществляется ряд реакций:
1.Гидратация (присоединение воды) с образованием гидратов:
|
R1 |
|
|
|
R1 |
|
|
|
R1 |
|
+ | |
- |
+ |
- |
| |
|
|
|
| |
|
C = О + Н—ОН НО—С—О- |
+ Н+ НО — C — OН |
|||||||
|
| |
|
|
|
| |
|
|
|
| |
|
R2 |
|
|
|
R2 |
|
|
|
R2 |
2. Присоединение цианводородной кислоты (НСN) с образованием |
|||||||||
циангидринов: |
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
R1 |
|
|
|
R1 |
+ | |
- |
+ |
- |
|
| |
- |
|
+ |
| |
C = О + Н—СN |
NaOH |
NC—С—О |
+ Н |
NС — C —ОН |
|||||
|
|
|
|||||||
| |
|
|
|
|
| |
|
|
|
| |
R2 |
|
|
|
|
R2 |
|
|
|
R2 |
|
|
|
|
|
|
|
|
|
циангидрин |
Реакция лежит в основе получения α-гидроксикислот и α-аминокислот.
3. Присоединение одноатомных спиртов с образованием полуацеталей:
34

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
|
|
|
|
O- |
OH |
+ |
- |
+ |
- |
| |
| |
R — C = O + H—OC2H5 |
R—C— H + H+ |
R—C—H |
|||
|
\ |
|
|
| |
| |
|
H |
|
|
O—C2H5 |
O—C2H5 |
полуацеталь
Если альдегидная и спиртовая группы находятся в одной молекуле, то образуется циклический полуацеталь (циклические формы углеводов).
При обработке полуацеталя избытком спирта в кислой среде его гидроксильная группа замещается с отщеплением воды и образуется ацеталь:
OH |
|
H+ |
O — C2H5 |
| |
+ - |
| |
|
R — C—H + H—OC2H5 |
|
R—C— H + H2O |
|
| |
|
|
| |
O— C2H5 |
|
|
O — C2H5 |
ацеталь Кетоны по сравнению с альдегидами взаимодействуют со спиртами
значительно труднее, образуя полукетали и кетали:
|
|
|
|
|
H+ |
|
O — C2H5 |
|
|
|
|
|
|
||
+ |
+ |
- |
|
|
| |
||
СH3—C— СH3 + Н — OC |
2H5 |
H3С — С — С H3 |
|||||
- || |
|
|
|
|
|
|
| |
O |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
полукеталь |
|
|
O — C2H5 |
|
|
H+ |
OC2H5 |
||
|
| |
|
|
|
|
| |
|
H3С — С— СH3 |
|
+ H—O C2H5 |
|
H3С—C— CH3 + H2O |
|||
|
| |
|
|
|
|
|
| |
|
OH |
|
|
|
|
OC2H5 |
|
кеталь
4. Взаимодействие альдегидов и кетонов с первичными аминами осуществляется по механизму присоединения-отщепления. Сначала происходит нуклеофильное присоединение по карбонильной группе, затем - отщепление воды с образованием иминов:
35

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
R1 |
|
H |
R1 |
R1 |
|
+ | |
- |
|- |
| |
| |
|
C = О + Н—N— C2H5 |
H |
R2 — C = N- C2H5 + |
|||
R2— С—ОH |
|||||
|
|
|
|
| |
имин |
|
|
|
|||
R2 |
|
этиламин |
N—H |
+ H2O |
|
|
|
|
|
| |
|
|
|
|
|
C2H5 |
|
Образование |
иминов, т.е. формирование связи |
=С=N-, — необходимая стадия |
|||
в процессе транс-аминирования при биохимическом превращении одних аминокислот в другие.
Окислительно-восстановительные свойства альдегидов и кетонов
1.При окислении альдегидов образуются карбоновые кислоты. Если окисление вести оксидом серебра (1), то выделяется металлическое серебро (реакция “серебряного зеркала”):
R — C = O + Ag2O |
R— C=O + 2Ag |
\ |
| |
H |
OH |
Окисление кетонов происходит сложнее, с разрывом углеродной цепи и образованием либо двух кислот, либо кислоты и кетона с более короткими цепями.
2.При восстановлении альдегидов образуются первичные спирты, кетонов — вторичные спирты:
|
|
H |
R — C = O |
|
| |
[H ] |
R—C—OH |
|
|
||
\ |
|
| |
H |
|
H |
|
|
H |
R1- C - R2 |
|
| |
[ H ] |
R1 - C - R2 |
|
|
||
|| |
|
| |
O |
|
OH |
Альдегиды, занимая по степени окисления промежуточное положение между спиртами и кислотами, связаны с этими соединениями окислительновосстановительными переходами, которые играют важную роль в метаболизме органических веществ.
36

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Специфические реакции альдегидов и кетонов.
Карбонильная группа в альдегидах и кетонах является электроноакцепторной и смещает электронную плотность в молекуле на себя:
+ |
++ |
O-δ |
|
R1→CH2→CH→C |
|
||
β |
|
α |
R2 |
|
H |
|
|
Врезультате на атомах углерода образуется частичный положительный заряд, наибольший на α-углеродном атоме. При этом α-водородный атом приобретает подвижность, что обуславливает следующие свойства карбонильных соединений:
1.Таутомерия – это равновесная динамическая изомерия. Она заключается во взаимном превращении изомеров вследствие переноса какойлибо подвижной группы и соответствующего перераспределения электронной плотности. Такие изомеры называются таутомерами.
Вкарбонильных соединениях кето-енольная таутомерия проявляется в том, что из-за переноса протона карбонильное соединение (кетонная форма) существует в равновесии с его енольным изомером (енольная форма):
H |
|
|
|
O-δ |
|
|
OH |
R1−CH− C+δ |
↔R1−CH |
|
C |
|
|||
|
|||
R2 |
|
|
R2 |
кетонная форма |
енольная форма |
||
2. Реакции конденсации – |
это реакции, приводящие к усложнению |
||
углеродного скелета и возникновению новой углеродной связи в результате взаимодействия двух или более простых молекул.
При взаимодействии двух альдегидов в присутствии кислот или щелочей образуется альдоль (альдольная конденсация), который затем, отщепляя молекулу воды, превращается в ненасыщенный альдегид (кротоновая конденсация):
|
|
|
OH H |
|
||
R1−C+δ |
О-δ |
О OH- |
|
|
O H+ |
|
+ Н− |
СН− С |
→ R1− C − C − C |
→ |
|||
|
||||||
|
Н |
|
Н |
|
|
H |
|
|
|||||
|
R2 |
|
H |
R2 |
|
|
|
O |
|
|
|
|
|
→R1−CH  C−C +H2O H
C−C +H2O H
R2
Реакции конденсации такого типа характерны и для кетонов.
3. Галоформные реакции осуществляются при взаимодействии альдегидов или кетонов с галогенами. Галогены замещают один или несколько
37

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
α-водородных атомов в углеводородных радикалах. При этом образуются
галогенкарбонильные соединения, которые расщепляются щелочью с образованием галоформа (иодоформа, бромоформа):
O |
I |
|
O-δ |
|
|
|
O |
H3C−C |
+I2 → I |
−C − C+δ |
+ NaO−H → CHI3 + H−C |
|
|||
H |
I |
|
H |
|
|
иодоформ |
ONa |
|
|||||||
|
|
|
|
|
|
|
|
Эти реакции используются в аналитических целях.
Отдельные представители:
Альдегидная группа обуславливает наркотические и дезинфицирующие свойства соединений.
О
Н−С
Н
- муравьиный альдегид или формальдегид свертывает белки.
Используется в виде формалина для дезинфекции и консервирования анатомических препаратов. Производные формальдегида, например, уротропин, также обладают дезинфицирующими свойствами.
О
СН3−С
Н
- уксусный альдегид – естественный метаболит в организме человека.
Cl |
OH |
Cl− C − C − OH |
|
Cl |
H |
- хлоральгидрат – успокаивающее и снотворное средство. Наличие галогена усиливает специфическое действие альдегидной группы на организм, а гидратация карбонильной группы снижает токсичность вещества в целом.
СН3−С − СН3
O - ацетон – недоокисленный продукт обмена. Образуется в организме при некоторых заболеваниях, например, диабете. Используется в синтезах различных лекарственных препаратов.
α-галогензамещенные альдегиды и кетоны сильно раздражают слизистые оболочки носа и глаз. Они являются лакриматорами, входят в состав слезоточивых газов.
38

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
Тема 5 Карбоновые кислоты и их функциональные производные
Ключевые понятия и слова: хиральность, энантиомер, диастереомер, абсолютная конфигурация.
Карбоновые кислоты- это производные углеводородов, в которых один или более атомов замещены карбоксильной группой:
О
−С |
|
ОН |
|
Общая формула карбоновых кислот: |
O |
R – C
OH.
По характеру углеводородного радикала кислоты делят на насыщенные, ненасыщенные, алифатические, ароматические, гетероциклические, а также высшие или жирные кислоты с числом углеродных атомов от 4 до 22.
В зависимости от числа карбоксильных групп различают: одноосновные /монокарбоновые/ и многоосновные – двуосновные /дикарбоновые/, трёхосновные /трикарбоновые/ и т.д. кислоты.
Электронное строение карбоксильной группы:
Карбоксильная группа является сопряжённой системой, в которой неподелённая пара электронов атома кислорода ОН – группы вступает в сопряжение с π-связью /р, π-сопряжение/. Это обуславливает следующее
распределение электронной плотности в молекулах кислот:
 О-δ
О-δ
R→С+δ
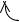
 О←Н
О←Н
В результате атом углерода в карбоксильной группе, приобретая частичный положительный заряд +σ, становится электрофильным центром. Он склонен к атаке нуклеофильных реагентов. Однако, проявление у ОН-группы электроноднородных свойств /+М-эффект/ и наличие сопряжения вызывает смещение электронной плотности от гидроксильной группы в сторону молекулы. Вследствие этого:
1. величина частичного положительного заряда на атоме углерода в карбоксильной группе меньше, чем на атоме углерода в карбонильной группе >С=О. Потому кислоты менее активны к восприятию атаки нуклеофильного реагента, чем альдегиды или кетоны. Для кислот более характерны реакции нуклеофильного замещения, а не присоединения; 2. полярная σ-связь в гидроксильной группе ещё более поляризуется и
электронная плотность сдвигается от атома водорода. В результате он
39

Generated by Foxit PDF Creator © Foxit Software
http://www.foxitsoftware.com For evaluation only.
приобретает большую активность. Это обуславливает повышенную кислотность карбоновых кислот по сравнению со спиртами.
Исходя из этого, для карбоновых кислот характерны реакции двух типов: 1. с разрывом О-Н связи:
1.диссоциация карбоновых кислот в водном растворе с образованием карбоксилат /ацилат/- иона и гидратированного протона:
|
|
О-δ |
|
О |
R→С+δ |
|
+Н2О ↔ R−С |
+ Н3О+ |
|
|
|
|
||
|
|
О←Н |
|
О- |
|
|
|
||
ацилат-ион
2.взаимодействие со щелочными металлами и щелочами с образованием солей:
О |
|
O |
R−С |
+ NaOH ↔ R−С |
+ H2O |
ОН |
|
ОNa |
Поскольку карбоновые кислоты слабее минеральных , их соли в водном растворе гидролизованы и дают щелочную реакцию.
2.реакция с разрывом С-ОН связи, протекающие по механизму нуклеофильного замещения /SN/:
В этих реакциях атом углерода карбоксильной группы является электрофильным центром. Он атакуется нуклеофильным реагентом с образованием промежуточного нестабильного продукта /аниона/, который далее стабилизируется путём отщепления уходящей группы –ОН. Реакция осуществляется либо при наличии сильного нуклеофила, либо в условиях кислотного катализа:
|
О-δ |
|
|
О- |
O |
R→С+δ |
+ :Y- → |
R− С |
→ R−С |
+ :OH- |
|
|
О←Н |
|
|
OH |
Y |
|
|
Y |
|
|
|
субстрат |
нуклеофил |
промежуточный |
уходящая |
||
|
|
|
|
продукт |
группа |
Остаток карбоновой кислоты после отщепления гидроксильной группы
называется ацил: |
|
|
|
О |
O |
О |
O |
R−С |
R−С |
H3C−С |
H3C −С |
ОН, |
, |
OH, |
|
кислота |
ацил |
уксусная кислота |
ацетил |
Реакция, протекающая с участием ацила, являются реакциями ацилирования:
40
