
- •Вопрос 2 амины-производные аммиака .В которых один атом водорода замещен на радикал.На основность аминов влияют природа радикалов и их количество.
- •Вопрос 4 Сахарид галактоза.
- •Вопрос 2. Одноосновные непредельные кислоты - производные ненасыщенных углеводородов, у которых один атом водорода замещен карбоксильной группой.
- •Вопрос 4.Аспаргиновая кислота соон-сн-nh2 этиламин сн3-сн2-nh2
- •Вопрос 2.
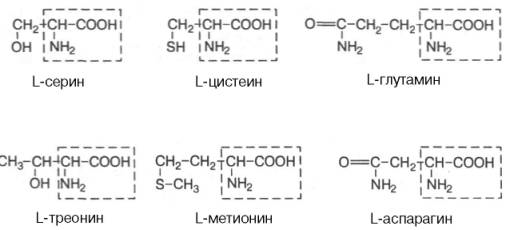
- •Вопрос 4.Аланин.(сн3-сн(nh2)cooh)серин (он-сн2-сн(nh2)cooh)пролин связи через азот !!!
- •Вопрос 1. Правила замещения в бензольном кольце: Первый заместитель встает в любое положение и влияет на распределение электронной плотности в кольце.
- •Вопрос 3.
Вопрос 4.Аспаргиновая кислота соон-сн-nh2 этиламин сн3-сн2-nh2
|
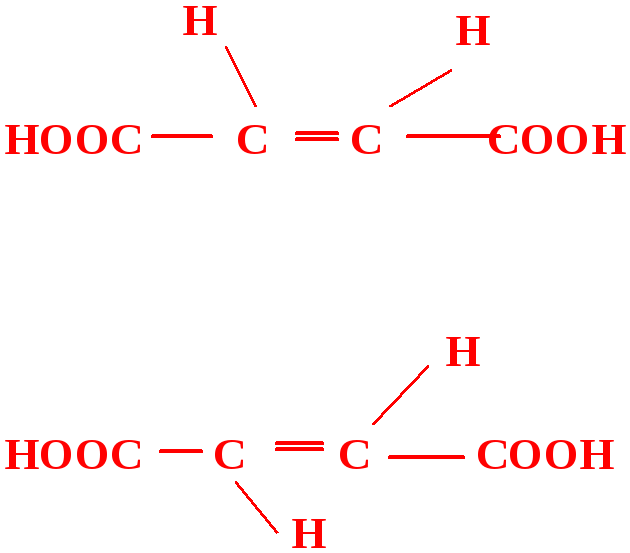 СН2-СООН
СН2-СООН
Билет 26
Вопрос 1. Возникновение водородной связи можно в первом приближении объяснить действием электростатических сил. Атом с большой электроотрицательностью, например, фтор в молекуле HF смещает на себя электронное облако, приобретая значительный эффективный отрицательный заряд, а ядро атома водорода (протон) почти лишается электронного облака и приобретает эффективный положительный заряд. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Атом водорода, соединенный с атомом сильно электроотрицательного элемента, способен к образованию еще одной химической связи с другим сильно электроотрицательным атомом. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. Вторичная структура - укладка первичной структуры белка, возможны два вида конформации: Вторая структура – складчатый слой (b-структура): полипептидные цепи лежат антипараллельно или параллельно друг другу (водородные связи соединяют 2 различные цепи). Вторичная структура фиксируется водородными связями между пептидными группами. . Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -CONH2, SH-группы) и любыми другими гидрофильными группами. Белки, функционирующие в неполярном (ли-пидном) окружении, например белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение
В соответствии с моделью Дж. Уотсона и Ф. Крика, предложенной в 1953 г. на основании ряда аналитических данных, а также рентгеноструктурного анализа молекула ДНК состоит из двух цепей, образуя правовращающую спираль, в которую обе полинуклеотидные цепи закручены вокруг одной и той же оси. Удерживаются цепи благодаря водородным связям, образующимся между их азотистыми основаниями (рис. 3.1). Обе цепи поли-нуклеотидов в биспиральной молекуле ДНК имеют строго определенное пространственное расположение, при котором азотистые основания находятся внутри, а фосфорильные и углеводные компоненты – снаружи.
Вопрос 2.
L-яблочная кислота D-яблочная кислота Яблочная кислота (оксиянтарная кислота, гидроксибутандиовая кислота) НООС-СН(ОН)-СН2-СООН — двухосновная оксикарбоновая кислота. Бесцветные гигроскопичные кристаллы, хорошо растворимые в воде и этиловом спирте. Температура плавления 100 °C. Впервые выделена шведским химиком Карлом Вильгельмом Шееле (Carl Wilhelm Scheele) в 1785 году из незрелых яблок. Соли и анионы яблочной кислоты — малаты.
![]()
Ви́нная кислота́ (диоксиянтарная кислота, 2,3-дигидроксибутандиовая кислота) НООС-СН(ОН)-СН(ОН)-СООН — двухосновная оксикислота. Известны три стереоизомерные формы. Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, в аналитической химии для обнаружения альдегидов, сахаров и др. Соли винной кислоты (тартраты) используются в медицине, при крашении тканей и др.
![]()
Лимо́нная
кислота́
(2-гидрокси-1,2,3-пропантрикарбоновая
кислота,
3-гидрокси-3-карбоксипентандиовая)
(C6H8O7) —
кристаллическое вещество белого цвета,
температура плавления 153 °C,
хорошо растворима в воде,
растворима в этиловом
спирте,
малорастворима в диэтиловом
эфире.
Слабая трёхосновная кислота. Соли и
эфиры лимонной кислоты называются
цитратами.
![]()
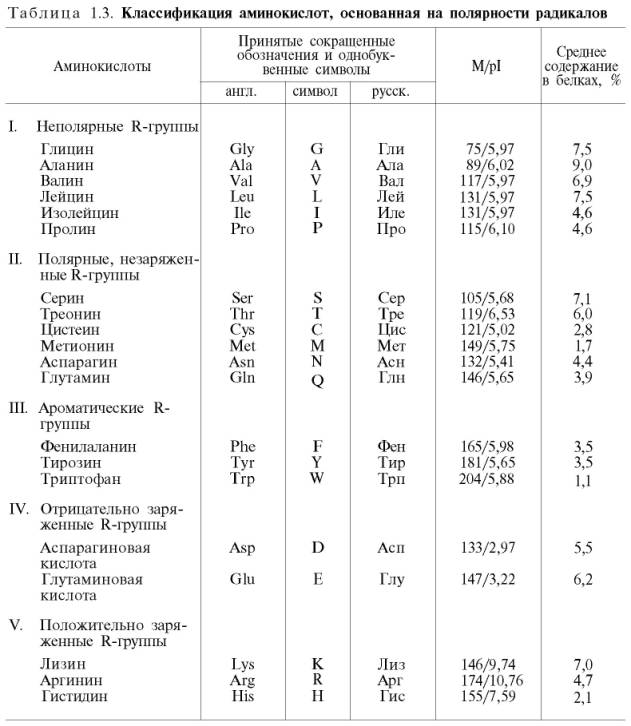

Полярные, незаряженные R-группы
Отрицательно заряженные R-группы

Положительно заряженные R-группы

Ароматические R-группы
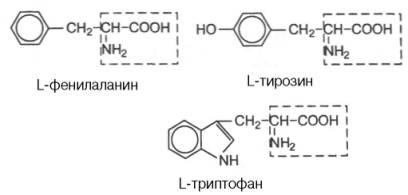
Аминокислоты - амфотерные вещества, которые могут существовать в виде катионов или анионов. Это свойство объясняется наличием как кислотной (-СООН), так и основной (-NH2) группы в одной и той же молекуле. В очень кислых растворах NH2-группа кислоты протонируется и кислота становится катионом. В сильнощелочных растворах карбоксильная группа аминокислоты депротонируется и кислота превращается в анион.
Свойства СООН группы
1 – декарбоксилирование
2 – образование хлорангидридов, амидов, сложных эфиров
Смотри диск лекция аминокислоты
NH2 – реакция карбоксилирования приводит к получению аминокислот.
- формольное титрование
- образование N – ацильных производных
Билет 27
Вопрос1. Индуктивный эффект – перераспределение электронной плотности по системе σ–связей, вызванное разной электроотрицательностью (ЭО) атомов. +I эфф. имеют все R, причем для них I эфф. меняется в следующей последовательности: CH3 < C2H5 < (CH3)2 CH<(CH3)3C; также +I эфф. характерен для Мe и иона О2-. +I эфф
- I эффект Изображают I эфф. стрелкой вдоль сигма-связи.
I эфф. затухает через 3–4 атома углерода из-за малой поляризуемости сигма-связи С–С. –I эфф.: Hal, NH2, OH, OR, NO2, COOH
МЕЗОМЕРНЫЙ ЭФФЕКТ (ЭФФЕКТ СОПРЯЖЕНИЯ) Мезомерный эффект (М) – перераспределение электронной плотности по системе p–связей.
М эфф., в отличие от I эфф., возникает лишь там, где появляется сопряжение.
Сопряжение – это выравнивание связей и зарядов в реальной молекуле по сравнению с идеальной.Сопряжение возникает в результате образования единого p–делокализованного облака, принадлежащего более чем двум атомам.
Чтобы появлялся мезомерный эффект, молекула должна иметь p–связь, а заместитель вступал в сопряжение с ней.

н.п.е (р) образует единое π–делокализованное облако с π–связью, и на дальнем углероде возникает отрицательный заряд + М эфф.: NH2, OH, OR, Hal, SH, NR2 имеют гетероатом, участвующий в p-π сопряжении. Заместитель не имеет двойной связи.
Две p–связи С=С и С=О объединяются в единое p-делокализованное облако, которое смещается в сторону более ЭО кислорода, происходит уменьшение электронной плотности в p-связи С=С - М эфф. – заместитель с p–связью:
Суммарный эффект заместителей складывается из I и М эффектов.
В результате заместители делятся на:
1) электронодонорные (ЭД);
2) электроноакцепторные (ЭА). ЭД (+ М > - I) OH, OR, NH2, NHR, NR2, SH
(+ I ) R
ЭА (- I, - M) COOH, CHO, NO2, CN, SO3Н
(- I > + M) Hal (F, Cl, Br, I)
Заместители с – эффектом усиливают кислотность!!!!!!!!!!!!!!!!
С +эффектом –ослабевают!!!!!!!!!!!!!!!!
Факторы определяющие кислотность:
1)ЭО атома,связанного с Н(чем больше ЭО тем стабильней атом)
2)влияние радиуса (чем больше р.,тем больше кт=ислотность)
3)природа заместителей (электродонор. Заместитель снижает кис-ть,электроакцепторн. Увеличивает)

Вопрос 2. Салициловая кислота (2-гидроксибензойная кислота), С6Н4(ОН)СООН; бесцветные кристаллы, хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях, плохо растворима в воде (1.8 г/л при 20 °C).
Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
В природе встречается в растениях в виде производных — главным образом в виде гликозида метилового эфира (в частности, салициловая кислота была впервые выделена из коры ивы Salix L., откуда и происходит название), свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи. Реагирует с Na2CO3=салицилат натрия;с СН3ОН(в кислой ср.)=метилсалицилат;с С6Н5ОН(в кис.ср.)=фенилсалицилат:ВСЕ РЕАКЦИИ по группе СООН(замещается Н);реагирует с (СН3СО)2О=ацетилсалициловая кислота (РЕАКЦИЯ ПО гр ОН ,-О-С=ОСН3
 Реакционная
способность бензольного ядра салициловой
кислоты определяется наличием двух
заместителей с противоположными
мезомерным и индуктивным эффектами:
донорной гидроксильной и акцепторной
карбоксильной: в результате салициловая
кислота значительно легче бензойной,
но не так активно, как фенол,
вступает в реакции электрофильного
замещения вследствие стабилизации
промежуточного σ-комплекса гидроксильной
группой.
Реакционная
способность бензольного ядра салициловой
кислоты определяется наличием двух
заместителей с противоположными
мезомерным и индуктивным эффектами:
донорной гидроксильной и акцепторной
карбоксильной: в результате салициловая
кислота значительно легче бензойной,
но не так активно, как фенол,
вступает в реакции электрофильного
замещения вследствие стабилизации
промежуточного σ-комплекса гидроксильной
группой.
Нуклеофильное замещение направляется в орто- и пара-положения к гидроксилу и зачастую сопровождается декарбоксилированием: так, нитрование салициловой кислоты приводит к пикриновой кислоте (2,3,5-тринитрофенолу), а бромирование — к 2,3,5-трибромфенолу, хотя сульфирование олеумом идёт без декарбоксилирования и даёт сульфосалициловую (2-гидрокси-5-суль-фобензойную) кислоту Салициловая кислота и салицилаты, а также её сложные эфиры (метилсалицилат) и другие синтетические производные салициловой кислоты (например, ацетилсалициловая кислота — аспирин), обладают выраженым противовоспалительным действием.парааминосалициловая кислота (ПАСК)противотуберкулезный препарат
Парааминобензойная
кислота
 Парааминобензойная
кислота (ПАБК) -
витамин Bx, витамин В10, n-аминобенозойная
кислота. Витаминоподобное соединение,
участвующее в синтезе фолиевой кислоты
у микроорганизмов; является фактором
роста для многих бактерий; используется
в качестве лекарственного средства.
Парааминобензойная
кислота (ПАБК) -
витамин Bx, витамин В10, n-аминобенозойная
кислота. Витаминоподобное соединение,
участвующее в синтезе фолиевой кислоты
у микроорганизмов; является фактором
роста для многих бактерий; используется
в качестве лекарственного средства.
Вопрос 3. Крахмал (С6Н10О5)n состоит из моносахаридных звеньев a-Д- глюкопиранозы. Включает 2 фракции: амилоза (линейная 10 – 20 %) и разветвленная – амилопектин (80-90%). Образуется в результате фотосинтеза в растениях и накапливается в клубнях, семенах, корнях. В горячей воде набухает и подвергается гидролизу, в результате образуются более мелкие полисахариды, конечным продуктом является глюкоза. представляет собой смесь двух полисахаридов: линейного — амилозы и разветвленного — амило-пектина, общая формула которых: (C6H10O5)n,. Как правило, содержание амилозы в К. составляет 10—30%, а амилопектина 70—90% . Полисахариды К. построены из остатков глюкозы, соединённых в амилозе и в линейных цепях амилопектина -1,4-глюкозидными связями, а в точках ветвления — межцепочечными -1,6-глюкозидными связями (см. формулы).

амилоза
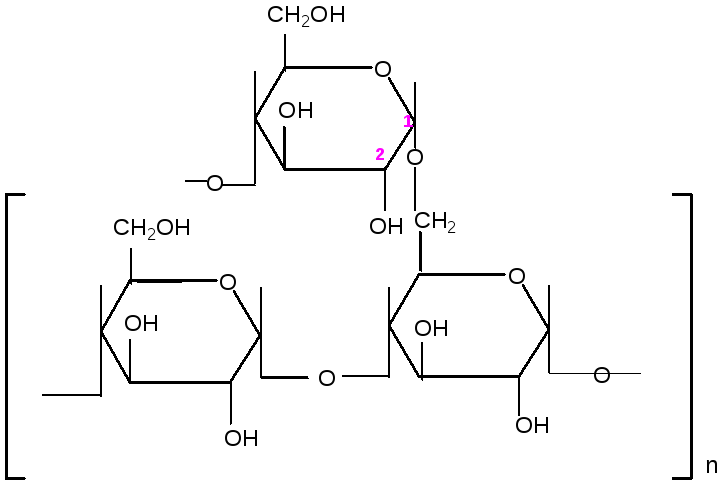
![]() амилопектин
амилопектин
Гликоген – полисахарид, структурной единицей которого является a-глюкоза. По своему строению он аналогичен амилопектиновой фракции крахмала, но имеет более разветвленное строение. Макромолекула гликогена более плотная и симметричная, чем амилопектин. При взаимодействии с реактивом Люголя амилопектин развивает красно-фиолетовую окраску.
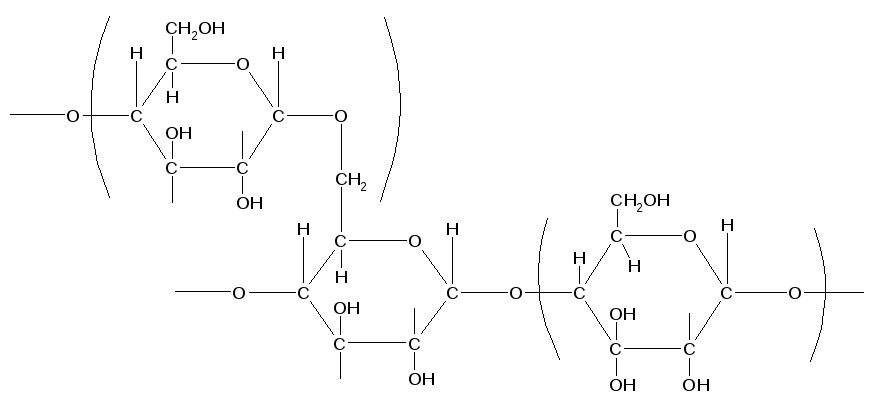
ГЛИКОГЕН, полисахарид, состоящий из остатков глюкозы; основной запасной углевод человека и животных. Откладывается в виде гранул в цитоплазме клеток (главным образом печени и мышц). Потребность организма в глюкозе удовлетворяется путем ферментативного расщепления гликогена.
