
- •Волновая и квантовая оптика
- •Интерференция.
- •Дифракция.
- •Поляризация.
- •Тепловое излучение.
- •Квантовая природа света.
- •Релятивистская механика.
- •Примеры решения задач.
- •Элементы атомной физики и квантовой механики.
- •Боровская теория атома водорода.
- •Волновые свойства частиц.
- •Квантовые числа. Заполнение электронных оболочек атомов.
- •Ядерные реакции .
- •Радиоактивность.
- •Примеры решения задач.
-
Ядерные реакции .
20. Массовое число ядра (число нуклонов в ядре):
 A = Z + N,
A = Z + N,
где Z – число протонов, N – число нейтронов.
21. Дефект массы ядра:
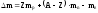 ,
,
где Z – число протонов в ядре, A – Z = N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона, mz – масса ядра.
22. Энергия связи ядра
Есв = mc2,
где с – скорость света в вакууме.
Во внесистемных единицах МэВ энергия связи ядра:
Eсв = 931m,
где m – дефект массы в а.е.м. (1 а.е.м. ~ 931МэВ).
23. Энергетический эффект ядерной реакции
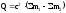 или
или
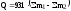 МэВ,
МэВ,
где m1 – сумма масс частиц до реакции, m2 – сумма масс частиц после реакции. В эту формулу можно подставлять массы изотопов, а не ядер, так как поправки на массу электронной оболочки входят с разными знаками и поэтому взаимно исключаются.
-
Радиоактивность.
24. Закон радиоактивного распада:
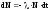 ,
или
,
или
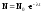 ,
,
где dN – число ядер, распадающихся за интервал времени dt, N – число ядер, не распавшихся к моменту времени t, N0 – число ядер в начальный момент (t=0), – постоянная радиоактивного распада.
25. Число ядер, распавшихся за время t:
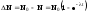 .
.
В случае, если интервал времени t, за который определяется число распавшихся ядер, много меньше периода полураспада Т1/2, то число распавшихся ядер можно определить по формуле:
 .
.
26. Зависимость периода полураспада от постоянной радиоактивного распада:
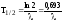 .
.
27. Среднее время жизни радиоактивного ядра, т.е. интервал времени, за который число нераспавшихся ядер уменьшается в е раз:
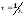 .
.
28. Число атомов, содержащихся в радиоактивном изотопе:
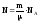 ,
,
где m – масса изотопа, – молярная масса, NА – число Авогадро.
29. Активность радиоактивного изотопа:
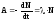 ,
или
,
или
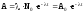 ,
,
где dN – число ядер, распадающихся за интервал времени dt, А0 – активность изотопа в начальный момент времени. Измеряется в беккерелях (Бк).
30. Удельная активность изотопа
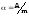 .
.
Примеры решения задач.
Пример 1. Определить для атома водорода радиус третьей боровской орбиты, скорость электрона на ней и период обращения.
Решение: На основании второго постулата Бора (закон квантования орбит):
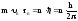 ,
(1)
,
(1)
где m – масса электрона, n – скорость электрона на n-ой орбите, rn – радиус n-ой орбиты, n – главное квантовое число (номер орбиты), h – постоянная Планка.
Запишем далее второй закон Ньютона для электрона, движущегося вокруг ядра под действием кулоновской силы притяжения ядра (ядром атома водорода является протон):
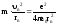 ,
(2)
,
(2)
где
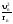 – центростремительное ускорение. Решая
совместно уравнения (1) и (2) относительно
rn и n,
получим:
– центростремительное ускорение. Решая
совместно уравнения (1) и (2) относительно
rn и n,
получим:
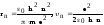 .
(3)
.
(3)
Период обращения электрона :
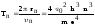 .
(4)
.
(4)
Подставим числовые значения в формулы (3) и (4):
n = 3, 0 = 8.8510-12 Ф/м, m = 9.110-31 кг, е = 1.610-12 Кл, h = 6.6210‑34Дж с.
Получим: r3 = 4.710-10 м, 3 = 7.2105 м/с, Т3 = 0.4110-14 с.
Пример 2. Электрон в атоме водорода перешел с третьего энергетического уровня на второй. Определить энергию испущенного при этом фотона.
Решение: Для определения энергии фотона воспользуемся сериальной формулой для водородоподобных ионов:
 ,
(1)
,
(1)
где – длина волны излученного фотона, R – постоянная Ридберга, Z – порядковый номер элемента в таблице Менделеева (для атома водорода Z=1), n1 – номер орбиты, на которую перешел электрон, n2 – номер орбиты, с которой перешел электрон.
Энергия фотона выражается формулой:
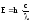 .
.
Умножив обе части формулы (1) на hc, получим выражение для энергии фотона:
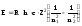 .
.
Так как величина Rhc есть энергия ионизации Еi атома водорода, то формула (2) примет вид :
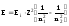 ,
(2)
,
(2)
Подставим числовые данные: Ei = 13.6 эВ (см. табл. 1), Z = 1, n1 = 2, n2 = 3.
Получим
Е =13.6(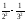 )=1.9
эВ.
)=1.9
эВ.
Пример 3. Найти длину волны де Бройля для электрона, обладающего кинетической энергией Т = 5 МэВ.
Решение: В данной задаче кинетическая энергия электрона больше, чем его энергия покоя Е0 = m0c2 = 0.51 МэВ. Следовательно, электрон – релятивистская частица и поэтому его импульс выражается формулой:
 .
(1)
.
(1)
Длина волны де Бройля:
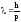 ,
,
где h – постоянная Планка, p – импульс частицы.
С учетом (1):
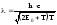 .
.
Подставляем числовые значения:
h = 6.6210-34 Джс, с = 3108 м/с, Т = 51061.610-19 = 8.010-13 Дж.
В результате расчетов получаем: = 2.2510-12 м.
Пример 4. Используя соотношения неопределенностей, определить наименьшую неточность, с которой можно вычислить координату электрона в атоме. Средняя кинетическая энергия электрона в невозбужденном атоме водорода равна 13.6 эВ.
Решение: Соотношение неопределенностей для координаты и импульса имеет вид:
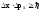 ,
,
отсюда неточность координаты частицы
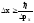 .
(1)
.
(1)
Электрон по условиям данной задачи является нерелятивистской частицей (Т<<Е0). Запишем связь импульса с кинетической энергией:
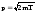 .
(2)
.
(2)
Данная формула позволяет определить модуль вектора импульса. Проекция px импульса на ось x оказывается неопределенной, так как ее величина изменяется в интервале (‑p, p). Поэтому за неопределенность импульса px можно взять величину, не превышающую значение самого импульса
рх р.
Отсюда с учетом (1) и (2):
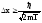 .
.
Подставляем числовые значения:
 = 1.0510-34 Джс,
m = 9.110-31 кг, Т
= 13.61.610-19
Дж.
= 1.0510-34 Джс,
m = 9.110-31 кг, Т
= 13.61.610-19
Дж.
Получаем результат: х 0.510-10 м.
Из решения видно, что наименьшая неточность в определении координаты электрона в атоме примерно равна (по величине) радиусу первой боровской орбиты.
Пример 5. Частица находится в возбужденном состоянии (n=3) в одномерном потенциальном ящике шириной l с абсолютно непроницаемыми стенками (0 < х < l). Определить вероятность обнаружения частицы в средней трети ящика.
Решение: В одномерном случае вероятность dw обнаружения частицы в интервале dx можно определить по формуле:
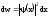 ,
,
где
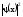 –
плотность вероятности.
–
плотность вероятности.
Вероятность обнаружения частицы в средней трети ящика (l/3 < x < 2l/3) выразится через интеграл:
w =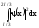 .
.
Собственная волновая функция, описывающая возбужденное состояние частицы (n = 3) в потенциальном ящике имеет вид:
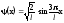 .
(1)
.
(1)
С учетом (1) искомая вероятность:
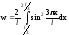 .
.
Используя соотношение
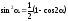 ,
вычислим интеграл :
,
вычислим интеграл :
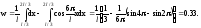
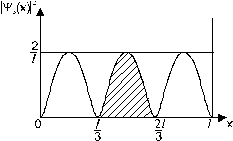
Рис. 37
Заштрихованная площадь кривой (рис. 37) численно равна вероятности обнаружения частицы в интервале l/3 < x < 2l/3.
Пример 6. Указать (с учетом принципа Паули), какое максимальное количество электронов в атоме может иметь следующие одинаковые квантовые числа:
1) n, l, ml;
2) ml, ms, если n = 2.
Решение: По принципу запрета Паули в атоме не может быть двух и более электронов с одинаковыми квантовыми числами. Если три квантовых числа одинаковы, то электроны должны отличаться хотя бы спином (собственным механическим моментом импульса), который может принимать для электронов только два значения:
Ls = msћ, где ms = 1/2.
Следовательно, в первом случае электронов с тремя одинаковыми квантовыми числами n, l, ml может быть не более двух. Во втором случае квантовому числу n = 2 соответствуют два значения азимутального квантового числа l (0,1) (Савельев И.В. Курс общей физики, т.3. М. 1987 г., стр. 129, табл. 36.1). В свою очередь каждому l соответствует набор значений магнитного квантового числа ml (ml = 0, 1, 2... l). Следовательно, и для l = 0 и для l = 1 значение ml = 0 является одинаковым. С учетом того, что спин электронов с таким набором квантовых чисел должен быть одинаков, получаем, что число таких электронов может быть также не более двух. Набор квантовых чисел для этих электронов:
для 1-ого: 2, 0, 0, +1/2;
для 2-ого: 2, 1, 0, + 1/2.
Пример
7. При соударении -частицы
с ядром атома бора
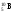 произошла ядерная реакция, в результате
которой образовались два новых ядра:
ядро атома водорода
произошла ядерная реакция, в результате
которой образовались два новых ядра:
ядро атома водорода
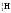 и ядро изотопа углерода
и ядро изотопа углерода
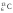 .
Определить энергетический эффект этой
реакции.
.
Определить энергетический эффект этой
реакции.
Решение. Краткая запись ядерной реакции имеет вид:

(-частица представляет собой ядро атома гелия).
Энергетический эффект Q ядерной реакции определяется по формуле :
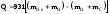 .
.
При числовых подсчетах по этой формуле массы ядер заменяют массами нейтральных атомов, так как электронные оболочки ядер гелия и бора вместе содержат столько же электронов, сколько и электронные оболочки ядер углерода и водорода.
Подставив массы атомов (из табл. 14) в расчетную формулу, получим:
Q = 931((4.00260+10.01294) – (1.00783+13.00335)) МэВ = 4.06 МэВ.
Энергия в результате реакции выделяется, т.к. Q > 0.
Пример 8. Определить начальную активность А0 радиоактивного препарата магния 27Mg массой m = 0.2 мкг, а также его активность А через 6 часов. Период полураспада магния считать известным.
Решение. Активность А изотопа характеризует скорость радиоактивного распада и определяется отношением числа dN ядер, распавшихся за интервал времени dt к этому интервалу:
A = – dN/dt. (1)
Знак “–” показывает, что число N радиоактивных ядер с течением времени убывает.
Для нахождения dN/dt воспользуемся законом радиоактивного распада:
N = N0e-t, (2)
где N – число радиоактивных ядер, содержащихся в изотопе в момент времени t, N0 – число ядер в момент времени, принятый за начальный (t = 0), – постоянная радиоактивного распада.
Продифференцируем выражение (2) по времени:
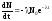 .
(3)
.
(3)
Исключая
из формул (1) и (3)
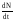 ,
находим активность препарата в момент
времени t:
,
находим активность препарата в момент
времени t:
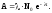 (4)
(4)
Начальную активность А0 получаем при t = 0:
A0 = N0. (5)
Постоянная связана с периодом полураспада Т1/2 соотношением:
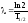 . (6)
. (6)
Число N0 радиоактивных ядер, содержащихся в изотопе, можно определить по формуле:
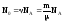 ,
(7)
,
(7)
где – количество вещества, m – масса изотопа, – молярная масса, NA – постоянная Авогадро.
С учетом выражений (6) и (7) формулы (5) и (4) принимает вид:
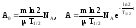 .
.
Произведем вычисления, учитывая, что Т1/2 = 10 мин = 600 с (см.табл. 15), ln2 = 0.693, t = 6 ч = 2.16104 с, = 2710-3 кг/моль:
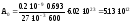 Бк
,
Бк
,
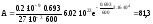 Бк .
Бк .
№ 634
-частица находится в одномерном потенциальном ящике1. Используя соотношение неопределенностей, оценить ширину l одномерного ящика, если известно, что минимальная энергия -частицы Emin = 8 эВ.
№ 655
Указать (с учетом принципа Паули), какое максимальное число электронов в атоме может иметь следующие одинаковые квантовые числа: 1) n, 2) n, l, ml.
1 Имеется в виду бесконечно глубокий, одномерный, прямоугольный потенциальный ящик
