
3. Самонагрівання, самозаймання і температура самонагрівання
Температурою самонагрівання називається найнижча температура речовини (матеріалу, суміші), при якій виникає її самонагрівання.
Тобто та температура, вище якої речовина в контакті з повітрям починає підвищувати свою температуру самостійно.
Температура самонагрівання залежить від природи речовини і від поверхні її контакту з киснем. Час, який потрібен речовині для того, щоб при цій початковій температурі вона дійшла до займання (самозаймання), залежить теж від природи речовини; а ще від початкової температури.
Речовини, що мають температуру самонагрівання, нижчу за 500С , умовно виділені в окрему групу - групу пірофорних речовин.
Самозайманням називається займання в результаті самоініційованих екзотермічних процесів.
Тепловим називається самозаймання, що викликане самонагріванням, спричиненим зовнішнім нагрівом речовини (матеріалу, суміші) вище температури самонагрівання.
Мікробіологічним називається самозаймання в результаті самонагрівання, яке спричинене життєдіяльністю мікроорганізмів в масі речовини (матеріалу, суміші).
Хімічним називається самозаймання в результаті самонагрівання, що виникло під дією хімічної взаємодії речовин.
Наприклад:
2Na + 2H2O = 2NaOH + H2
Висновок з питання 3.
Коли в якомусь процесі тепловиділення перевищує теплозйом, в системі починається самонагрівання. Та найнижча температура, при якій виникає самонагрівання, називається температурою самонагрівання. За механізмом процесу, який ініціює виділення тепла, розрізняють теплове, мікробіологічне та хімічне самонагрівання.
4. Примусове спалахування і примусовий вибух. Джерела запалювання
Високоенергетичне джерело нагріває холодну горючу суміш на невеликій дільниці горючої суміші. Основна частина об’єму при цьому лишається холодною.
При самоспалахуванні уся суміш розігрівається рівномірно. До температури самоспалахування суміш доводиться поступово. Процес горіння може виникнути з однаковою вірогідністю у будь-якій точці об’єму, або навіть по всьому об’єму одночасно.
У випадку запалювання до температури спалахування швидко нагрівається тільки незначна частина суміші. Уся ж маса цієї суміші в момент запалювання може лишатися відносно холодною.
При самоспалахуванні процес самоприскорення розвивається відносно повільно, період індукції має значну величину.
При запалюванні процес займання і спалахування іде значно скоріше. Розігрів суміші від зовнішнього джерела відбувається локально, але значно енергійніше і до більш високої температури. Індукційний період майже відсутній.
При примусовому запалюванні питома поверхня тепловідведення значно вища, ніж при самоспалахуванні. Тому прискорення реакції починається при температурі, вищій, ніж при самоспалахуванні. Отже, температура джерела запалювання повинна бути вищою ніж температура самоспалахування суміші.
Примусовим спалахуванням, або просто спалахуванням, називається початок горіння під впливом джерела запалювання.
Запалюванням називається процес ініціювання початку горіння.
Теорія
Я. Б. Зельдовича розглядає не усю
суміш, а вузьку смугу біля стінки
товщиною .
Ця смуга вважається значно меншою, ніж
відстань до будь-якої реальної точки
суміші, наприклад точки yi.
Тобто
yi
. Згідно
теплової теорії Я.Б.Зельдовича, критичною
умовою спалахування є умова
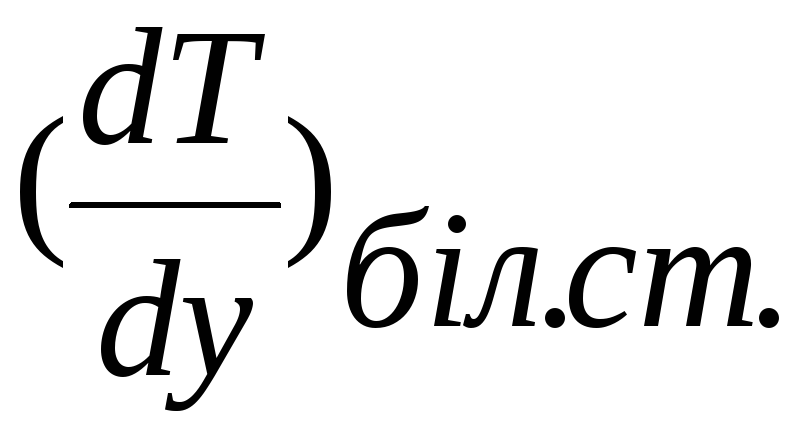 = 0.
= 0.
Д. А. Франк-Каменецький вивів вираз зв’язку геометричних розмірів системи з температурою нагрітої поверхні і фізико-хімічними параметрами горючої суміші:
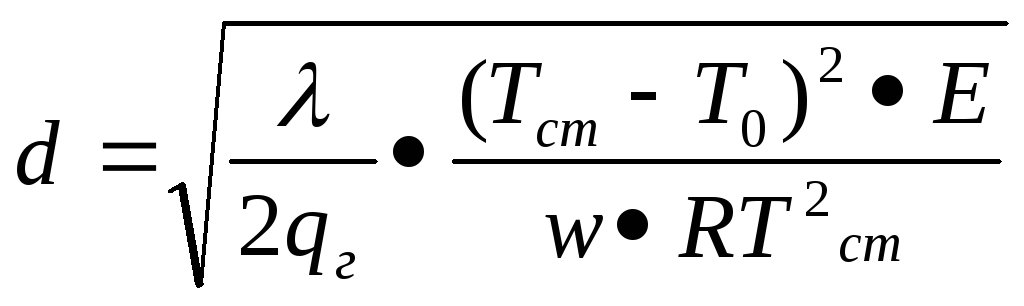 ,
у виразі
,
у виразі
d – діаметр кульки, що підпалює систему;
λ – теплопровідність суміші;
qг – теплота згоряння;
w – швидкість реакції горіння;
R – газова стала;
Е – енергія активації;
Тст і То –температура стінки і температура суміші.
Найменше значення потужності електричної іскри, необхідне для запалювання суміші називається критичною енергією запалювання даної суміші.
Порівняльна
методика
розрахунку
базується на порівнянні нормальних
швидкостей горіння: 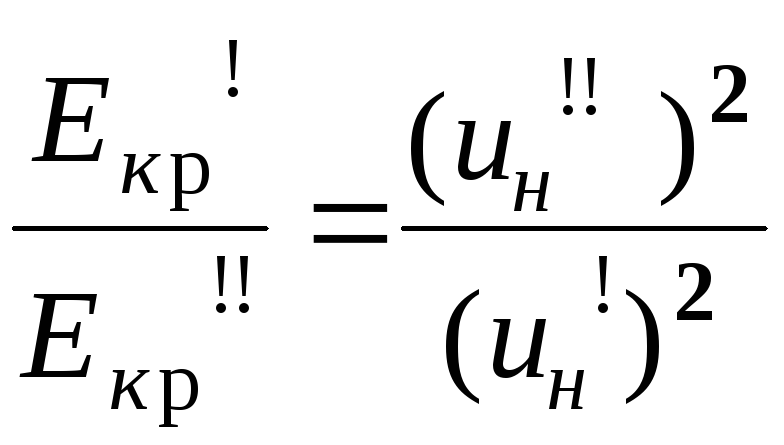
Для більшості органічних речовин як модель використовують н-бутан, С4Н10, для якого
Екр = 0,25 мДж, а uн = 0,38 м/с.
Для речовини, для якої Екр розраховують:
Екр
=
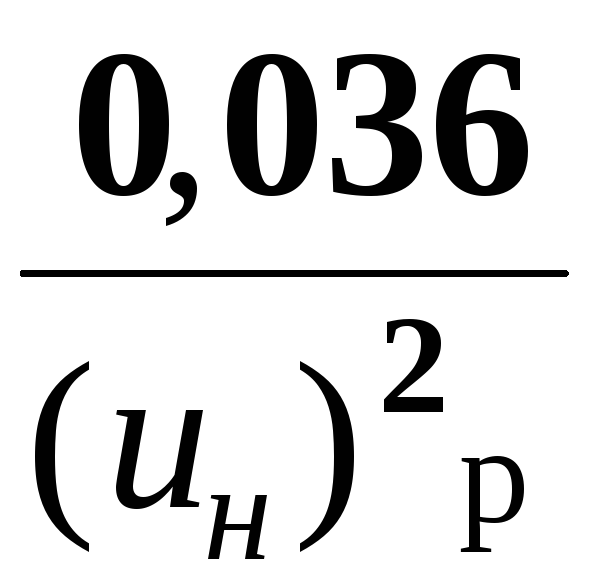
Можна виходити з критичного діаметру гасіння:
Екр = 0,01 dкр2,5
Висновок з питання 4
Примусове запалювання відрізняється від самоспалахування наявністю стороннього джерела запалювання. Критичною умовою спалахування при примусовому запалюванні являється нульовий градієнт температури між джерелом запалювання і горючою сумішшю.
Висновок з лекції
Швидкість реакції залежить від природи речовини, концентрації її і температури. Розвиток реакції горіння здійснюється по ланцюговому механізму з проміжним утворенням пероксидних сполук. Причиною виникнення горіння є перевищення виділення тепла в якомусь процесі над його відведенням, яке веде до самоспалахування або примусового спалахування.
-
Яка реакція іде при однакових умовах з більшою швидкістю: та, енергія активації якої 30 кДж/моль, чи та, енергія активації якої 300 кДж/моль ?
-
Як зміниться швидкість реакції
NaOH + HCl = NaCl + H2O, якщо
концентрації обох вихідних речовин зменшити у два рази?
-
Як зміниться швидкість реакції
СН4 + 2О2 = СО2 + 2Н2О, якщо
тиск збільшити у два рази ?
-
Як зміниться швидкість реакції
С + О2 = СО2 якщо
тиск збільшити у два рази ?
-
Який вигляд має графік функції залежності виділення тепла хімічної реакції від температури ?
-
Який вигляд має графік функції залежності кількості тепла, що знімається з певної поверхні від температури ?
-
Що називається температурою самоспалахування?
-
Чому дорівнюватиме допустима температура нагріву технологічної поверхні реактора, якщо у виробництві застосовується бензол температура само-спалахування якого 560оС ?
