
2. Теплова теорія самоспалахування
Чому відносно повільна реакція окиснення переходить в бурхливу реакцію горіння?
За Вант-Гоффом: “Умова теплового самоспалахування полягає у неможливості теплової рівноваги між системою, яка реагує, й оточуючим середовищем”.
Перехід повільної реакції окиснення в бурхливе горіння спостерігається тоді, коли реакція окиснення отримує можливість самоприскорюватися. Прискорення реакції викликає і прискорення виділення теплоти реакції. Останнє викликає підвищення в системі температури і прискорення реакції. Чим більше тепла виділяється, тим швидше йде реакція, а чим швидше йде реакція, тим більше тепла виділяється. Якщо тепло вчасно не відводити, воно піднімає температуру в системі, суміш розігрівається і займається або вибухає.
Отже, причиною виникнення горіння є перевищення виділення тепла над його відведенням; при тепловому спалахуванні теплота є як причиною самоспалахування, так і його наслідком.
Поєднавши цю ідею з теорією ланцюгових реакцій, М.М. Семенов розробив теплову теорію самоспалахування (теорію теплового вибуху).
Кількість теплоти, яка виділяється при реакції, зокрема реакції горіння qвид залежить від питомої теплоти горіння речовини (Qг), кількості суміші, тобто об’єму (V), і швидкості реакції (v):
qвид = Qг · V · v.
За законом Аренiуса:
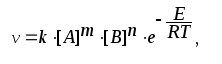
звідки :
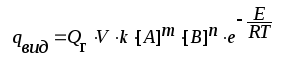 .
.
В наведеній залежності 5 параметрів (Q , V, k, [A] та [B]) є постійними i можуть бути замінені спільною константою Ксп. Тоді
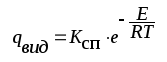
Графічно така залежність відображається як експоненціальна крива. Чим більше Т, тим стрімкіша крива.
Кількість тепла, що знімається, без великої помилки можна вважати пропорційною коефіцієнту теплопередачі від суміші до оточуючого середовища (α), площі теплопередачі (S) та різниці температур (температури горіння і температури оточуючого середовища):
qзн = α ·S·(Тг - Тзн) .
α, S і Тзн не змінюється.. Тоді qзн = const·(Tг – Тconst), а це є пряма пропорційна залежність; на графіку вона буде прямою, нахил якої залежить від α та S. Чим більше Тзн, тим меншу кількість теплоти можна зняти, бо тим менша різниця Тг - Тзн.
При цьому можливий випадок, коли в перший момент крива буде розташована вище прямої і с підвищенням температури наближатися до останньої, при якійсь температурі відбудеться доторкання, а при подальшому підвищенні температури крива буде знов розташовуватися вище прямої, стрімко віддаляючися від останньої.
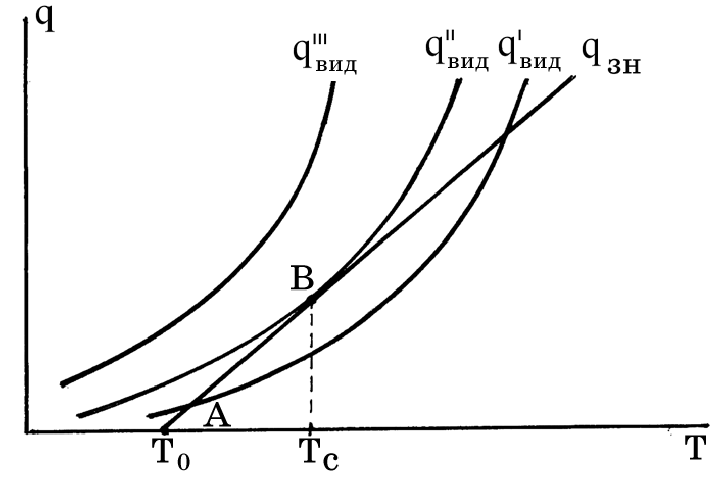
В початковий момент суміш розігрівається, потім до точки “В” цей розігрів поступово уповільнюється.
У точці “В” настає рівновага: скільки тепла виділяється, стільки і знімається.
Рівновага тут нестабільна, після цієї точки, точки самоспалахування і реакція, і тепловиділення різко прискорюються. З точки зору ланцюгової теорії, іде розгалуження ланцюга. Зважаючи на різке прискорення розігріву суміші М.М.Семенов назвав цей процес «тепловим вибухом».
Точка «В» відображає температуру самоспалахування. Температурою самоспалахування називається та найнижча температура, при якій спостерігається різке збільшення швидкості екзотермічних реакцій окислення речовини, яке закінчується полум’яним горінням
Для визначення температури самоспалахування існують різні методики і пристрої.
Визначати її треба для того, щоб знати, коли суміш спалахне навіть без примусового запалювання.
В технологічних процесах, згідно ОСТ 12.1.004-85, жодна поверхня не має права бути нагрітою до температури, яка перевищує 80% від стандартної температури самоспалахування речовини, яка в цьому процесі займається найлегше:
tдоп < 0,8 tсс.
За структурною формулою підраховують загальну кількість ланцюгів і довжину кожного з них. Потім знаходять середню довжину ланцюга у даній сполуці і, за таблицями, температуру самоспалахування, яка цій довжині відповідає.
2,2,4-триметилпентан. Його структурна формула:
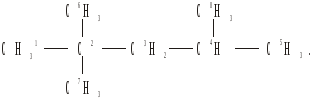
Загальна кількість вуглецевих ланцюгів визначається за формулою:
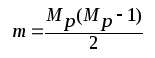
де: m – кількість карбонових ланцюгів, що складаються з Сi атомів карбону;
Mp – кількість груп СН3 в даній молекулі.
В нашій молекулі Мр = 5, значить,
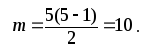
Треба
кожен з цих ланцюгів знайти.
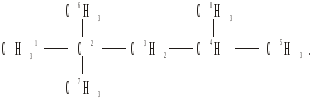
Сi = 5: 1,2,3,4,5; 1,2,3,4,8; 6,2,3,4,5;
6,2,3,4,8; 7,2,3,4,5; 7,2,3,4,8. m5 = 6.
Ci = 4: m4 = 0.
Ci = 3: 1,2,6; 1,2,7; 5,4,8; 6,2,7. m3 = 4.
Середню довжину вуглецевого ланцюга визначають за формулою:

![]() ,
або
,
або
![]()
За таблицями (табл. 3 додатка) Тссп = 673 К.
Висновок з питання 2.
Причиною виникнення горіння є перевищення виділення тепла над його відведенням, яке веде до різкого збільшення швидкості екзотермічних реакцій.
