
Опыт 2.
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ ХЛОРИДОВ МЕТАЛЛОВ СРЕДНЕЙ АКТИВНОСТИ
Описание проведения опыта.
Заполните электролизер раствором ZnCl2, присоедините зажимами к проводам графитовые стержни и опустите их в электролизер. Под контролем преподавателя включите источник постоянного тока. Через 2 минуты запишите наблюдения (что выделялось на катоде и аноде в процессе электролиза). Выключите ток и выньте стержни из электролизера. В анодное пространство добавьте 2 капли раствора KI и запишите, какое окрашивание появляется при этом.
Описание наблюдений.
При электролизе водного раствора ZnCl2 на графитовом катоде выделяются …………………………... и ……………………... (указать агрегатные состояния) вещества, а на графитовом аноде выделяется ………………….... (указать агрегатное состояние) вещество. При добавлении в анодное пространство раствора KI появляется ...................... (указать какое) окрашивание.
Уравнение диссоциации ZnCl2:
ZnCl2 →
Стандартный электродный потенциал
![]() = .............. В;
(написать его
значение).
= .............. В;
(написать его
значение).
……………….
![]() …………………….
(указать
…………………….
(указать
![]() <
–1,6 В;
<
–1,6 В;
![]() >
–0,15 В; –1,6
В <
>
–0,15 В; –1,6
В <
![]() <
–0,15 В).
<
–0,15 В).
Электронные уравнения катодных процессов: ... (написать их).
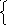
Формула аниона, входящего в состав ZnCl2: ... (написать ее).
Электронное уравнение анодного процесса: ... (написать его).
Молекулярное уравнение реакции с KI: ... (написать его).
Вывод.
При электролизе водных растворов хлоридов металлов средней активности, на графитовом катоде образуются ………... (написать общее название веществ) и ….. (написать формулу вещества), а на графитовом аноде образуется вещество ……. (написать формулу).
Опыт 3.
КОНТАКТНАЯ КОРРОЗИЯ МЕТАЛЛОВ
Описание проведения опыта.
В пробирку налейте 1 мл раствора NaCl и добавьте туда же 2 капли раствора метилоранжа. Запишите наблюдения (какова окраска метилоранжа в растворе соли). В фарфоровую чашечку налейте 20 мл раствора NaCl и добавьте туда же 3–4 капли раствора фенолфталеина. Возьмите медную и цинковую пластинки, зачистите их верхние концы наждачной бумагой и соедините их между собой, а нижние концы разведите подобно циркулю. Опустите нижние концы пластинок в раствор, налитый в чашечку (см. рисунок).
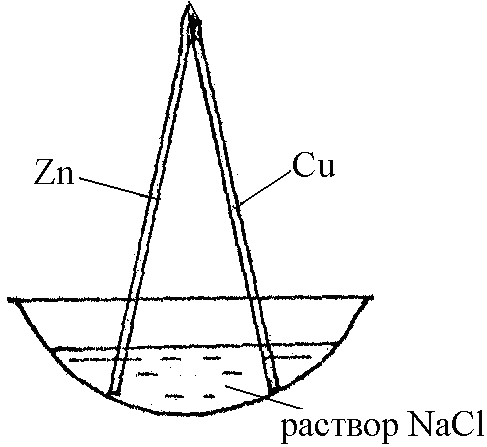
Через несколько минут запишите наблюдения (что и в каком месте произошло с окраской раствора).
Описание наблюдений.
Метилоранж в растворе NaCl имеет ……………… (указать какую) окраску. При контактной коррозии меди и цинка в растворе NaCl фенолфталеин окрасился в ……………… (указать какой) цвет около ............. (указать цинковой, медной) пластинки.
Среда раствора NaCl – ……………… (указать кислая, нейтральная, щелочная).
Электронное уравнение катодного процесса: ... (написать его).
Стандартные электродные потенциалы
металлов:
![]() =
...................... В … (указать >, <)
=
...................... В … (указать >, <) ![]() =
……… В (написать
их значения и сравнить)⇒металл
анода – … (указать Cu,
Zn).
=
……… В (написать
их значения и сравнить)⇒металл
анода – … (указать Cu,
Zn).
Электронное уравнение анодного процесса: ... (написать его).
Вывод.
При электрохимической коррозии в ……………………………….. (указать кислой, щелочной, нейтральной) среде, ионы …... (написать формулу) образуются около …………….... (указать анода, катода).
