
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ ФАРМАЦИЯ
.pdf236

|
COO |
O |
OR |
CH2OR1 |
|
|
|||||
H |
|
O |
|
|
O |
H |
R=R1=H хондроитин |
||||
H |
|
|
H |
|
|
||||||
O |
OH H |
|
H |
|
|
H |
|
R=SO3H R1=H хондроитин-4-сульфат |
|||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
OH |
|
|
H |
|
NH-C-CH3 |
|
|||
O
Гепарин является протеогликаном соединительной ткани и состоит из мукополисахаридных цепей, присоединенных к белку, обладает антикоагулянтным действием.
CH OH |
|
|
|
H |
|
|
CH2OSO3 |
|
||||
|
2 |
|
|
|
|
|
|
|
|
O |
|
|
H H |
O |
H |
|
|
|
O |
|
O H H |
H |
|
||
|
H |
|
|
H COO |
|
|
фрагмент |
|||||
OSO3 |
|
|
|
OH |
H |
|
OH H |
O |
||||
O |
|
|
|
|
O |
|
|
H |
|
|
молекулы |
|
H |
NHSO |
3 |
|
H |
OSO |
H |
NHSO3 n |
гепарина |
||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
Препараты гепарина в виде натриевых солей получают из легких и печени рогатого скота. Применяют в хирургии для предотвращения свертываемости крови при длительных операциях, а также для лечения инфаркта миокарда и атеросклероза.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (арены)
Арены – это ряд циклических соединений с сопряженной системой связей, обладающих специфическими химическими свойствами.
Классификация и номенклатура
1.Моноядерные арены
|
|
|
CH3 |
|
CH3 |
|
CH3 |
|
|
|
|
|
|||
|
CH3 |
|
1 CH3 |
|
1 |
|
1 |
|
|
2 |
2 |
||||
|
|
2 |
|||||
|
|
|
|
3 |
3 |
||
|
|
|
|
|
CH3 |
4 |
|
|
|
|
|
|
CH3 |
||
|
метилбензол |
1,2-диметилбензол, |
|
|
|||
бензол |
1,3-диметилбензол, 1,4-диметилбензол, |
||||||
|
толуол |
орто-ксилол |
мета-ксилол |
пара-ксилол |
|||
236

2.Полиядерные арены
CH2
CH
дифенил дифенилметан
трифенилметан
3.Конденсированные арены
нафталин |
антрацен |
фенантрен |
Ароматичность – это совокупность структурных, энергетических и химических особенностей, характерных для циклических сопряженных систем.
Структурный критерий – правило Хюккеля
Плоский цикл, содержащий 4n+2 р-электронов (где n=0,1,2,…), образующих замкнутую систему (кольцевой ток), является ароматическим.
В ароматических циклах атомы углерода, азота, кислорода находятся в sp2-гибридизации, что является необходимым условием для того, чтобы цикл был плоским и р-электроны делокализованы.
Для того, чтобы отнести циклическое соединение, имеющее сопряженную систему связей, к аренам необходимо выяснить следующее:
1)вид гибридизации атомов, образующих цикл;
2)количество делокализованных р – электронов (правило Хюккеля);
3)возможность описания структуры соединения методом резонанса (что позволяет выяснить степень делокализации р-электоронов).
Примеры ароматических систем:
Бензол
Все атомы углерода находятся в sp2-гибридизации, n=1, имеется 6 делокализованных р-ē, так называемый ароматический секстет или ароматическое ядро.
237

Нафталин
Все атомы углерода находятся в sp2-гибридизации, n=2, имеется 10 делокализованных р-ē, что показано с помощью 2-х резонансных структур.
Циклопропенил-катион
C6H5 |
|
C6H5 C6H5 |
|
C6H5 |
C6H5 |
|
C6H5 |
C6H5 |
C6H5 |
C H |
5 |
C |
H |
5 |
|
C H |
5 |
|
C6H5 |
6 |
6 |
|
|
6 |
|
|
Все атомы углерода находятся в sp2-гибридизации, n=0, имеется 2 делокализованных р-ē, что показано с помощью 3-х резонансных структур.
Тропилий-катион
Br2 |
Br |
|
- HBr |
||
|
||
H H |
H Br |
|
циклогептатриен |
тропилий-катион, ароматичен |
|
(неароматичен, один |
|
|
из атомов углерода в |
|
sp3-гибридизации, неплоский)
В тропилий-катионе все атомы углерода находятся в sp2-гибридизации, n=1, имеется 6 делокализованных р-ē, образующих замкнутую систему. Строение тропиллий-катиона описывается с помощью 4-х резонансных структур.
238

Циклопентадиенил-анион
Na
-1/2H2
H H H
В циклопентадиенил-анионе все атомы углерода находятся в sp2-гибридизации, n=1, имеется 6 делокализованных р-ē, образующих замкнутую систему.
Пиррол
N N N N
H H H H
Четыре атома углерода и атом азота находятся в sp2-гибридизации, распределение электронов для атома азота в пирроле следующее:
 в ароматическом секстете участвует
в ароматическом секстете участвует  электронная пара, находящаяся на pz
электронная пара, находящаяся на pz
 2sp2 2pz 1s
2sp2 2pz 1s
Всего в ароматическом ядре пиррола 6 р-ē: 4 р-ē атомов углерода и 2 р-ē атома азота. Аналогично для тиофена и фурана:
S O
тиофен фуран
Пиридин
N N N
239

Пять атомов углерода и атом азота находятся sp2-гибридизации. Распределение электронов для атома азота пиридина следующее:
 в ароматическом секстете участвует 1p электрон,
в ароматическом секстете участвует 1p электрон,
НПЭ азота не включена в ароматический секстет

 2sp2 2pz 1s
2sp2 2pz 1s
В ароматическом ядре пиридина – 6 делокализованных р-ē: 5 р-ē атома углерода и 1 р-ē атома азота ( 2 резонансные структуры).
Бензол, нафталин, фенантрен, антрацен относят к бензоидным аренам. Ароматические катионы (циклопропенил, тропилий) считаются небензоидными ароматическими структурами. Пиррол, тиофен, фуран,
пиридин являются гетероциклическими аренами.
Строение бензола и его реакционная способность
Молекула бензола плоская, р-ē образуют единое электронное облако, которое находится над и под плоскостью углеводородного скелета. Длины С-С связей одинаковы и равны 0,139 нм, угол равен 120°. Длина С-Н связей – 0,109 нм.
Вид молекулы бензола «сверху» и «сбоку»:
H
H H C C
C C
H

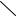 H C C
H C C
H
Выигрыш в энергии за счет образования единого электронного облака –
энергия стабилизации ( или резонанса) составляет 150 кДж/моль. При этом
бензол сравнивают с гипотетическим циклогексатриеном, в котором р- электроны «не делокализованы» (не образуют замкнутой системы).
Качественными реакциями для бензола являются отсутствие обесцвечивания бромной воды и раствора KMnO4 при 20°С, не смотря на наличие трех двойных связей. Для бензола преимущественно характерны
реакции электрофильного замещения атома водорода, SЕ ArH, протекающие при сохранении ароматического ядра.
240

I. Реакции электрофильного замещения, SЕ ArH
1) Нитрование
реагенты: HNO3 к./H2SO4 к. (нитрующая смесь) ; KNO3/H2SO4 к;
H HO-NO2 к |
NO2 |
|||
|
|
|
+ H2O |
|
H2SO4 к (катализатор) |
||||
|
||||
|
500C |
нитробензол |
||
Механизм
а) генерация Е+
HO-NO2 |
+ |
H-OSO H |
H-O |
NO2+ OSO3H |
H2O + NO2 + OSO3H |
|
3 |
H |
|
|
|
|
|
|
|
|
|
E+=NO2 |
(нитроний-катион) |
|
|
|
|
б)
NO2 |
|
H |
NO2 быстро |
|
|
медленно |
NO2 |
|
π-комплекс |
|
σ-комплекс |
|
(бензолониевый ион) |
|
описание σ-комплекса методом резонанса:
H |
|
H |
|
H |
NO |
2 |
NO |
2 |
NO2 |
|
|
|
 NO2
NO2
- H+
 H
H
NO2
2) Галоидирование (хлорирование и бромирование)
реагенты: Cl2 (Br2) / Fe или FeCl3 (FeBr3)
Br
Br2
+ HBr
Fe
бромбензол
241

генерация Е+ : |
2Fe + |
3Br2 |
FeBr3 |
(кислота Льюиса) |
|
Br Br |
+ |
FeBr3 |
Br FeBr4 |
|
E+ = Br |
(бромоний катион) |
||
Механизм аналогичен описанному для реакции нитрования.
Для успешного фторирования и йодирования применяются специальные методики.
3) Сульфирование
реагенты: к. H2SO4/100° ; 8% олеум , 20°
HO-SO3H к. |
|
|
O |
|
|
|
S |
O + |
H2O |
||
|
|
|
|||
100° |
|
|
|||
|
|
|
OH |
|
|
|
|
|
|
|
|
бензолсульфокислота (ряд аренсульфоновых кислот)
Механизм
Сульфирование относится к обратимым реакциям, причиной является невысокая прочность связи углерод-сера.
генерация Е+:
HO-SO3H + H-OSO3H |
H-O SO3H + OSO3H |
H2O + SO3H + OSO3H |
|
H |
|
E+ = SO H (сульфоний-катион) |
|
|
3 |
|
|
|
H |
SO3H |
|
H2O |
|
SO3H |
SO3H |
+ H3O |
быстро |
|
|
|
медленно |
|
Для смещения равновесия равновесия вправо применяют азеотропную отгонку воды или добавляют P2O5 .
Обратная реакция называется десульфированием и применяется как метод снятия сульфогруппы (см. также тему сульфокислоты).
SO3H |
|
CH3 |
|
|
|
|
|
||
|
|
|
||
|
H3O |
|
+ H2SO4 |
+ H2O |
>100° |
|
|||
|
|
|
||
CH3
п-толуолсульфокислота толуол
242

4) Ацилирование (по Фриделю-Крафтсу)
реагенты: |
R-C |
O |
, |
AlCl3 |
; (R-CO)2O , AlCl3 |
|
|
|
||
Cl |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
CH3-C |
O |
|
O |
|
|
|
|
|
||
Cl |
|
C CH3 |
+ |
HCl |
|
|
|
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
AlCl3 |
|
ацетилбензол, ацетофенон |
|
|
|
|
|||
|
|
|
|
|
|
|
||||
генерация Е+ : |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
O |
|
|
|
AlCl |
|
CH3-C |
|
AlCl4 |
E+= CH -C |
(ацетил-катион) |
||
CH -C |
+ |
|
3 |
|
||||||
3 |
|
|
|
|
|
|
3 |
|
|
|
Cl |
|
|
|
|
|
O |
|
|
|
|
CH3-C |
O |
|
|
|
|
AlCl3 |
|
|
|
|
O |
+ |
|
AlCl3 |
CH3-C |
O C |
CH3 |
|
|
||
|
|
|
|
|||||||
CH3-C |
O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
||
Далее механизм аналогичен, описанному для реакции нитрования.
5) Алкилирование
реагенты: R-Cl (R-Br) , AlCl3 ROH / H3PO4 или BF3
Cl CH3-CH-CH3 (а)
AlCl3
CH3CH2CH2Cl (б)
AlCl3
CH3-CH=CH2 (в)
(по Фриделю Крафтсу) ; алкены / HF
CH3
CH
CH3
HF изопропилбензол, кумол
OH
CH3-CH-CH3 (г)
H3PO4
генерация Е+ :
а) CH |
-CH |
Cl |
+ |
AlCl |
|
|
CH -CH |
AlCl |
|
E+= CH(CH3)2 |
||
|
|
|
||||||||||
3 |
|
|
|
|
3 |
3 |
|
|
4 |
|
||
|
|
|
|
|
|
|
||||||
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
243

б) CH3-CH2-CH2 Cl + |
AlCl3 |
CH3-CH-CH2 |
||
|
|
- AlCl4 |
|
H |
в) |
H+ |
|
|
|
CH3-CH=CH2 |
CH3-CH-CH3 |
|
|
|
|
H+ |
|
|
|
г) CH3-CH OH |
CH3-CH |
OH2 |
-H2O |
|
|
CH3 |
CH3 |
|
|
|
|
|
||
~H
CH3-CH-CH3
гидридный перенос (образуется более устойчивый вторичный карбкатион)
CH3-CH-CH3
Далее механизм аналогичен, описанному ранее для нитрования.
II. Реакции присоединения |
|
|
|
|
|
Реакции |
присоединения |
мало |
характерны |
для |
бензола: |
хлорирование(бромирование) на свету и гидрирование в каталитических условиях.
Cl |
H |
Cl H |
3Cl2 |
3H2 |
H |
|
Cl |
||
H |
|
H |
hν |
Ni |
Cl |
Cl |
Cl |
|
|
|
H |
|
циклогексан |
|
гексахлоран |
|
|||
(1,2,3,4,5,6 - гексахлорциклогексан)
II. Окисление
Бензол и его гомологи устойчивы к действию водных растворов KMO4 при
200С.
а) О2 воздуха
O2 |
|
H |
C O |
||
|
|
|
|||
|
|
|
O |
||
V2O5 |
, 450° |
C |
|||
|
|||||
|
|
H |
O |
||
|
|
|
|
||
малеиновый ангидрид
б) озонирование
|
O O |
|
|
|
O3 |
O |
Zn |
O |
O |
|
O O O |
|
3 |
C C |
O |
H2O |
H |
H |
|
O |
O |
|
|
глиоксаль |
|
озонид |
|
|
|
244
