
- •1. Гармонический осциллятор, его закон движения, скорость, ускорение, возвращающая сила, энергия.
- •2. Маятники пружинный, математический, физический.
- •3. Сложение одинаково направленных гармонических колебаний с одинаковыми частотами. Метод векторной диаграммы. Биения.
- •4. Сложение взаимно-перпендикулярных колебаний. Фигуры Лиссажу.
- •5. Свободные затухающие колебания. Логарифмический декремент. Апериодический процесс.
- •6. Вынужденные колебания. Резонанс
- •7. Волна, уравнение гармонической волны.
- •8. Перенос волной энергии, вектор Умова.
- •9. Электромагнитное поле. Уравнения Максвелла. Плоская электромагнитная волна.
- •Уравнения Максвелла для электромагнитного поля
- •Интерференция волн
- •Интерференция света
- •11. Интерференция света в тонких пленках, примеры ее наблюдения и применения.
- •Кольца Ньютона
- •Полосы равного наклона (интерференция от плоскопараллельной пластинки)
- •Применение интерференции света
- •12. Дифракция, условие её наблюдения. Принцип Гюйгенса-Френеля. Метод зон Френеля и его применение для расчета дифракции света на узкой щели.
- •13. Дифракционная решетка, ее применение в качестве спектрального прибора.
- •14. Физические принципы голографии.
- •15. Поляризация света. Поляризатор и анализатор. Закон Малюса. Примеры получения и применения поляризованного света.
- •16. Тепловое излучение, его характеристики: энергетическая светимость, испускательная и поглощательная способности. Цвет несамосветящегося тела. Абсолютно черное и серое тела. Закон Кирхгофа
- •17. Законы излучения абсолютно черного тела: Закон Стефана-Больцмана, закон Вина. Трудности классической физики при объяснении распределения энергии в спектре черного тела. Квантовая гипотеза Планка.
- •1. Закон Стефана-Больцмана:
- •2. Закон Вина:
- •18. Фотоэффект, красная граница, работа выхода электрона из металла, задерживающее напряжение. Квантовый механизм фотоэффекта, уравнение Эйнштейна.
- •19. Эффект Комптона, его квантовый механизм.
- •20. Корпускулярно-волновой дуализм излучения. Фотоны. Взаимосвязь волновых и корпускулярных характеристик фотонов. Связь между корпускулярной и волновой картинами.
- •21. Волна де Бройля. Дифракция электронов. Статистический смысл волн де Бройля. Электронный микроскоп как пример практического использования электронных волн.
- •22. Соотношения неопределенностей как выражение корпускулярно-волнового дуализма и границ применения классической физики.
- •23. Состояние и уравнение движения квантовой частицы. Волновая функция, ее статистический смысл. Уравнение Шредингера.
- •24. Примеры применения уравнения Шредингера: частица в бесконечно глубокой потенциальной яме; гармонический осциллятор.
- •25. Развитие представлений о строении атома. Модель атома Резерфорда, ее недостатки.
- •26. Спектры испускания и поглощения атомов как источник информации об их строении и свойствах. Спектр атома водорода. Формула Бальмера.
- •27. Модель атома Бора, ее недостатки. Постулаты Бора. Энергетические уровни атома водорода и его спектр по модели Резерфорда – Бора.
- •28. Волновая модель атома водорода. Квантовые числа, их проявления в опыте. Периодическая таблица элементов Менделеева как отражение квантовых состояний электронов.
- •29. Спонтанное и вынужденное излучение. Лазер.
- •30. Ядро атома: состав, размеры, плотность. Энергия связи ядра атома, удельная энергия связи.
- •31. Радиоактивность. Закон радиоактивного распада. Период полураспада. Виды радиоактивного распада. Экологические аспекты радиоактивности.
- •32. Ядерная реакция. Законы сохранения. Энергетический эффект. Реакция деления тяжелых ядер, термоядерная реакция, их применение в энергетике, экологические аспекты.
26. Спектры испускания и поглощения атомов как источник информации об их строении и свойствах. Спектр атома водорода. Формула Бальмера.
И сследования спектров излучения разреженных газов (т.е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самый изученный спектр атома водорода. Схема уровней водорода показана на рисунке.
Электрон, имеющий энергию Е1, не может самопроизвольно ее изменить, т.к. ниже разрешенных уровней нет, а для перехода на верхние требуется получение энергии извне. Это устойчивое состояние называется основным (n=1). Если электрон находится на любом другом уровне с отрицательной энергией (Е2 и т.д.). то состояние атома называется возбужденным. Если электрон атома получает достаточно большую порцию энергии извне, в результате чего его полная энергия оказывается равной нулю, он становится свободным, т.е. отрывается от атома. Это значение полученной энергии называется энергией ионизации, она переводит атом из основного состояния (n=1) в свободное состояние (n=∞).
![]() - Формула
Бальмера,
где λ – длины
волн в спектре атома водорода, R
= 1,097*107
м-1
– постоянная Ридберга; k,
n
– целые числа
(k
≠ n).
- Формула
Бальмера,
где λ – длины
волн в спектре атома водорода, R
= 1,097*107
м-1
– постоянная Ридберга; k,
n
– целые числа
(k
≠ n).
Все линии группируются в серии, соответствующие определенному диапазону шкалы электромагнитных волн.
Серия ультрафиолетовая (Лаймана): k=1, n=2,3,4,…,∞;
Серия видимая (Бальмера): k=2, n=3,4,5,…,∞;
Серия инфракрасная (Пашена): k=3, n=4,5,6,…,∞; и т.д.
Если через газ, заполняющий трубку пропустить свет и раскладывать в спектр прошедшее излучение, то на тех же самых местах будут появляться черные полосы, т.е. спектры поглощения и спектры излучения совпадают.
27. Модель атома Бора, ее недостатки. Постулаты Бора. Энергетические уровни атома водорода и его спектр по модели Резерфорда – Бора.
Модель планетарная (ядерная) + постулаты Бора
1. Специальные состояния: Е1, Е2, Е3, … - уровни энергии.
2. Момент импульса:
![]() ,
n=1,2,3,…
– номер
стационарного состояния, орбиты.
,
n=1,2,3,…
– номер
стационарного состояния, орбиты.
(волна де Бройля:
![]() ,
2πr=λn
– Бор не знал!)
,
2πr=λn
– Бор не знал!)
3. n,k – номера уровней энергии
hν = Еn - Ek – Энергия излучается скачком, при переходе с одного энергетического уровня на другой n→k.
Схема расчета:
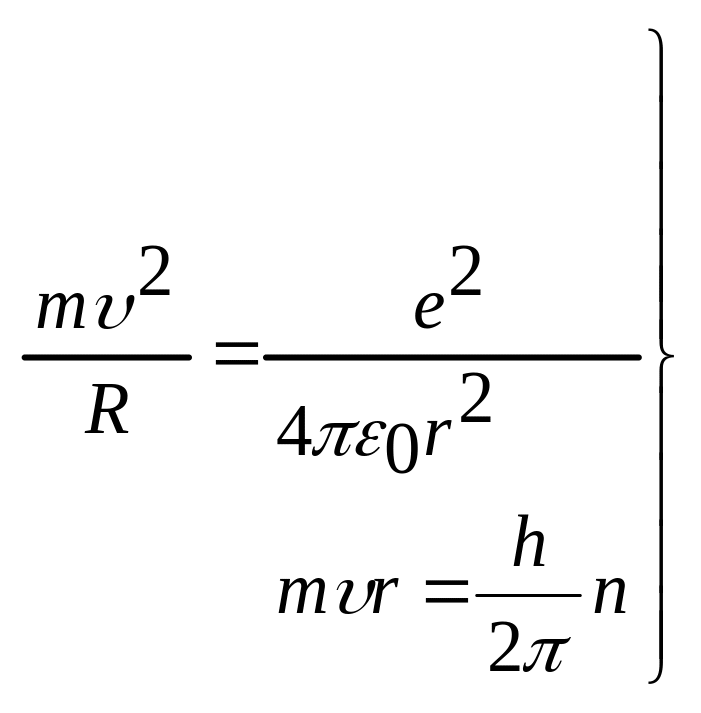 rn,
υn
rn,
υn
![]() - характер
притяжения
- характер
притяжения
![]()
Eп
– полная
энергия на уровне с номером n:

Схема уровней энергий атома водорода (представлена на рис.):
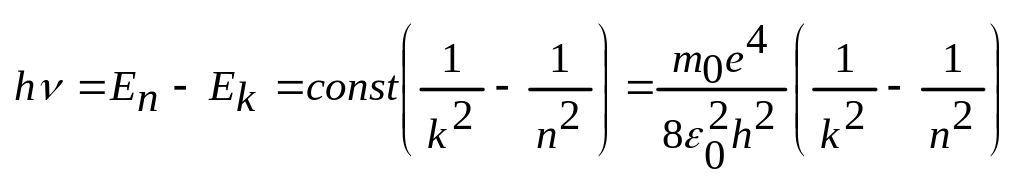 - Теория.
- Теория.
Опыт: формула Бальмера:
![]() Полное совпадение
опыта и теории!
Полное совпадение
опыта и теории!
Модель Бора отлично согласуется с опытом для одноэлектронных атомных систем.
атом Н, водородоподобные ионы: He+; Li++.
![]() ,
где Z
– порядковый
номер элемента (заряд ядра); R
– постоянная Ридберга.
,
где Z
– порядковый
номер элемента (заряд ядра); R
– постоянная Ридберга.
Однако, для двухэлектронных и более сложных атомов теория Бора не работает. Эта теория приближенная.
Заслуга теории Бора заключается в том, что она показала необходимость перехода от классических к квантовых представлениям. Сама модель Бора была полуклассической, полуквантовой. В настоящее время имеет только исторический интерес.
Постулаты Бора:
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии.
Второй постулат
Бора (правило частот):
при переходе электрона с одной стационарной
орбиты на другую излучается (поглощается)
один фотон с энергией
![]() равной разности энергий соответствующих
стационарных состояний (En
и Em
энергии до
и после излучения (поглощения)).
равной разности энергий соответствующих
стационарных состояний (En
и Em
энергии до
и после излучения (поглощения)).
