
- •Растворы полимеров
- •Полимеризация
- •Поликонденсация
- •Полиэтилен
- •Полипропилен
- •Поливинилхлорид
- •Полиэтилентерефталат
- •Полистирол
- •Ионообменные смолы
- •Эпоксидные смолы
- •Волокна химические
- •Пластические массы
- •Гальванический элемент
- •Электродные потенциалы
- •Тривиальные названия
- •Классификация
- •Физические свойства
- •Характерные химические реакции
- •Алкадиены (диеновые углеводороды)
- •Строение, общие свойства
- •Физические свойства
- •Получение
- •Химические свойства
- •Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л).
- •36. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Типы окислительно-восстановительных реакций.
- •Структура периодической системы
Алкадиены (диеновые углеводороды)
Алкадиены, как следует из их названия, представляют собой ненасыщенные углеводороды, содержащие в своем углеродном скелете две двойные связи. Их также называют диеновыми угле-водородами. Общая формула гомологического ряда алкадиенов — СnН2n-2. Следует иметь в виду, что такая же формула соответствует и другим гомологическим рядам — например, алкинов или циклоалкенов.
Строение, общие свойства
Номенклатура При составлении названия алкадиена по номенклатуре ИЮПАК главную цепь необходимо выбирать так, чтобы в нее входили обе двойные связи. Нумеровать атомы в цепи нужно таким образом, чтобы атомы углерода, связанные двойными связями, получили минимальные номера:
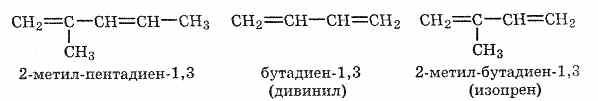 Некоторые
простые алкадиены имеют тривиальные
названия (на рисунке выше они приведены
в скобках), однако их употребление (в
отличие от названий простейших алканов)
не рекомендуется в номенклатуре ИЮПАК.
Тем не менее они используются, и их нужно
знать.
Возможны три разных способа
взаиморасположения двойных связей в
диеновом углеводороде относительно
друг друга:
1) Двойные связи расположены
вплотную одна к другой:
СН2=С=СН-СН2-СН3
Такие
углеводороды называются кумуленовыми.
Рассмотрение химических свойств
кумуленовых углеводородов выходит за
рамки данного курса.
2) Двойные связи
разделены более чем одной одинарной
связью:
СН2=СН-СН2-СН=СН2
Такие
алкадиены носят название изолированных.
Их химические свойства ничем не отличаются
от свойств обычных алкенов (разумеется,
с учетом того, что в реакцию могут
вступать две никак не зависящие друг
от друга двойные связи).
-связью, то
их называют сопряженными. В этом случае
в молекуле двойные и одинарные связи
чередуются, как, например, в бутадиене-1,3
СН2=СН—СН=СН2, который является простейшим
сопряженным алкадиеном.3)
Если двойные связи разделены в цепи
только одной
Соединения с чередующимся
расположением двойных связей отличаются
по свойствам как от алкенов, так и от
других типов алкадиенов. Особенности
химического поведения этих соединений
объясняются наличием сопряжения.
Сопряжение —
образование единого электронного облака
в результате взаимодействия
негибридизованных р-орбиталей в молекуле
с чередующимися двойными и одинарными
связями.
Большой интерес представляют
диены с сопряженными двойными связями,
так как они имеют некоторые свойства,
обусловливающие их широкое применение
в химической промышленности. Особые
свойства таких диеновых углеводородов
объясняются их электронным строением.
Рассмотрим строение бутадиена.
Экспериментально установлено расположение
всех атомов углерода в одной плоскости,
определены межатомные расстояния.
Оказалось, что длина связи между
углеродными атомами (в нм) такова:
Некоторые
простые алкадиены имеют тривиальные
названия (на рисунке выше они приведены
в скобках), однако их употребление (в
отличие от названий простейших алканов)
не рекомендуется в номенклатуре ИЮПАК.
Тем не менее они используются, и их нужно
знать.
Возможны три разных способа
взаиморасположения двойных связей в
диеновом углеводороде относительно
друг друга:
1) Двойные связи расположены
вплотную одна к другой:
СН2=С=СН-СН2-СН3
Такие
углеводороды называются кумуленовыми.
Рассмотрение химических свойств
кумуленовых углеводородов выходит за
рамки данного курса.
2) Двойные связи
разделены более чем одной одинарной
связью:
СН2=СН-СН2-СН=СН2
Такие
алкадиены носят название изолированных.
Их химические свойства ничем не отличаются
от свойств обычных алкенов (разумеется,
с учетом того, что в реакцию могут
вступать две никак не зависящие друг
от друга двойные связи).
-связью, то
их называют сопряженными. В этом случае
в молекуле двойные и одинарные связи
чередуются, как, например, в бутадиене-1,3
СН2=СН—СН=СН2, который является простейшим
сопряженным алкадиеном.3)
Если двойные связи разделены в цепи
только одной
Соединения с чередующимся
расположением двойных связей отличаются
по свойствам как от алкенов, так и от
других типов алкадиенов. Особенности
химического поведения этих соединений
объясняются наличием сопряжения.
Сопряжение —
образование единого электронного облака
в результате взаимодействия
негибридизованных р-орбиталей в молекуле
с чередующимися двойными и одинарными
связями.
Большой интерес представляют
диены с сопряженными двойными связями,
так как они имеют некоторые свойства,
обусловливающие их широкое применение
в химической промышленности. Особые
свойства таких диеновых углеводородов
объясняются их электронным строением.
Рассмотрим строение бутадиена.
Экспериментально установлено расположение
всех атомов углерода в одной плоскости,
определены межатомные расстояния.
Оказалось, что длина связи между
углеродными атомами (в нм) такова:
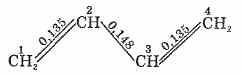 Крайние
связи (C1—С2 и С3—С4) имеют несколько
большую длину, чем двойная связь в
этилене (0,132 нм), центральная связь С2—С3
короче простой связи О—С (0,154 нм). Чтобы
объяснить это, обратимся к электронному
строению бутадиена.
-связи, перекрываются
не только между первым и вторым, третьим
и четвертым атомами углерода, но также
между вторым и третьим. Хотя 2,3-перекрывание
меньше 1,2- и 3,4-перекрывания (рис. 34), все
же оно вызывает уменьшение длины
центральной связи С2—С3.-связи.
Негибридиованные р-электронные орбитали
(их четыре), образующие У
каждого атома углерода имеются три
гибридные sp2-орбитали, которые при
перекрывании образуют
-электронное
облако. В этом случае говорят о сопряжении
двойных связей, приводящем к некоторому
выравниванию связей. Сопряжениесвязей
часто изображают пунктиром:-связи,
а единое, общее При
перекрывании р-орбиталей в бутадиене
получаются не отдельные, обособленные
Основная особенность сопряженной
системы заключается в том, что она
реагирует как единое целое. Это можно
проследить на примере присоединения
хлороводорода к бутадиену. Данная
реакция, подобно всем злектрофильным
реакциям присоединения по двойной
связи, начинается с присоединения
протона к концевому атому углерода (по
правилу Марковникова — см. §2.4).
Крайние
связи (C1—С2 и С3—С4) имеют несколько
большую длину, чем двойная связь в
этилене (0,132 нм), центральная связь С2—С3
короче простой связи О—С (0,154 нм). Чтобы
объяснить это, обратимся к электронному
строению бутадиена.
-связи, перекрываются
не только между первым и вторым, третьим
и четвертым атомами углерода, но также
между вторым и третьим. Хотя 2,3-перекрывание
меньше 1,2- и 3,4-перекрывания (рис. 34), все
же оно вызывает уменьшение длины
центральной связи С2—С3.-связи.
Негибридиованные р-электронные орбитали
(их четыре), образующие У
каждого атома углерода имеются три
гибридные sp2-орбитали, которые при
перекрывании образуют
-электронное
облако. В этом случае говорят о сопряжении
двойных связей, приводящем к некоторому
выравниванию связей. Сопряжениесвязей
часто изображают пунктиром:-связи,
а единое, общее При
перекрывании р-орбиталей в бутадиене
получаются не отдельные, обособленные
Основная особенность сопряженной
системы заключается в том, что она
реагирует как единое целое. Это можно
проследить на примере присоединения
хлороводорода к бутадиену. Данная
реакция, подобно всем злектрофильным
реакциям присоединения по двойной
связи, начинается с присоединения
протона к концевому атому углерода (по
правилу Марковникова — см. §2.4).
![]() -электронная
пара соседней двойной связи. В результате
недостаток электронов (положительный
заряд) переносится частично и на концевой
атом углерода. Таким образом, катион
имеет мезомерный эффект:Положительный
заряд в образовавшемся катионе не
закреплен (локализован) на втором атоме
углерода, так как к нему может смещаться
-электронная
пара соседней двойной связи. В результате
недостаток электронов (положительный
заряд) переносится частично и на концевой
атом углерода. Таким образом, катион
имеет мезомерный эффект:Положительный
заряд в образовавшемся катионе не
закреплен (локализован) на втором атоме
углерода, так как к нему может смещаться
![]() Мезомерный
катион можно записать в виде одной
структуры с распределенным зарядом
(строго говоря, полной симметрии в;
распределении заряда здесь нет):
Мезомерный
катион можно записать в виде одной
структуры с распределенным зарядом
(строго говоря, полной симметрии в;
распределении заряда здесь нет):
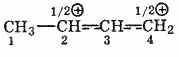 Если
в мезомерном катионе анион хлора
присоединится ко второму атому, то
получится продукт 1,2-присоединения;
если
Присоединение идет к четвертому
атому углерода, то образуется продукт
1,4-присоединения.
Если
в мезомерном катионе анион хлора
присоединится ко второму атому, то
получится продукт 1,2-присоединения;
если
Присоединение идет к четвертому
атому углерода, то образуется продукт
1,4-присоединения.
 Обычно
получается смесь продуктов присоединения.
Процентный выход того или иного продукта
зависит от условий, прежде всего от
температурного режима, растворителя.
При действии второй молекулы хлороводорода
присоединение к оставшейся двойной
связи идет по обычным законам, образуется
дихлорпроизводное. Подобно реакции с
хлороводородом, проходят реакции с
бромом, хлором и др.
Реакция полимеризации
тоже может протекать таким образом, что
присоединение элементарных звеньев
будет проходить в ^Вожениях 1,2 или 1,4.
При полимеризации бутадиена по способу
Лебедева (в присутствии металлического
натрия) получаются макромолекулы
нерегулярного разветвленного строения:
Обычно
получается смесь продуктов присоединения.
Процентный выход того или иного продукта
зависит от условий, прежде всего от
температурного режима, растворителя.
При действии второй молекулы хлороводорода
присоединение к оставшейся двойной
связи идет по обычным законам, образуется
дихлорпроизводное. Подобно реакции с
хлороводородом, проходят реакции с
бромом, хлором и др.
Реакция полимеризации
тоже может протекать таким образом, что
присоединение элементарных звеньев
будет проходить в ^Вожениях 1,2 или 1,4.
При полимеризации бутадиена по способу
Лебедева (в присутствии металлического
натрия) получаются макромолекулы
нерегулярного разветвленного строения:
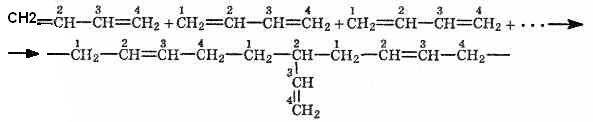 Такие
макромолекулы не дают высококачественного
материала: из-за их разветвленности нет
плотной упаковки молекул в полимере и
каучук получается с невысокими
физико-механическими показателями.
Поэтому в настоящее время в присутствии
специальных катализаторов получают
каучуки, в макромолекулax которых
элементарные звенья соединены только
в положениях 1,1; в этом случае цепь не
имеет разветвлений.
Такие
макромолекулы не дают высококачественного
материала: из-за их разветвленности нет
плотной упаковки молекул в полимере и
каучук получается с невысокими
физико-механическими показателями.
Поэтому в настоящее время в присутствии
специальных катализаторов получают
каучуки, в макромолекулax которых
элементарные звенья соединены только
в положениях 1,1; в этом случае цепь не
имеет разветвлений.
