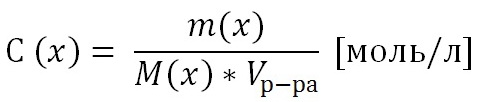25) Характеристика растворов
Истинные растворы — устойчивые гoмогенные (однородные) системы переменного состава, состоящие из двух или более компонентов. Растворы могут быть жидкими и твердыми. Иногда о смесях газов говорят, что они относятся к растворам. Самая характерная особенность растворов (истинных растворов) состоит в том, что растворенное вещество находится в виде атомов, ионов или молекул, равномерно окруженных атомами, ионами или молекулами растворителя. Растворитель — вещество (как правило, жидкость), в среде которого находится растворенное вещество. Деление на растворенные вещества и растворители условно. В случае растворения твердых веществ растворителем всегда считают жидкость, а в случае растворения жидких веществ, растворителем считают ту жидкость, которой для приготовления раствора взяли больше по объему. Однако за водой практически всегда сохраняется приоритет называться растворителем. Способность к образованию растворов выражена в различной степени у различных веществ. Одни вещества способны неограниченно растворяться друг в друге (например, спирт и вода), другие — лишь в ограниченных количествах (например, поваренная соль в воде). Раствор, в котором данное вещество при данных условиях (температуре (и давлении для газов)) больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называется нaсыщенным. Раствор, в котором растворяемое вещество еще может раствориться, называется ненасыщенным. Растворимостью (коэффициентом растворимости) называется максимальная масса вещества, которая при данной температуре может раствориться в 100 г растворителя. Для подавляющего большинства твердых веществ растворимость в воде увеличивается с повышением температуры. Если раствор, нaсыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы растворенного вещества, то образуется пересыщенный раствор. Пересыщенным называется раствор, содержащий больше растворенного вещества, чем нaсыщенный при той же температуре раствор. Растворимость газов, в отличие от большинства твердых веществ, с увеличением температуры уменьшается. Растворы с низким содержанием растворенного вещества называют разбавленными, а с высоким — концентрированными. Для количественного выражения состава раствора используют концентрацию и массовую долю растворенного вещества.
26) способы выражения концентрации раствора.
Способы выражения концентрации растворов
Концентрацию веществ в растворах можно выразить разными способами. На этой страничке вы с ними познакомитесь. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
1) Массовая доля раствора ω (х). Выражается отношением массы растворенного вещества m(х) к массе раствора.
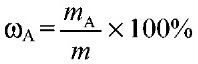
Является величиной безразмерной или выражается в процентах:

Например, 15%-ный раствор: массовая доля ω (х) = 0,15
2) Молярная концентрация раствора С(х). Выражается отношением количества растворенного вещества n(x) к объему раствора, выраженному в литрах.
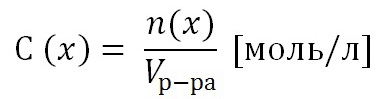
Т.к. количество вещества n(x) выражается отношением массы вещества m(x) к его молярной массе M(x), то молярную концентрацию раствора удобно выразить как