- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Властивості ферментів
Висока каталітична активність (фермент амілаза за 1хв. перетворює 1100000 молекул субстрату; 1 моль ферменту сахараза за 1 с здатен розщепити 1000моль бурякового цукру; 1г кристалів пепсину розщеплює 50кг коагульованого яєчного альбуміну; 1 г кристалічного реніну згортає 72т молока.
Каталітичну активність ферменту характеризують молекулярною активністю.
Молекулярна активність – число молекул даного субстрату або еквівалентів реагуючих груп, що перетворюються за 1 хв. однією молекулою ферменту при оптимальній концентрації субстрату.
Специфічність дії ферментів полягає в тому, що певний фермент діє лише на певну реакцію або групу реакцій, що відбуваються в організмі. Зумовлена конформаційною та електростатичною компліментарністю між молекулами ферменту; субстрату і структурою активного центру ферменту.
Специфічність:
абсолютна специфічність (каталізують лише одну реакцію – фермент уреаза каталізує гідролітичне розщеплення сечовини на СО2 і NH3; фермент каталаза діє тільки на пероксид водню);
абсолютна групова специфічність (каталізують певний тип реакції – пепсин, трипсин, хімотрипсин каталізують розщеплення пептидних зв’язків у білках і пептидах);
відносна групова специфічність (каталізують розщеплення окремого типу хімічного зв’язку – фермент ліпаза гідролізує складноефірний зв’язок в будь-яких жирах);
стереоізомерна, просторова специфічність (дія на цис-трансізомери або оптично активні сполуки – фермент дипептидаза прискорює гідроліз дипептидів, утворених залишками L-амінокислот; фермент α-глюкозиада діє тільки на α-глюкозиди, а фермент β-глюкозиада – тільки на β-глюкозиди).
Чутливість до температури (термочутливі та термолабільні).
При t>800С – денатурація білкового компонента, втрата активності ферментів. При низьких температурах – дія ферментів припиняється (не руйнуються);
Оптимальна активність ферментів: t = 37 – 400С (збільшення швидкості ферментативної реакції). Якщо при захворюванні температура тіла людини підвищилась до 39,5С, це свідчить про прискорення біохімічних процесів у 1,13 – 1,39рази (13-19%). Підвищення температури до 40-420С призводить до швидкого зниження біохімічного процесу у зв’язку з денатурацією та інактивацією ферментів.
Чутливість до рН середовища (зумовлена іонізацією активного центру, субстрату і кофакторів, що впливає на формування активного фермент-субстратного комплексу). Кожний фермент має свій рН-оптимум, тобто значення рН середовища, при якому його каталітична активність максимальна.
Оптимальні значення рН для:
-
пепсину 1,5–2,5;
трипсину 7,5-8,5;
хімозину 6,0;
кишкової мальтази 5,8-6,1;
амілази слини 6,8-7,0;
панкреатичної ліпази 7,0-8,5.
Активатори ферментів (підвищують активність ферментів) – кислоти НСІ і жовчні, катіони металів (Са2+, Mg2+, Со2+, Сu2+), аніони (СІ-).
Інгібітори (знижують активність ферментів), розрізняють:
оборотне гальмування (утворення слабкого комплексу, який має здатність розпадатися з вивільненням ферменту);
необоротне гальмування (міцний комплекс, поступове зв’язування і вилучення ферменту із середовища).

|
|
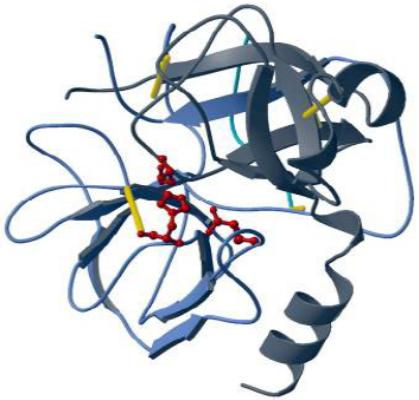
Активний центр ферменту хімотрипсину |
|


Застосування ферментів. Ферменти впливають на якість сировини (плоди, овочі, борошно, м’ясо) і готової продукції. Використовуються для визрівання м’яса, покращення його консистенції, смаку, аромату, для виготовлення м’ясних паштетів, покращення відокремлення м’яса від кісток, збільшення термінів зберігання м’ясних продуктів.
При виробництві пива і квасу використання ферментних препаратів дозволяє зменшувати витрати солоду. Ферменти прискорюють процес дозрівання сирів.
Негативна функція: наявність активних ферментів при зберіганні продуктів може спричинити зниження харчової цінності. Наприклад, у крах маловмісних продуктах активна амілаза спричиняє деградацію крохмалю, знижує хлібопекарські якості борошна; зменшення вмісту лізину (пшениця) при дії протеолітичних ферментів; при зберіганні на повітрі очищеної картоплі активна о-дифенолоксидаза каталізує процес утворення темного пігменту на поверхні картоплі.