- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Розчинність рідин у рідинах
Взаємна розчинність рідин мало залежить від тиску від тиску і помітно зростає лише в разі дуже високих тисків.
При взаємному розчиненні рідин спостерігаються:
необмежена розчинність (спирт – вода, вода – оцтова есенція);
практична нерозчинність (бензин – вода, ефір – вода, ртуть ‑ вода);
обмежена розчинність (фенол – вода, анілін – вода).
|
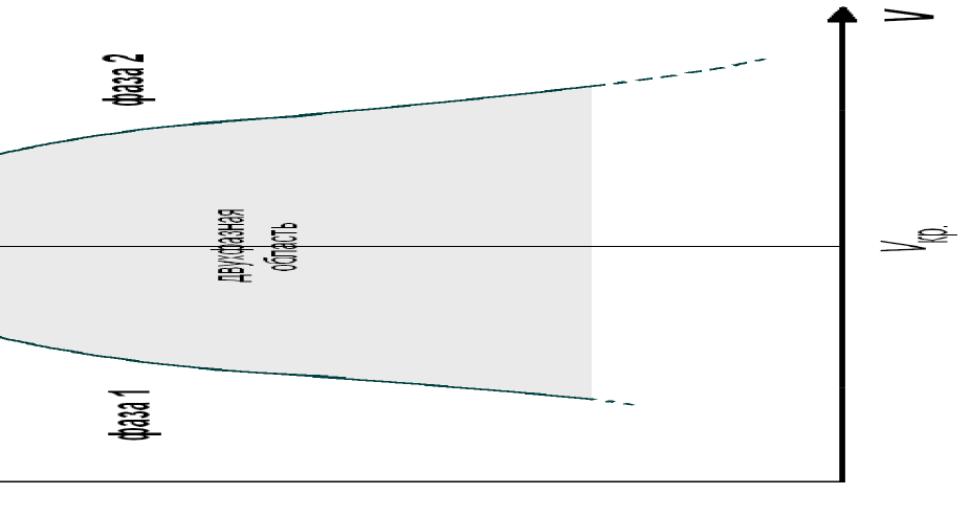
При змішуванні аніліну з водою утворюється двох шарова гетерогенна система: верхній шар – насичений розчин аніліну у воді; нижній шар – насичений розчин води в аніліні; При t=const, в системі – рівновага. При додаванні аніліну (води) збільшується об’єм анілінового (водного) шару, але С=const. Т↑, збільшується взаємна розчинність аніліну і води. В середині кривої – 2-х шарова система; Ззовні кривої – 1 шарова система; т.К – критична температура розчинення (температура, вище якої обидва компоненти суміші починають необмежено розчинятися один в одному); Наприклад, tкрит аніліну і води = 168оС. Застосування tкрит. розч: для проведення аналітичних визначень (відмінність маргарину від масла). Взаємна розчинність рідин з підвищенням температури збільшується доти. Доки буде досягнута температура, за якої обидві рідини змішується в будь-яких співвідношеннях. При додаванні третього компонента (йодид літію) анілін набуває здатності змішуватися з водою у будь-яких співвідношеннях. Пояснюється тим, що йодид літію однаково добре розчиняється у воді та аніліні. |
Крива розшарування аніліну і води (ілюструє взаємну розчинність рідин)
Екстракція – видалення одного або декількох компонентів із розчинів або твердих тіл за допомогою вибіркових розчинників ‑ екстрагентів. При екстракції з твердого тіла існують дві фази – рідка і тверда. При екстракції з рідини обидві фази – рідкі. Екстракція можлива лише при умові тісного контакту фаз між собою.
Метод екстракції базується на тому, що речовина, що екстрагується, розчиняється значно краще в органічному розчиннику, ніж у воді. На відміну від методів осадження екстрагування використовується тільки для відокремлення тієї чи іншої речовини, після чого визначення виконується іншим методом (фотометричним або об’ємним).
|
Визначення йоду. Водний розчин, що містить йодид-іони, обробляють відповідним окисником ‑ виділяється молекулярний йод, який потім відокремлюють за допомогою органічного розчинника (хлороформ СНСІ3, тетрахлорид вуглецю ССІ4, бензол С6Н6). Йод розчиняється в цих розчинниках краще, ніж у воді, легко видаляється. |
|
|
Дві рідини, що не змішуються використовують як селективні розчинники для компонентів суміші: суміш спочатку струшують з двома рідинами, що не змішуються, а потім відокремлюють одну рідину від іншої. Кожний шар декілька разів піддають екстракції з іншим розчинником. |
|
Умови проведення екстракції:
При постійній температурі.
При достатньому розведенні двох розчинів.
Розчинна речовина не повинна реагувати з розчинниками, не повинна дисоціювати в них.
Якщо продуктом є летка або термічна нестійка сполука, то випаровування розчинника повинно проводитися при низькій температурі. Наприклад, діетиловий ефір має температуру кипіння 34,50С і є підходящим розчинником для екстракції, проте його можна застосовувати тільки за умови, що в лабораторії відсутнє відкрите полум’я пальника (самоспалахування).
Повторні екстракції з використанням невеликих порцій розчинника більш ефективні, ніж однократна екстракція великого об’єму розчинника.
Краще використовувати важкі розчинники (хлороформ СНСІ3, тетрахлорид вуглецю ССІ4, бензол С6Н6) так як вони більш зручні у користуванні. Важкий розчинник легше відокремити від водної фази за допомогою ділильної лійки і цей розчинник менше випаровується тому, що більше часу знаходиться під шаром води.
Якщо речовина розчиняється одночасно у двох розчинниках, що перебувають у контакті, то при сталій температурі, незалежно від кількості розчиненої речовини, співвідношення концентрацій цієї речовини між двома розчинниками, що не змішуються, залишається сталим. (Закон розподілу, Нернст, 1890).
Кр
=
![]() ,
,
де Сорг – концентрація речовини в органічному розчиннику;
Сводн – концентрація речовини у водній фазі;
Кр – коефіцієнт розподілу
Висновок: чим краща розчинність речовини в органічному розчиннику, тим менша розчинність цієї речовини за даних умов у воді та більш повним буде відокремлення речовини.
Застосування закону розподілу:
рідинна хроматографія;
концентрування та очищення речовин методом екстракції.
Процес екстракції відбувається в результаті безперервного руху молекул розчинника і розчиненої речовини (з підвищенням температури рух молекул ‑ більш інтенсивний, тим менше часу потрібно для вирівнювання концентрації в усіх точках об’єму, що займає розчин).
Вилучення рідиною з пористого тіла речовин, розчинних в рідині, що заповняє пори, визначається двома взаємно протилежними процесами:
Процес забезпечує підведення речовини з глибинних шарів сировини до поверхні матеріалу.
Перехід цієї речовини з поверхні матеріалу у потік екстрагуючої рідини.
Інтенсивність переходу речовини з поверхні частинки у потік обумовлена різницею концентрацій речовини на поверхні частинки і в потоці рідини.
|
|
|
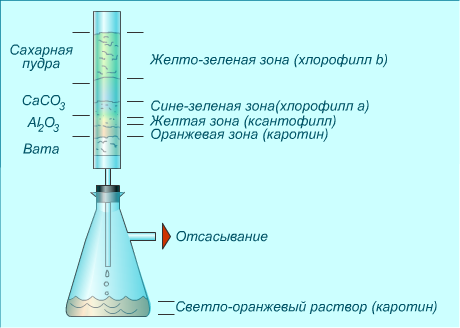
Колоночна хроматографія (внутрішня хроматограма) |
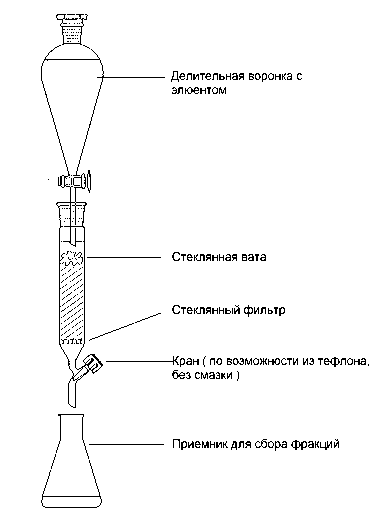
Елюентна хроматографія |
Екстрактор Сокслета |