
- •Лекція №1. Вступ
- •Лекція №2. Агрегатні стани речовини. Газоподібний стан речовини
- •Основні положення кінетичної теорії газів
- •Основні закони і рівняння ідеального газу
- •Реальні гази
- •Застосування рідких газів
- •Лекція №3. Рідкий стан речовини
- •Властивості рідин залежать:
- •Значення в’язкості
- •Характеристики рідкого стану речовини
- •Лекція №4. Твердий стан речовини
- •Процеси, що відбуваються з утворенням кристалічної решітки:
- •Лекція №5. Термодинаміка: основні поняття та закони
- •Застосування хімічної термодинаміки для:
- •Залежно від кількості фаз системи класифікують на:
- •Перетворення речовин бувають:
- •Способи передачі енергії системі або від неї:
- •І та іі закони термодинаміки і закон термодинаміки (Майєр, 1842; Гельмгольц, 1847)
- •І закон термодинаміки для ізохорних та ізобарних процесів
- •Спонтанні процеси. Ентропія
- •Іі закон термодинаміки (Клаузіус, 1850; Томсон, 1851)
- •Сутність теплових процесів у харчових виробництвах
- •Теплофізичні закономірності процесів варіння і смаження
- •16 Лютого 2005р. Вступив у дію Кіотський протокол. Основні зобов’язання щодо скорочення викидів у повітря шести парникових газів (со2, сн4, n2o, sf6, hfCs, pfCs) узяли на себе індустріальні країни:
- •Виробництво нових синтетичних холодоагентів (групи нfc) для пкхм.
- •Застосування природних холодоагентів (со2, с3н8, nh3).
- •Удосконалення екологічно чистої холодильної техніки, що базується на низько ефективних принципах одержання холоду.
- •Розробка нових принципів одержання холоду.
- •Виробництво холодильних машин Стірлінга помірного холоду.
- •Лекція №6. Термохімія: основні поняття та закони
- •Калорійність основних складових частин їжі та алкогольних напоїв
- •Закони термохімії
- •Лекція №7. Хімічна кінетика
- •Зміна швидкості реакції в часі
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •Теорія перехідного стану
- •Початковий стан (Реагенти) → Перехідний стан (Активований комплекс) → Кінцевий стан (Продукти)
- •Вплив каталізатора на швидкість реакції
- •Розвиток ланцюга.
- •Обрив ланцюга.
- •Лекція №8. Каталіз. Ферментативний каталіз
- •К аталіз
- •Каталіз
- •Гомогенний
- •Гетерогенний
- •Ферментативний
- •Загальні властивості:
- •Властивості ферментів
- •Лекція №9. Хімічна рівновага
- •Вплив температури на стан рівноваги
- •Вплив тиску на стан рівноваги
- •Застосування принципу Ле Шательє
- •Застосування принципу Ле Шательє
- •Лекція №10. Розчини. Розчинність газів, рідин і твердих речовин
- •Рідкі розчини
- •Розчинність рідин у рідинах
- •Застосування екстракції
- •Лекція №11. Властивості розбавлених розчинів неелектролітів
- •Роль дифузії
- •Залежність р насиченої пари від температури над чистим розчинником і над розчином
- •Вплив процесу заморожування на властивості харчових продуктів
- •Лекція №12. Властивості розбавлених розчинів електролітів
- •Визначення рНх за допомогою калібрувального графіка:
- •Індикаторний метод
- •Спосіб Міхаеліса
- •Вплив рН середовища на перебіг технологічних і ферментативних процесів
- •Буферні розчини
- •Лекція №13. Основи електрохімії
- •Абсолютна швидкість і рухливість іонів. Закон Кольрауша
- •Фізико-хімічні методи дослідження
- •Водневий електрод. Будова, принципи роботи, призначення
Роль дифузії

Приготування
других страв
(зменшення
переходу екстрактивних речовин у
розчин) – зменшення швидкості дифузії: мала
кількість рідини (1:1, припускання або
варіння парою); занурення
продукту в гарячу воду (поверхня швидко
нагрівається, але в центрі зберігається
початкова температура, виникає градієнт
температури, що викликає
термовологоперенесення разом з рідиною
відбувається переміщення розчинних
речовин у глибину продукту); краще
солити після закипання, на початку
варіння; варити
великим куском (збільшення розміру
частинок, зменшення поверхні стикання).
При виробництві кулінарної продукції процес розчинення є процесом, що супроводжує інші теплові процеси: адсорбцію, ректифікацію, варіння і смаження. Розчинення твердих тіл належить до процесів з фіксованою поверхнею фаз (наявна межа розділу рідина – тверде тіло).
При виготовленні їжі шляхом теплової обробки (варіння, смаження) важливим є масопередача в твердій фазі. В цих процесах крім масовіддачі від поверхні розділу фаз в рідину, пару, жир (фритюр) відбувається переміщення речовини в твердій фазі – масопровідність.
Процес масоперенесення в твердих тілах називають «стиснена дифузія», що пояснюється тим, що основа, скелет матеріалу, з якого складається продукт, здійснює опір дифузійному потоку або навіть перегороджує шлях дифузійному потоку.
Закон кінетики перенесення дифундуючої речовини: кількість речовини, що була переміщена в твердій фазі за рахунок масопровідності, пропорційна коефіцієнту масопровідності Dм, градієнту концентрації С, площі поверхні, перпендикулярної до напряму потоку речовини, і часу τ:
![]() ,
,
де Dм – коефіцієнт масопровідності, м2/с;
![]() – градієнт
концентрацій;
– градієнт
концентрацій;
dS – площа поверхні, що перпендикулярна напряму потоку речовини, м2;
τ – час, с.
У процесах варіння та смаження різні напрями поширення температури і концентрації речовини, що дифундує.
Температурний градієнт спрямований від периферії продукту до його центру, а градієнт концентрації – від центру до периферії. При цьому важка речовина, що дифундує, переміщується у напрямі градієнта температур, а дифундуюча легка речовина – у напрямі градієнта концентрацій. Таке явище називається термодифузією. При термодифузії процес масообміну може бути утруднений внаслідок протилежних напрямів руху, наприклад, вологи і парів при варінні, смаженні, висушування.
Рух вологи у напрямі градієнта температур (від периферії до центру) називається термовологопровідність.
Переміщення вологи у напрямі градієнта концентрації (від центру до периферії) називається волого провідність (дифузія води).
Якщо в колбу з водою внести розчинну речовину, то молекули цієї речовини будуть спричиняти тиск на стінки колби, який можна виявити за допомогою напівпроникних перетинок (мембран).
Напівпроникна мембрана – мембрана, що пропускає частинки розчинника, але не пропускає частинки розчиненої речовини.
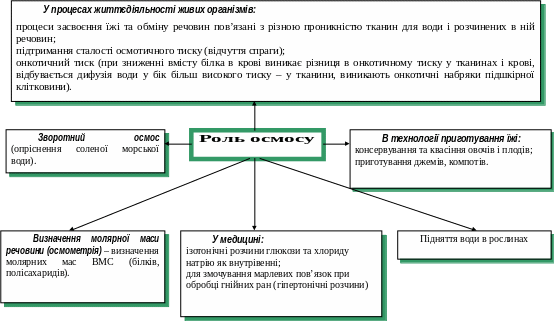
Осмос – довільний перехід розчинника через напівпроникну мембрану з розбавленого розчину (чистого розчинника) в концентрований розчин. Явище осмосу можна спостерігати за допомогою приладу ‑ осмометра.
Експеримент, який показує дію осмотичного тиску:
Початок експерименту |
Кінець експерименту |
||
1
3 |
1 – вода 2 – концентрований розчин цукру 3 ‑ напівпроникна мембрана Система, що утворилася – нерівноважна. Внаслідок цього в ній починається самочинний процес вирівнювання концентрацій: молекули розчинника (води) переходять у посудину 2 з розчином цукру. |
|
Внаслідок осмосу об’єм рідини у посудині 2 збільшиться і розчин почне підійматись. Для припинення осмосу необхідно ззовні до розчину прикласти тиск, що спричинятиме зворотний процес – вихід молекул розчинника з розчину. Цей тиск ‑ осмотичний тиск, πосм (рівноважний гідростатичний тиск) |
Осмотичний
тиск
(![]() осм.)
– тиск, який необхідно прикласти до
концентрованого розчину, щоб завадити
перенесенню розчинника через мембрану.
осм.)
– тиск, який необхідно прикласти до
концентрованого розчину, щоб завадити
перенесенню розчинника через мембрану.
Якщо Рзовнішній > осм. – зворотний осмос (одержання питної води з морської, очищення стічних вод). Причиною того, що на солонцюватих ґрунтах не всі рослини можуть проростати є зворотний (обернений) осмос.
Закон осмотичного тиску для розведених розчинів неелектролітів (Вант-Гофф, 1887): осмотичний тиск розчину дорівнює тому тиску, який чинила б розчинена речовина, якби вона при тій же температурі перебувала у газоподібному стані і займала б об’єм, рівний об’єму розчину (осмотичний тиск розчину прямо пропорційний його концентрації та температурі).
-
πосм =
 ,
,Якщо V=1л, то v =См
πосм.= СмRT
πосм. =
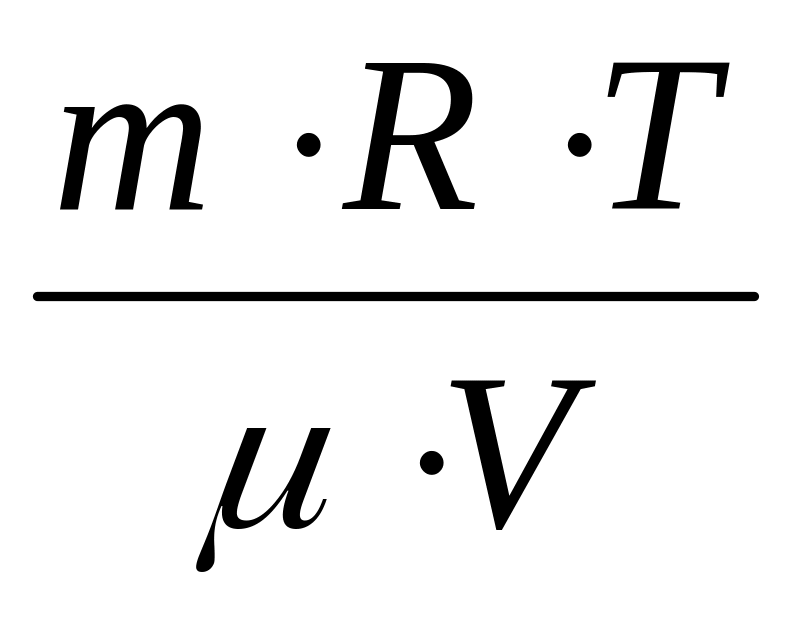
πосм. ‑ осмотичний тиск розчину (Па);
v ‑ кількість молей розчиненої речовини (моль);
V – об’єм розчину (м3);
R – універсальна газова стала 8,31 Дж/(моль∙ К);
Т – абсолютна температура (К);
См – молярна концентрація розчиненої речовини (моль/л);
m – маса розчиненої речовини (г);
μ ‑ молярна маса розчиненої речовини (г/моль).
Висновки:
Осмотичний тиск залежить від концентрації розчиненої речовини, а не від її хімічного складу.
Осмотичний тиск пропорційний різниці концентрацій у розчинах, що розділені мембраною (Т=const).
Осмотичний тиск пропорційний температурі (∆С=const).
За осмотичним тиском розчини класифікують на:
Гіпертонічні (πосм. зовнішнього розчину > Р у середині клітини): клітина знаходиться в концентрованому розчині, відбувається дифузія води з клітини в розчин, об’єм клітини зменшується (цитоплазма відокремлюється від оболонки), клітина зморщується.
Плазмоліз – явище зморщування клітини в гіпертонічному розчині внаслідок втрати води (при консервуванні овочів і плодів, приготуванні джемів, повидла, варення; в медицині як зовнішнє для змочування марлевих пов’язок, що вводять у гнійні рани).
Гіпотонічні (πосм. зовнішнього розчину < Р у середині клітини) – клітина знаходиться в розбавленому розчині, відбувається дифузія води в клітину із зовнішнього розчину, збільшується об’єм клітинного соку, клітина набухає.
Тургор – явище збільшення клітини в об’ємі, набухання в гіпотонічному розчині (при варінні компотів, гемоліз еритроцитів).
Ізотонічні (πосм. зовнішнього розчину = Р у середині клітини) – стан клітини не змінюється. У медицині вводять внутрівенно для компенсації втрат крові: πосм. 0,85%-ного NaCІ = 7,5 105Па; πосм.4,5-5%-ного C6Н12О6 = 7,5 105Па;
πосм. крові людини = 7,4 105 - 7,8 105 Па (t=37оС).
Властивості розчину завжди відрізняються від властивостей кожного з його компонентів. Ця зміна властивостей зумовлена:
характером взаємодії між компонентами;
зменшенням концентрації молекул кожної з речовин під час розподілу в ній молекул іншої речовини.
Вплив цих чинників зростає із збільшенням концентрації розчиненої речовини.
Тиск насиченої пари – це тиск, при якому (при певній температурі) досягається динамічна рівновага, що характеризується рівністю швидкостей випаровування та конденсації рідини.
Внаслідок випаровування над рідиною утворюється пара, тиск якої можна виміряти за допомогою манометра. Одночасно з ендотермічним процесом випаровування відбувається зворотний екзотермічний процес конденсації. За певних умов між цими процесами встановлюється рівновага (ΔG = 0). Рівноважний стан системи рідина – пара за певної температури характеризується тиском насиченої пари.
Якщо в рідині розчинена нелетка речовина, то вона утруднює випаровування розчинника (між молекулами розчинника і розчиненої речовини відбувається взаємодія) при цьому зменшується концентрація молекул розчинника в одиниці об’єму, зменшується кількість молекул, що випаровуються за одиницю часу з рідкої фази у пароподібну. Згідно з принципом Ле Шательє, починається процес, спрямований на зменшення зовнішнього впливу, тобто відбувається процес конденсації, що призводить до зниження тиску пари. Рівновага між рідиною і парою встановиться при нижчій концентрації пари, тобто при нижчому тиску пари.
Р насиченої пари розчинника над розчином < Р насиченої пари розчинника над чистим розчинником.
Зниження тиску пари над розчином буде більшим, чим вища концентрація розчиненої речовини у розчині.
І закон Рауля (1887): відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини.
І закон Рауля встановлює залежність тиску пари від концентрації розчину: тиск насиченої пари розчинника над розчином (Ра) прямо пропорційний молярній долі розчинника (Na).
Ра = Рао Na, де Рао – тиск пари над розчинником;
![]() ,
де Nв
– молярна доля розчиненої речовини;
,
де Nв
– молярна доля розчиненої речовини;
![]() ‑ відносне зниження тиску насиченої
пари розчинника над розчином.
‑ відносне зниження тиску насиченої
пари розчинника над розчином.
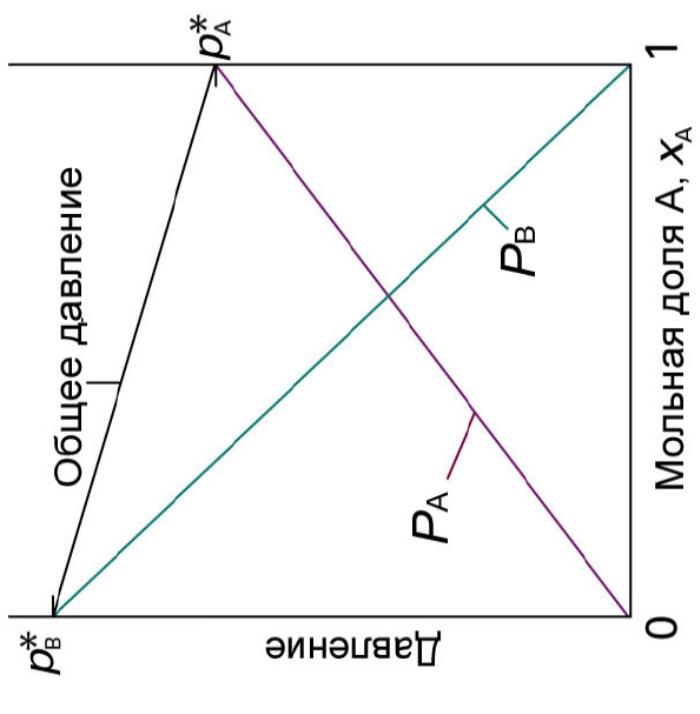
Закон Рауля точно виконується тільки для ідеальних розчинів.
Графічне зображення І закону Рауля (для ідеального розчину) Т=const
|
В- чистий компонент В (менш леткий) А – чистий компонент А (більш леткий) Сумарний тиск парів 2-х компонентного розчину (Р) та парціальний тиск пари більш леткого компоненту (Рао) збільшується зі збільшенням молярної долі більш леткого компоненту (Na) Одночасно парціальний тиск менш леткого компоненту розчину (Рв) зменшується. |
|
Відхилення від закону Рауля:
Позитивні Р пари експ. > Р пари обчисл. Бензол + етанол; вода + етанол Сили притягання А..В < Сили притягання А..А та В..В
Р рідина Т=const
В А
|
Негативні Р пари експерим. < Р пари обчисл. Метанол + вода; азотна кислота + вода
С
Р рідина Т=const
пара
В А |








 2
2





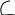


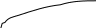

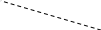
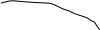 пара
пара

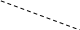


 или
притягання А..В <
Сили притягання А..А та В..В
или
притягання А..В <
Сили притягання А..А та В..В