
- •Билет № 1
- •1 Закон Ньютона:
- •Билет№2
- •Билет № 4
- •Билет № 3
- •Билет № 6
- •Билет №5
- •Билет № 8
- •Билет №21
- •Билет №16
- •Билет № 27
- •Билет № 18
- •Билет № 20
- •Билет № 10
- •Билет № 7
- •Билет № 23
- •Билет № 15
- •17. Билет № 24
- •18. Билет № 9
- •19. Билет № 13
- •20. Билет № 11
- •21. Билет № 26
- •22. Билет №17
- •23. Билет №19
- •24. Билет № 12
- •25. Билет №14
- •26. Билет №25
- •27. Билет №22
Билет № 7
Взаимодействие точечных зарядов. Закон Кулона
Электростатика – раздел электродинамики, посвященный изучению покоящихся электрически заряженных тел.
Основной закон электростатики был экспериментально установлен французским физиком Шарлем Кулоном в 1785 гс помощью крутильных весов и читается так: модуль силы взаимодействия двух точечных неподвижных электрических зарядов в вакууме прямо пропорционален произведению величин этих зарядов и обратно пропорционален квадрату расстояния между ними.
F
==![]() ,
где|q1|
и |q2|—
модули зарядов, r — расстояние между
ними, k — коэффициент пропорциональности,
в СИ k = 9·109
Н·м2/Кл2.
Физический смысл коэффициента k:
численно равен силе взаимодействия
единичных положительных зарядов на
расстоянии 1 м в вакууме.
,
где|q1|
и |q2|—
модули зарядов, r — расстояние между
ними, k — коэффициент пропорциональности,
в СИ k = 9·109
Н·м2/Кл2.
Физический смысл коэффициента k:
численно равен силе взаимодействия
единичных положительных зарядов на
расстоянии 1 м в вакууме.
Величина,
показывающая во сколько раз сила
взаимодействия зарядов в вакууме больше,
чем в среде, называется диэлектрической
проницаемостью среды
ε. Для среды с диэлектрической
проницаемостью ε (греческая «эпсилон»)
закон Кулона записывается следующим
образом: F
= =![]() .
.
Вместо
коэффициента k часто используется
коэффициент, называемый электрической
постоянной
ε0.
Электрическая постоянная связана с
коэффициентом k следующим образом k =
![]() и численно равна ε0=8,85·10-12
Кл2
/Н·м2.
и численно равна ε0=8,85·10-12
Кл2
/Н·м2.
С использованием электрической постоянной закон Кулона имеет вид:
F=![]() .
.
В

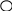

 заимодействие
неподвижных электрических зарядов
называют электростатическим, или
кулоновским, взаимодействием. Кулоновские
силы можно изобразить графически (рис.).
+
-
заимодействие
неподвижных электрических зарядов
называют электростатическим, или
кулоновским, взаимодействием. Кулоновские
силы можно изобразить графически (рис.).
+
-
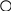
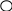


+ +
Кулоновская сила направлена вдоль прямой, соединяющей заряженные тела. Она является силой притяжения при разных знаках зарядов и силой отталкивания при одинаковых знаках.
В природе точечных зарядов не существует, но если расстояние между телами во много раз больше их размеров, то их можно рассматривать как материальные точки и применять закон Кулона. Также можно применять закон Кулона для геометрически симметричных тел (например, сфер), в этом случае r - расстояние между геометрическими центрами (центры сфер).
Билет № 23
Электрический ток в электролитах. Законы электролиза. Применение электролиза
Жидкости, как и твердые тела, могут быть диэлектриками, проводниками и полупроводниками. К числу диэлектриков относится дистиллированная вода, к проводникам – растворы и расплавы электролитов: кислот, щелочей и солей. Жидкими полупроводниками являются расплавленный селен, расплавы сульфитов и др..
Электролиты состоят из молекул, которые при растворении в воде распадаются ионы, способные к свободному перемещению.
Пример: CuSO4 →Cu2++ SO42-
катион анион
Распад молекул вещества на ионы под действием молекул растворителя называется электролитической диссоциацией. Процесс, обратный диссоциации – рекомбинация. Носителями тока в электролитах являются положительно и отрицательно заряженные ионы. Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду – аноду, а положительные – к отрицательному – катоду. В результате установится электрический ток. Таким образом, электрический ток в жидкостях – это упорядоченное движение положительных ионов к катоду, а отрицательных - к аноду.
Жидкости могут обладать и электронной проводимостью – например, жидкие металлы.
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролита. На аноде отрицательно заряженные ионы отдают свои лишние электроны, а на катоде положительные ионы получают недостающие электроны. Процесс выделения на электроде вещества, входящего в состав электролита, называется электролизом(«лио» - разделяю).
Электролиз широко применяется на практике:
покрытие поверхности металла тонким слоем другого металла (никелирование, хромирование, омеднение и т.п.) – защита от коррозии;
изготовление металлических копий рельефной поверхности;
очистка металлов от примесей;
получение газов промышленным способом;
электрополировка поверхностей.
Закон электролиза впервые был установлен экспериментально Фарадеем и носит название закона электролиза Фарадея: масса вещества, выделившегося на электроде при прохождении электрического тока, прямо пропорциональна заряду q, прошедшему через электролит.
m
= kq,
где k
– коэффициент пропорциональности между
массой вещества и зарядом, называемый
электрохимическим
эквивалентом
вещества. k=
![]() ,
где Nа
– постоянная Авогадро, М – молярная
масса вещества, n
– валентность вещества, а отношение
,
где Nа
– постоянная Авогадро, М – молярная
масса вещества, n
– валентность вещества, а отношение
![]() называется химическим
эквивалентом вещества.
называется химическим
эквивалентом вещества.
Из формулы закона электролиза видно, что коэффициент k численно равен массе вещества, выделившегося на электродах при переносе ионами заряда, равного 1 Кл. Таким образом, единица измерения 1кг/Кл. Значение k для различных веществ можно найти в таблице.
