
- •Функціонування кліток
- •Клітинна організація
- •1.2.9. Эукариотические клітини мають скелет
- •1.2.12. Клітини эукариот містять значно більше днк, чим це необхідно
- •1.2.13. Генетичний матеріал эукариотических клітин упакований дуже складно
- •1.3. Від клітин - до багатоклітинних організмів
- •1.3.1. Поодинокі клітини здатні об'єднуватися і утворювати колонії
- •1.3.2. Клітини вищих організмів стають спеціалізованими і взаємозалежними
- •1.3.4. Епітеліальні шари клітин оточують захищене від зовнішніх дій внутрішнє середовище організму
- •1.3.11. Нервові клітини дозволяють організму швидко адаптуватися в умовах [, що змінюються, 17,18]
- •1.3.12. Зв'язки між нервовими клітинами визначають тип поведінки
- •2.1.6. Нуклеотиди субодиниці днк і рнк [5]
- •2.2.3. Хімічна енергія переходить від рослин до тварин
- •2.2.4. Клітини отримують енергію в результаті окислення біологічних молекул [9]
- •2.2.5. Розпад органічних молекул здійснюється в результаті послідовних ферментативних реакцій [10]
- •Тема9. Методи виділення та фракціонування клітин.
- •4.3. Розподіл клітин і їх культивування [18]
- •4.3.1. Клітини можна виділити з тканин і розділити на різні типи [19]
- •4.3.3. За допомогою середовищ певного хімічного складу можна ідентифікувати специфічні чинники зростання [21]
- •5. Основні генетичні механізми
- •5.1.10. Рамка прочитування матриці встановлюється у момент ініціації синтезу поліпептидного ланцюга [6, 9].
- •5.1.13. Загальна швидкість білкового синтезу регулюється у эукариот чинниками ініціації [12]
5.1.10. Рамка прочитування матриці встановлюється у момент ініціації синтезу поліпептидного ланцюга [6, 9].
Теоретично нуклеотидная послідовність РНК може бути декодована за допомогою будь-якої з трьох різних рамок прочитування причому поліпептидні ланцюги, що утворюються, будуть в цих трьох випадках абсолютно різними (див. мал. 3-14). Як насправді піде прочитування, визначається у той момент, коли рибосома з'єднується з молекулою мРНК. У фазі ініціації білкового синтезу зборка рибосоми з двох її субчасток на молекулі мРНК відбувається в тому самому місці, з якого повинен початися синтез поліпептидного ланцюгаПроцес ініціації складний. Він складається з ряду етапів, що каталізуються білками, які носять назву чинників ініціації (1Р); багато хто з них самі складається з декількох поліпептидних ланцюгів. Через цю складність ініціації багато її деталей досі не цілком з'ясовано. Відомо, проте, що зборка кожної рибосоми на ланцюзі мРНК проходить в два етапи: спочатку навантажена чинниками ініціації мала субодиниця рибосоми знаходить на мРНК старт-кодон, а потім до неї приєднується велика субодиниця.
Рис. 5-29. Более подробное изображение
первого этапа фазы элонгации белкового
синтеза, позволяющее видеть, как
отбирается на рибосоме правильная тРНК.
На начальной стадии связывания молекула
аминоацил-тРНК с присоединенным фактором
элонгации временно спаривается с кодоном
в А-участке. Спаривание служит сигналом
для гидролиза СТР, вызываемого фактором
элонгации, благодаря этому фактор
элонгации получает возможность отделиться
от молекулы аминоацил-тРНК,
которая теперь стоит точно на своем
месте в А-участке и может сыграть
предназначенную ей роль в элонгации
полипептидной цепи (см. рис. 5-20). Только
тРНК с правильным антикодоном остаются
спаренными с мРНК достаточно 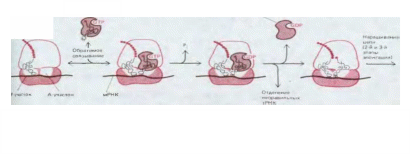 долго
для того, чтобы участвовать в элонгации
цепи. Фактор элонгации (имеющий белковую
природу) у прокариот обозначается ЕБ-Ти
(ФЭ-Ти), а у эукариот-ЕР-1 (ФЭ-1).
долго
для того, чтобы участвовать в элонгации
цепи. Фактор элонгации (имеющий белковую
природу) у прокариот обозначается ЕБ-Ти
(ФЭ-Ти), а у эукариот-ЕР-1 (ФЭ-1).
5.1.13. Загальна швидкість білкового синтезу регулюється у эукариот чинниками ініціації [12]
Відомо (детальніше про цей см гл. 13), що клітини багатоклітинного організму розмножуються тільки тоді, коли вони знаходяться у відповідному оточенні і на них впливають специфічні чинники зростання. Механізм дії цих чинників зростання не зовсім ясний, але поза сумнівом, що одним з головних ефектів має бути збільшення загальної швидкості білкового синтезу (см разд. 13.3.4). Чим визначається ця швидкість? Прямі дослідження на тканинах украй складні, але якщо клітини в культурі не отримують достатньої кількості поживних речовин, то різко знижується швидкість ініціації синтезу поліпептидних ланцюгів, причому можна показати, що це гальмування обумовлюється інактивацією одного з чинників ініціації білкового синтезу, а саме 1Т- 2. Показано, що принаймні у одного типу клітин (у незрілих еритроцитах) активність ТР- 2 знижується контрольованим чином в результаті фосфорилювання однієї з трьох його білкових субодиниць. Можна припустити тому, що швидкість білкового синтезу у эукариот регулюється до певної міри специфічними протеинкиназами, які у своїй активній формі гальмують його ініціацію. Можливо, що дія чинників зростання здійснюється за посередництва якихось регуляторних речовин, які інактивують ці протеинкиназы або нейтралізують їх ефект.У эукариот чинники ініціації, необхідні для синтезу білку, численніші і складніші, ніж у прокариот, хоча і у тих, і у інших вони виконують одні і ті ж основні функції. Численні додаткові компоненти, можливо, є регуляторними білками, що реагують на різні чинники зростання і координуюче зростання і розмноження клітин в багатоклітинних організмах. У бактерій немає потреби в такій регуляції: вони ростуть з тією
швидкістю, яку допускає наявність в середовищі поживних речовин.5-95.1.14. Точність білкового синтезу забезпечується двома різними механізмами [13]Судити про частоту помилок в процесі білкового синтезу можна, визначивши, як часто включається в цей білок яка-небудь амінокислота, в нормі в нім відсутня. Спостереження показують, що в середньому на кожні 104 амінокислот включається одна "неправильна" амінокислота, і, значить, тільки одна помилка доводиться на кожні 25 білків, що синтезуються, середнього розміру (400 амінокислот). Точність процесу декодування залежить від надійності двох адапторных механізмів, про які ми вже говорили вище, : від зв'язування кожної амінокислоти з відповідною молекулою гРНК і від спаровування кодонів в мРНК з антикодонами тРНК (див. мал. 5-12). Недивно, що в ході еволюції в клітинах виникли механізми, які забезпечують зниження числа помилок на цих двох ключових етапах білкового синтезуДва механізми, діючі на цих двох етапах, здійснено різні; кожен з них відбиває стратегію, використовувану клітиною в інших процесах. Обидва механізми зв'язано, проте, з витратою вільної енергії, оскільки, як вже відзначалося в гл. 2 (см разд. 2.2). за всяке зростання впорядкованості доводиться платити. Надійність зв'язування амінокислоти з тРНК забезпечується порівняно простим механізмом. У багатьох аминоацил-тРНК-синтетаз є два окремі активні центри: один, відповідальний за реакцію, в результаті якої тРНК навантажується амінокислотою (мал. 5-10), і інший, що розпізнає неправильну амінокислоту, що приєдналася до тРНК, і що видаляє її шляхом гідролізу. Подібний процес корекції обходиться дорого, оскільки працювати ефективно він може лише у тому випадку, якщо видалятиме заразом і досить значне число амінокислот, що правильно приєдналися. Аналогічний дорогий двохетапний процес корекції використовується і в реплікації ДНК (см разд. 5.3.3).Точність спаровування до до на з антикодоном забезпечується тоншим механізмом "кінетичної корекції". Раніше ми обмежувалися лише спрощеним описом цього спаровування. Насправді, після того, як молекули тРНК приєднають відповідну амінокислоту, вони утворюють комплекс з особливим білком, гак званим чинником элонгации (ФЭ, EF), який міцно зв'язується з аминоацильным кінцем молекули тРНК і з молекулою GTP. Саме цей комплекс, а не вільна молекула тРНК злучається з належним кодоном в молекулі мРНК. Пов'язаний таким чином чинник элонгации забезпечує можливість правильного спаровування антикодону з кодоном, але при цьому перешкоджає включенню цієї амінокислоти в розтушую поліпептидний ланцюг Проте початкове пізнавання кодону служить для чинника элонгации сигналом до гідролізу пов'язаного з ним GTP (до GDP і неорганічного фосфату), після чого сам чинник відділяється від рибосоми без своєї тРНК, так що синтез білку може продовжитися. З мал. 5-29 видно, що завдяки чиннику элонгации У білковому синтезі важливу роль грає також велике число різних білків, пов'язаних з рРНК рибосом. Надзвичайна складність процесу, в який залучено стільки компонентів, змусила багатьох біологів переконатися в тому, що коли-небудь будуть зрозумілі шляхи його еволюції. Проте недавнє відкриття - виявлення молекул РНК, здатних діяти як ферменти (см разд. 3.2. 11), - дозволило по-новому поглянути на цей предмет. Як вже відзначалося в гл. 1. у перших біологічних реакціях каталізаторами могли служити не білкові молекули, а молекули РНК. Можливо, що на ранніх етапах, в перших клітинах, молекули тРНК самі, без участі аминоацилт РНК-синтетаз, формували каталітичні поверхні, які дозволяли їм зв'язувати і активувати амінокислоти. Не виключено, що у той час роль цілої "рибосоми" виконували молекули рРНК, що згорталися таким чином, що виникала складна система поверхонь, що забезпечує і спрямоване спаровування тРНК з кодонами мРНК, і каталіз полімеризації пов'язаних з тРНК амінокислот (див. мал. 1-7). В ході еволюції до цього апарату могли приєднуватися окремі білки, кожен з яких робив даний процес надійнішим і ефективнішим. Висока доля РНК в сучасних рибосомах, ймовірно, збереглася від тих дуже ранніх етапів еволюції, коли білки ще не займали головного місця в біологічному каталізі.
Висновок:Для того, щоб міг початися синтез якого-небудь певного білку, повинна спочатку утворитися відповідна мРНК (шляхом транскрипції ДНК). До цієї мРНК, до її старт-кодону, приєднується мала рибосомна субодиниця; дізнається старт-кодон особлива инициаторная тРНК. Приєднання великої субодиниці завершує зборку рибосоми, Далі слідує фаза элонгации білкового синтезу. Під час цієї фази різні аминоацил-тРНК, навантажені кожна своєю амінокислотою, по черзі зв'язуються з відповідним кодоном на мРНК шляхом спаровування його підстав з підставами антикодону тРНК. Кожна чергова амінокислота приєднується до карбоксильного кінця зростаючого поліпептиду в результаті циклічного процесу, що складається з трьох послідовних етапів, : зв'язування аминоацил-тРНК. утворення пептидного зв'язку і транслокації рибосоми. Рибосома переміщається уздовж молекули мРНК у напрямі 5' ^ 3 'від одного кодону до іншого до тих пір, поки не буде досягнутий якій-небудь з трьох стоп-кодонів. До цього стоп-кодону приєднується потім чинник звільнення, що викликає відділення завершеного поліпептиду від рибосоми.Рибосомам прокариот і эукариот властива висока міра гомології, незважаючи на досить істотні відмінності в числі і в розмірах обох видів компонентів - рРНК і білків. Переважаюча роль рРНК в структурі і функції рибосом, можливо, відбиває походження білкового синтезу, на ранніх етапах що еволюціонувало в середовищі, де каталіз здійснюється за допомогою РНК.
ЛЕКЦІЯ 12.5.2. Механізми репарації ДНК [16]
Тоді як шанси на довготривале існування виду можуть зростати внаслідок змін в його генетичній конституції, виживання в кожен конкретний момент вимагає безумовного збереження генетичної інформації. Для підтримки такої постійності генетичного матеріалу потрібно не лише надзвичайно точний механізм копіювання нуклеотидных послідовностей ДНК в кожному новому клітинному поколінні, але і механізм виправлення ушкоджень, що спонтанно виникають в ДНК Велика частина таких ушкоджень носить тимчасовий характер, оскільки вони дійсно усуваються за допомогою особливого механізму, який носить назву репарації ДНК. Якщо цей механізм, що забезпечує клітинну постійність, не спрацьовує, зміна закріплюється. Подібну зміну називають мутацією. Він може виявитися згубним для організму, якщо торкнеться якої-небудь життєво важливої послідовності ДНК.Перш ніж говорити про механізми репарації ДНК, торкнемося коротко питання про те, як відтворюються нуклеотидные послідовності ДНК з покоління в покоління.5.2.1. Висока надійність збереження нуклеотидных послідовностей ДНК [17]Частоту змін в нуклеотидных послідовностях ДНК (частота виникнення мутацій або швидкість мутації) вдається визначати тільки непрямим шляхом. Один із способів полягає в порівнянні амінокислотних послідовностей одного і того ж білку у декількох біологічних видів. Долю амінокислот, які виявляться при цьому різними, зіставляють потім з числом років, що пройшли з тієї миті, як два даних виду дивергировали в процесі еволюції від загального предка (цей термін оцінюють на основі даних палеонтологічного літопису) Виходячи з цього можна вичислити середнє число років, необхідне для того, щоб яка-небудь стійка зміна торкнулася однієї з амінокислот цього білку. Оскільки кожна така зміна відбиває, як правило, поодиноку зміну в нуклеотидной послідовності гена, що кодує цей білок, ми тим самим дізнаємося і середнє число років, що вимагається для виникнення в цьому гені однієї стабільної мутації.Такого роду визначення дають нам завжди сильно занижені оцінки швидкості мутації, оскільки велика частина мутацій порушує функцію цього білку і зникає з популяції під тиском відбору. Є, проте, серед вивчених білків одне сімейство, для якого це заперечення майже не має сили Це так звані фібринопептиди - фрагменти з 20 амінокислотних залишків, що відщепляються від білку фібриногену, коли він при згортанні крові, активуючись, перетворюється на фібрин. Фібринопептиди не виконують ніякої прямої функції, а тому вони толерантні майже до усіх можливих амінокислотних замін. Аналіз фібринопептидів показує, що білок середнього розміру, що складається з 400 амінокислот, змінюється випадковим чином в результаті однієї амінокислотної заміни приблизно кожні 200000 років. Пізніше з розробкою методів визначення нуклеотидных послідовностей ДНК (см разд. 4,6.6), з'явилася можливість виявити міру схожості нуклеотидных послідовностей ДНК в гомологічних некодируюших ділянках генома у різних видів ссавців. Отримані таким шляхом оцінки частоти мутацій прекрасно узгоджуються з тими, які дає аналіз фибронопептидов.5.2.2. Швидкість мутації в зростаючих клітинах співпадає з оцінками, отриманими на основі еволюційнихдосліджень [18]Швидкість мутації можна оцінити прямим способом, підраховуючи кількість генетичних змін, клітин, що спонтанно виникають у великій популяції, за відносно короткий проміжок часу. Для цього визначають частоту виникнення нових мутантів в дуже великих популяціях тварин (наприклад, у плодової мушки або в колоніях мишей), або проводять скринінг з метою виявити зміни в активності певних ферментів у клітин, зростаючих в культурі. Хоча такі оцінки носять лише наближений характер, вони в обох випадках узгоджуються з уявленням про те, що при реплікації на 109 пар підстав (в середньому) відбувається одна помилка, т. е. одна заміна пари підстав. Отже, для того, щоб в гені, що кодує середній по розмірах білок і що налічує приблизно 103 кодуючих пар підстав, могла виникнути мутація, потрібно близько 106 клітинних поколінь. Ця величина досить задовільно узгоджується з оцінкою, отриманою на основі еволюційних досліджень, згідно якої мутація в середньому гені зародкової лінії виникає один раз кожні 200000 років.5.2.3. Більшість мутацій, що змінюють білки, шкідливі і элиминируются природним відбором [17].
Якщо число відмінностей в амінокислотному складі одного і того ж білку у двох різних біологічних видів представити як функцію часу, що пройшов з моменту дивергенції цих видів, то ми отримаємо пряму лінію. Іншими словами, чим довше період, що пройшов з моменту дивергенції, тим більше число таких відмінностей. Для зручності нахил прямої може бути охарактеризований через одиницю еволюційного часу для цього білку (середній час, необхідне для того, щоб в послідовності з 100 амінокислот з'явилася одна амінокислотна заміна). Зробивши це для різних білків, ми переконаємося в тому, що кожен з них характеризується своєю особливою швидкістю еволюції (мал. 5-30). Оскільки усі пари підстав в ДНК схильні до випадкових змін в рівній мірі, ці різні швидкості відбивають відмінності у вірогідності для тих або інших організмів з випадковою.Оскільки мутації здебільшого шкідливі, жоден біологічний вид не може дозволити собі швидко накопичувати їх у своїх статевих клітинах. Пізніше ми обговоримо (см разд. 9.1.3), чому при спостережуваній частоті мутацій, хоча вона і невисока, число необхідних білків, які можуть бути закодовані в клітинах зародкового шляху будь-якого організму, не повинне перевищувати 60000 Якби частота мутацій була в 10 разів вище, через ту ж причину організм повинен був би задовольнятися 6000 білків. В цьому випадку еволюція, очевидно, не пішла б далі за організми, що стоять по мірі складності приблизно на рівні плодової мушки.
тже, збереження виду вимагає, щоб статеві клітини організмів були захищені від швидких генетичних змін, але збереження кожного конкретного індивідуума вимагає такого ж захисту і для усіх інших клітин багатоклітинного організму (соматичних клітин). Нуклеотидные заміни в соматичних клітинах можуть сприяти природному відбору на користь тих або інших краще пристосованих клітин і привести до їх неконтрольованого розмноження, т. е. розвитку раку, на долю якого в Західній півкулі доводиться близько 20% усіх передчасних смертей. Переконливі дані підтверджують, що загибель людей в даному випадку викликана головним чином накопиченням змін в нуклеотидных послідовностях ДНК соматичних клітин. Десятиразове підвищення частоти мутацій привело б, ймовірно, до катастрофічного зростання ракових захворювань внаслідок того, що частіше виникали б різні варіантні форми соматичних клітин. Таким чином і збереження того або іншого виду з його 60000 білків (стабільність статевих клітин), і запобігання раку, що виникає як наслідок мутацій в соматичних клітинах (стабільність соматичних клітин), залежать у эукариот від надзвичайно високої надійності збереження нуклеотидных послідовностей ДНК.5.2.5. Низькі частоти мутацій означають, що споріднені організми побудовані практично з одних і тих жебілків [17]Людина як рід, відмінний від великих людиноподібних мавп, виник всього декілька мільйонів років назад. У кожному гені, отже, могло статися за цей час лише порівняно небагато нуклеотидных замін, причому більшість з них природний відбір повинен був элиминировать. Порівняння людини і мавп показує, наприклад, що їх цитохроми з розрізняються лише по 1% амінокислотних залишків, а їх гемоглобіни - приблизно по 4%. Значна частина нашої генетичної спадщини сформувалася, поза сумнівом, задовго до появи Homo sapiens, в процесі еволюції ссавців (що почалася приблизно 3 - Ю8 років назад) і навіть раніше.Спосіб, яким в процесі репарації здійснюється видалення пошкодженої ділянки, залежить від типу ушкодження. Наприклад, при апуринизапии (найбільш ушкодженні ДНК, що часто зустрічається) один із залишків дезоксирибози втрачає основи (див. мал. 5-31), що раніше знаходилася при нім. Фермент АП-эндонуклеаза швидко розпізнає цей залишок дезоксирибози і розриває в цій зміненій ділянці ланцюга фосфодиэфирную зв'язок. Після цього пошкоджений нуклеотид віддаляється і правильна послідовність нуклеотидів відновлюється за допомогою механізму, представленого на мал. 5-33Інший, близький до цього, шлях репарації пов'язаний за участю особливого набору ферментів, званих ДНК-гликозилазами. Кожен з цих ферментів дізнається який-небудь один певний тип змінених підстав в ДНК і каталізує гідролітичне відщеплення такої основи. Існує, як вважають, не менше шести типів ферментів, що входять до цієї групи. Серед них є ферменти, що видаляють дезамінований цитозин, дезамінований аденин, алкіловані підстави різних типів, підстави з розімкненим кільцем і підстави, в яких подвійний вуглець-вуглецевий зв'язок замінений простій. Загальний для усіх випадків механізм проілюстрований на мал. 5-36 конкретним прикладом. Тут представлено видалення дезамінованого цитозина. Спочатку фермент урацил-ДНК-гликозилаза видаляє змінену основу (урапил). Дезоксирибозу. що втратила основу, що була при ній, дізнається інший Фермент-АП-эндонуклеаза. Оскільки це той самий фермент, який дізнається апуринизированные ділянки ДНК, відновлення правильної послідовності йде далі тим же шляхом, який ми вже описали для випадку апуринизации. У результаті U, що виник внаслідок випадкового дезамінування, знову заміщається на З Важливість процесу видалення з ДНК випадково дезамінованих підстав вдалося продемонструвати безпосередньо на конкретних прикладах. Один з них торкається бактерійних штамів, у яких внаслідок мутації відсутній фермент урацил-ДНК-гликозилаза. З'ясувалося, що у таких мутантів частота спонтанних замін C - G на Т-А (у нормі низька) зростає приблизно в 20 разів.У клітинах є особливий шлях для видалення майже будь-якого типу ушкодження в ДНК, що зачіпає дуже велику її ділянку. Такі великі ушкодження виникають, наприклад, при ковалентних взаимо-действиях між підставами ДНК і об'ємистими вуглеводнями, зокрема бензпиреном, що має канцерогенні властивості. До них же відносяться і різні пиримидиновые димери (Т-Т, Т-С і С-С), що виникають під дією сонячних променів (див. мал. 5-32). У подібних випадках великий мультиферментный комплекс дізнається не яку-небудь одну специфічну зміну основи, а велике ушкодження подвійної спіралі ДНК. Фосфодиэфирные зв'язку пошкодженого ланцюга по обидві сторони від ушкодження розриваються і змінена ділянка віддаляється увесь цілком. Після цього відновлення нормальної послідовності відбувається як завжди.Про роль репараційних процесів свідчить той факт, що клітини витрачають велику частину своїх ресурсів на виробництво репараційних ферментів. Великі дослідження, проведені на дріжджах, виявили у них понад 50 різних генів, що кодують гакие ферменти. Не менш складні шляхи репарації ДНК у людини. З'ясувалося, що у хворих з пігментною ксеродермой порушений процес репарації великих ушкоджень, в якому, як показує генетичний аналіз, бере участь не менше 7 різних генних продуктів. У таких хворих в клітинах накопичуються пиримидиновые 5.2.9. Клітини синтезують репарирующие ферменти у відповідь на ушкодження ДНК [23]В процесі еволюції клітини виробили багато різних механізмів, що забезпечують їх виживання у цьому світі, повному всіляких небезпек. Часто яка-небудь різка дія середовища активує цілий набір саме тих генів, продукти яких здатні захистити клітини від цієї дії. Усім клітинам властивий, наприклад, такий механізм, як реакція на тепловий шок; її можна спостерігати в клітинах, що піддалися дії надмірно високих температур. При цьому індукується синтез особливих "шокових" білків; частина з них, мабуть, допомагає стабілізувати і репарировать інші клітинні білки, частково денатуровані тепловим шоком.У багатьох клітинах існують також механізми, що дають їм можливість синтезувати ферменти для репарації ДНК, так би мовити, в аварійних ситуаціях, у відповідь на серйозні ушкодження ДНК Серед прикладів такого роду краще всього вивчений SOS -ответ (SOS -репарация) у Е. з/р. У цієї бактерії будь-яке порушення реплікації ДНК, викликане її ушкодженням, веде до появи сигналу (таким сигналом служить, мабуть, надлишок одноцепочечной ДНК), що посилює транскрипцію більш ніж 15 різних генів, багато хто з яких кодує білки, що беруть участь в репарації ДНК. Сигнал активує у Е. coli білок (см разд. 5.4.4), який потім руйнує інший білок - негативного регулювальника активності генів (репрессор). Дія цього репрессора полягає в пригніченні у Е. coli транскрипції усього набору генів, що беруть участь в SOS -ответе. Вивчення бактерійних мутантів з різними порушеннями SOS -репарации показало, що новосинтезовані білки обумовлюють два ефекти. По-перше, їх індукція підвищує виживаність клітин : якщо мутанти, у яких синтез таких ферментів порушений, піддати дії тих або інших агентів, що викликають ушкодження ДНК (наприклад, ультрафіолетових променів), то відсоток загиблих клітин виявиться незвично високим. По-друге, деякі з індукованих білків викликають тимчасове підвищення частоти мутацій, внаслідок чого генетична мінливість бактерійної популяції зростає. Вигода тут, мабуть, полягає в тому, щоВисновок:Судити про надійність збереження нуклеотидных послідовностей ДНК у вищих эукариот можна, виходячи з швидкості зміни амінокислотних послеОователъностей другорядних білків і нуклеотибных послебовательностей ДНК упродовж еволюційного часу. Ця надійність така велика, що за рік в геномі ссавця, що налічує 3 - 10я пару підстав, в середньому відбувається усього лише 10-20 замін підстав, що зачіпають клітини зародкової лінії. В той же час в геномі такого розміру із-за неминучих процесів хімічного розпаду щодня ушкоджуються тисячі нуклеотидів ДНК. Генетична інформація може надійно зберігатися в нуклеотидных послідовностях ДНК лише тому, що широкий набір різних репарирующих ферментів здійснює безперервний "огляд" ДНК і убаляет з неї пошкоджені нуклеотиди.Процес репарації ДНК заснований на тому, що генетична інформація представлена в цій молекулі двома копіями - по одній в кожному з двох ланцюгів подвійної спіралі ДНК. Завдяки цьому випадкове ушкодження в одному з ланцюгів може бути видалене репарирующим ферментом і ця ділянка ланцюга ре синтезована у своєму нормальному виді за рахунок інформації що міститься в неушкодженому ланцюзі.5.3. Механізми реплікації ДНК [24]Живі організми повинні не лише підтримувати цілісність нуклеотидных послідовностей ДНК шляхом її репарації, але ще і дуже точно відтворювати свою ДНК перед кожним клітинним діленням. При реплікації ДНК швидкість полімеризації коливається в межах від 500 нуклеотидів в 1 з у бактерій приблизні до 50 нуклеотидів у ссавців. Ясно, що ферменти, що каталізують процес реплікації, повинні працювати і точно, і швидко. Швидкість і точність досягаються за допомогою особливого мультиферментного комплексу, що спрямовує процес реплікації. Цей комплекс, що складається з декількох різних білків, є складним і досконалим "апаратом реплікації".
5.3.1. Реплікація ДНК, як і її репарація, заснована на спаровуванні комплементу підстав [25]Матрична активність ДНК проявляється в гом, що її нуклеотидная послідовність копіюється (цілком або частково) шляхом спаровування комплементу підстав (А з Т або Із з С) у вигляді послідовності комплементу нуклеотидів ДНК або РНК. Цей процес припускає пізнавання кожного нуклеотиду в ДНК вільним (неполімеризованим) нуклеотидом комплементу і обов'язковий розподіл (хоч би на якийсь час) двох ланцюгів ДНК, з тим щоб в кожній основі групи, що грають роль донорів і акцепторів при утворенні водневих зв'язків, виявилися доступними для спаровування комплементу. Поодинокі нуклеотиди, що таким чином поступають, вишиковуються в певному порядку уздовж матричного ланцюга ДНК для ферментативної полімеризації, продуктом якої є новий полинуклеотидная ланцюг. У 1957 р. був відкритий перший фермент, що каталізує процес полімеризації нуклеотидів; він був названий ДНК-полимеразой. Було показано, що субстратами ДНК-полимеразы служать дезоксирибонуклеозидтрифосфаты. що полімеризуються на одно-цепочечной ДНК-матриці (двоступінчатий механізм цієї полімеризації представлений на мал. 5-34 у зв'язку з обговоренням процесу репарації ДНК). Пізніше була виділена і РНК-полимераза, для якої субстратами служать рибонуклеозидтрифосфаты.
Під час реплікації ДНК кожен з двох її старих ланцюгів служить матрицею для утворення нового ланцюга Тому надзвичайно довга нуклеотидная послідовність клітинної ДНК реплицируется, як це прийнято називати, "полуконсервативно" і кожна з двох дочірніх клітин отримує при клітинному діленні нову подвійну спіраль ДНК, що складається з однієї старої і одному новому ланцюгу (див. мал. 3-11).
Мал.
