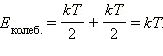- •Пространственно-временная система отсчёта
- •Траектория, путь, перемещение, скорость, ускорение.
- •Касательное и нормальное ускорение
- •Кроме центростремительного ускорения, важнейшими характеристиками равномерного движения по окружности являются период и частота обращения.
- •Вращательное движение, угловая скорость и ускорение
- •Связь между линейными и угловыми величинами.
- •, Отсюда
- •Аналогия между уравнениями поступательного и вращательного движений
- •Законы Ньютона
- •Первый закон Ньютона (закон инерции)
- •Преобразования Галилея
- •Принцип относительности Галилея
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Второй закон Ньютона для системы тел
- •Силы в механике
- •Работа и мощность силы. Диссипативные силы
- •Потенциальная энергия тела в поле гравитационной, кулоновской и упругой сил
- •Связь между потенциальной энергией и консервативной силой
- •Полная механическая энергия
- •Момент силы и импульса относительно оси
- •Момент инерции материальной точки
- •Уравнение моментов для материальной точки
- •Классификация колебаний
- •Квазиупругие силы
- •Гармонические колебания
- •Векторное и комплексное представление гармонических колебание
- •Скорость и ускорение колебаний
- •Дифференциальное уравнение гармонических колебаний или уравнение гармонического осциллятора
- •Маятники: пружинный, физический, математический. Периоды их колебаний
- •Свободные затухающие колебания пружинного маятника. Амплитуда, частота и период затухающих колебаний.
- •Характеристики колебательной системы с затуханием: логарифмический декремент колебаний и добротность колебательной системы
- •Вынужденные колебания. Резонанс.
- •Основные понятия: молярная масса и количество вещества
- •Температурные шкалы Кельвина и Цельсия
- •Нулевое начало термодинамика. Термодинамическое определение температуры
- •Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
- •Постулат Больцмана о равнораспределении энергии по степеням свободы молекулы. Полная кинетическая энергия молекулы.
- •Деление веществ на твёрдые тела, жидкости и газы. Идеальный газ
- •Внутренняя энергия идеального газа и её изменение
- •Количество теплоты. Теплоёмкость
- •Работа газа. Работа газа в изопроцессах
- •Первое начало термодинамики и его частные случаи для изопроцессов
Температурные шкалы Кельвина и Цельсия
Градус Цельсия (обозначение: °C) — широко распространённая единица измерения температуры, применяется в СИ, наряду с кельвином. Градус Цельсия назван в честь шведского учёного Андерса Цельсия, предложившего в 1742 году новую шкалу для измерения температуры. За ноль по шкале Цельсия принималась точка плавления льда, а за 100° — точка кипения воды при стандартном атмосферном давлении. Кельвин (обозначение: K) — единица измерения температуры в СИ, предложена в 1848 году. Один кельвин равен 1/273,16 термодинамической температуры тройной точки воды. Начало шкалы (0 К) совпадает с абсолютным нулём. Пересчёт в градусы Цельсия: °С = K - 273,15 (температура тройной точки воды — 0,01 °C).
Нулевое начало термодинамика. Термодинамическое определение температуры
Нулевое начало термодинамики (общее начало термодинамики) — физический принцип, утверждающий, что вне зависимости от начального состояния изолированной системы в конце концов в ней установится термодинамическое равновесие, а также что все части системы при достижении термодинамического равновесия будут иметь одинаковую температуру. Тем самым нулевое начало фактически вводит и определяет понятие температуры. Нулевому началу можно придать чуть более строгую форму: Если система A находится в термодинамическом равновесии с системой B, а та, в свою очередь, с системой C, то система A находится в равновесии с C. При этом их температуры равны.
Существование равновесного состояния называют первым исходным положением термодинамики. Вторым исходным положением термодинамики называют утверждение о том, что равновесное состояние характеризуется некоторой величиной, которая при тепловом контакте двух равновесных систем становится для них одинаковой в результате обмена энергией. Эта величина называется температурой.
Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения. Получим основное уравнение МКТ.
Уравнение
состояния идеального
газа (иногда уравнение
Клапейрона или уравнение Клапейрона — Менделеева) —
формула, устанавливающая зависимость
между давлением, молярным
объёмом и абсолютной
температурой идеального
газа.
Уравнение имеет вид:
![]() где
где
![]() —
давление,
—
давление,
![]() — молярный
объём,
— молярный
объём,
![]() — универсальная
газовая постоянная
— абсолютная
температура,К
Так как
— универсальная
газовая постоянная
— абсолютная
температура,К
Так как ![]() ,
где
,
где ![]() — количество
вещества,
а
— количество
вещества,
а ![]() ,
где
—
масса,
— молярная
масса,
уравнение состояния можно записать:
,
где
—
масса,
— молярная
масса,
уравнение состояния можно записать:
![]()
Модификации уравнения Клайперона-Менделеева
Из этого уравнения
получаются законы Бойля — Мариотта,
Шарля и Гей-Люссака:
![]() — закон
Бойля — Мариотта.
— закон
Бойля — Мариотта.
![]() — Закон
Гей-Люссака.
— Закон
Гей-Люссака.
![]() — закон Шарля (второй
закон Гей-Люссака, 1808 г.)
— закон Шарля (второй
закон Гей-Люссака, 1808 г.)
Давление газа на стенки сосуда. Основное уравнение МКТ.
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц, размером которых можно пренебречь: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.Основными доказательствами этих положений считались:Диффузия Броуновское движение. Изменение агрегатных состояний вещества. Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения. Получим основное уравнение МКТ. Основное уравнение МКТ: p=nkt;p=2/3nE;p=1/3mnv^2. Е=3/2kT
Среднеквадратичная скорость и средняя кинетическая энергия поступательного движения молекул. Физический смысл температуры.
Среднеквадратичная
скорость
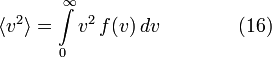 Подставляя
Подставляя ![]() и
интегрируя, мы получим
и
интегрируя, мы получим
 Температура
— мера средней кинетической энергии
молекул. Из
уравнений (25.2) и (25.4) следует равенство
Температура
— мера средней кинетической энергии
молекул. Из
уравнений (25.2) и (25.4) следует равенство
![]() .
(25.8) Средняя
кинетическая энергия хаотического
движения молекул газа пропорциональна
абсолютной температуре.
Из
уравнений (24.2) и (25.8) можно получить, что
p
= nkT.
.
(25.8) Средняя
кинетическая энергия хаотического
движения молекул газа пропорциональна
абсолютной температуре.
Из
уравнений (24.2) и (25.8) можно получить, что
p
= nkT.
Степени свободы молекул: поступательные, вращательные, колебательные
Каждое
независимое движение называется степенью
свободы.
Таким образом, одноатомная молекула
имеет 3 поступательные степени свободы,
«жесткая» двухатомная молекула имеет
5 степеней (3 поступательные и 2
вращательные), а многоатомная молекула
– 6 степеней свободы (3 поступательные
и 3 вращательные). При достаточно высоких
температурах в многоатомных молекулах
возбуждаются дополнительные –
колебательные степени свободы, связанные
с изменением расстояний между атомами.
Например, в двухатомной молекуле при
данных условиях насчитывается 6 стпеней
свободы (3 поступательные, 2 вращательные
и 1 колебательная). В классической
статистической физике доказывается
так называемая теорема
о равномерном распределении энергии
по степеням свободы:
Если
система молекул находится в тепловом
равновесии при температуре T,
то средняя кинетическая энергия
равномерно распределена между всеми
степенями свободы и для каждой
поступательной и вращательной степени
свободы молекулы она равна: kT/2Если
рассматриваются и колебательные степени
свободы, то для каждой колебательной
степени свободы молекулы средняя
кинетическая энергия равна kT,
так как колебательное движение связано
с наличием не только кинетической, но
и потенциальной энергии, причем для
малых (гармонических) колебаний среднее
значение потенциальной энергии равно
среднему значению кинетической. Поэтому
на каждую колебательную степень свободы
приходится: