
- •Лекции по квантовой физике
- •Тема I. Двойственность природы микрочастиц. Волновые свойства частиц.
- •§ 1. Гипотеза де-Бройля. Волны де-Бройля. Дифракция электронов.
- •§2. Соотношение неопределенностей Гейзенберга.
- •§3. Волновая функция и ее физический смысл.
- •Тема II. Атом водорода по Резерфорду-Бору
- •§ 4. Модели строения атома. Опыты Резерфорда по рассеиванию -частиц
- •§ 5. Постулаты Бора. Опыты Франка и Герца
- •§6. Спектральные серии атома водорода
- •§ 7. Теория атома водорода по Бору
- •§ 8. Квантовые числа. Строение электронных оболочек.
- •§9. Таблица Менделеева. Характеристическое рентгеновское излучение.
- •Тема 3. Физика атомного ядра
- •§ 10. Строение атомного ядра. Основные характеристики ядер.
- •§ 11. Энергия связи ядер и дефект масс.
- •§12. Радиоактивность ядер.
- •§ 13. Ядерные реакции.
- •§ 15. Некоторые сведения об элементарных частицах.
§6. Спектральные серии атома водорода
Атомы, в виде разреженного газа или паров металла, дают спектр излучения, состоящий из отдельных линий. Такие спектры называются линейчатыми. При этом линии в спектре можно объединить в группы или в серии.
Особенно отчетливо это проявляется в спектре простейшего атома водорода.
Швейцарский физик Бальмер показал, что длины волн 4-х линий в видимой области спектра водорода можно определять по общей формуле:
![]() (6.1),
(6.1),
В=const, n=3;4;5;6.
Если
введем обозначение v¢
=
![]() - волновое число, тогда:
- волновое число, тогда:
![]() (6.2),
(6.2),
![]() -
постоянная Ридберга.
-
постоянная Ридберга.
![]() ,
серия, Бальмера, n = 3;4;5;6
(6.3)
,
серия, Бальмера, n = 3;4;5;6
(6.3)
Волновые
числа
![]() (при n ®¥),
(при n ®¥),
![]()
![]() определяют границы спектральной серии.
определяют границы спектральной серии.
Наряду с серией Бальмера в спектре атомарного водорода были обнаружены другие серии, волновые числа которых можно представить аналогичными формулами.
В ультрафиолетовой области серия Лаймана:
![]() n = 2;3… (6.4),
n = 2;3… (6.4),
В инфракрасной области:
![]() -
серия Пашена, n =4;5…
-
серия Пашена, n =4;5…
![]() )
- серия Брэкета, n = 5;6… (6.5)
)
- серия Брэкета, n = 5;6… (6.5)
![]() -
серия Пфунда, n = 6;7…
-
серия Пфунда, n = 6;7…
![]() -
серия Хемфри, n = 7;8…
-
серия Хемфри, n = 7;8…
Анализируя соотношения (6.3) – (6.5), можно сказать, что все серии атомарного водорода можно представить общей формулой:
![]() (6.6)
– обобщенная
формула Бальмера:
(6.6)
– обобщенная
формула Бальмера:
m=1;2;3;4;5;6; n=m+1, m+2,…
Обозначим
величины
![]() и
и
![]() - спектральные
термы.
- спектральные
термы.
Тогда
(6.6) запишется
![]() (6.7).
(6.7).
Соотношение (6.7) получило название комбинационный принцип.
Этот
принцип был установлен опытным путем,
а теория Бора дала ему толкование:
Каждому спектральному терму соответствует
определенное стационарное состояние
атома и 2–ой постулат Бора – это есть
комбинационный принцип, выраженный
иным способом. Действительно, т.к.
![]() ,
а
,
а
![]() ,
то
,
то
![]() .
По II постулату Бора
.
По II постулату Бора
![]() или
или
![]() ,
,
![]() (6.8).
(6.8).
Сравнивая
(6.7) и (6.8) можно записать:![]() и
и
![]() .
Отсюда получается:
.
Отсюда получается:
![]() (6.9)
(6.9)
– энергия стационарного состояния атома. Знак «-» имеет условное значение, чисто физический смысл – энергия электрона в поле положительного ядра отрицательна.
Из (6.9) видно, что энергия стационарных состояний образует дискретный ряд при n=1;2;3…
§ 7. Теория атома водорода по Бору
По модели Резерфорда атом водорода: имеет в центре положительно заряженное ядро – протон, вокруг движется электрон.
Потенциальная энергия взаимодействия электрона с ядром:
![]() (7.1), r
– радиус орбиты.
(7.1), r
– радиус орбиты.
Кинетическая
энергия электрона, движущего вокруг
ядра:
![]() (7.2).
(7.2).
Тогда
полная энергия атома:
![]() (7.3).
(7.3).
Электрон
вокруг ядра движется с ускорением под
действием Кулоновской силы, которые
определяются как
![]() ;
; ![]() .
.
По
II закону Ньютона (ma
= Fk)
можно записать:
![]() (7.4);
(7.4);
отсюда
![]() (7.5). Поставим
(7.5) в (7.3) и получим выражение для полной
энергии
(7.5). Поставим
(7.5) в (7.3) и получим выражение для полной
энергии
![]() (7.6).
(7.6).
По классической механике радиус орбиты электрона может принимать любые значения, тогда и энергия согласно (7.6) может принимать любые значения. Согласно постулатам Бора энергия атома, а значит и радиус орбиты электрона определенные. Бор предложил правило отбора или правило квантования (III постулат Бора).
Из
всех возможных орбит электрона
осуществляется только те, для которых
момент импульса электрона кратен
постоянной Планка:
![]() (7.7), где
n=1,2,3,…
- главное квантовое число.
(7.7), где
n=1,2,3,…
- главное квантовое число.
Решим систему уравнений:
![]()
![]() подставим
во вторую формулу системы:
подставим
во вторую формулу системы:
![]()
определим радиус стационарной орбиты электрона:
![]() (7.8),
(7.8),
при
![]() (радиус 1-ой орбиты).
(радиус 1-ой орбиты).
Из
(7.8)
![]() .
Подставляя rn
из
(7.8) в
выражение для энергии
.
Подставляя rn
из
(7.8) в
выражение для энергии
получим:
![]() (7.9)
(7.9)
– энергии стационарных состояний.
При
![]() ,
,
![]() - энергия
первого стационарного состояния.
- энергия
первого стационарного состояния.
В состоянии с энергией Е1 атом может находиться сколь угодно долго. Для того, что бы ионизировать атом водорода, т.е. оторвать от него электрон, ему нужно сообщить энергию 13,55 эВ.
![]() эВ
– энергия
ионизации атома водорода.
эВ
– энергия
ионизации атома водорода.
![]() ;
; ![]() эВ;
эВ; ![]() эВ;
эВ;
![]() эВ и т.д.
эВ и т.д.
С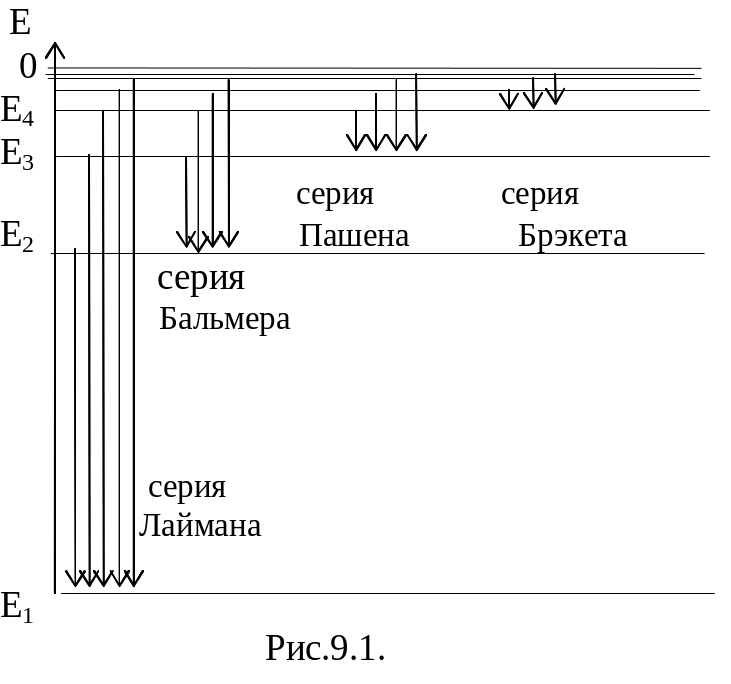 остояние
остояние
![]() ,
,
![]() ,…
соответствуют возбужденному атому.
Время жизни в этих состояниях имеет
порядок
,…
соответствуют возбужденному атому.
Время жизни в этих состояниях имеет
порядок
![]() .
.
За это время электрон успевает совершить около 100 млн. оборотов вокруг ядра.
Условно энергии стационарных состояний обозначаются горизонтальными линиями или уровнями энергии.
Пользуясь схемой энергетических уровней для атома водорода легко объяснить образование всех серий в спектре атома водорода.
Излучение спектральных линий связано с переходами с высших энергетических уровней на один из низших.
Сравнивая и (7.9) получаем, что постоянная Ридберга:
![]() .
.
