
Методические указания по выполнению лабораторного практикума.
Лабораторная работа №1
Использование тепловых диаграмм и таблиц для решения теплотехнических задач.
Цель работы: определение параметров водяного пара с использованием i-s диаграммы.
Приборы и оборудование: i-s-диаграмма для водяного пара, карандаш, резинка стиральная, линейка, инженерный калькулятор.
Краткие теоретические сведения.
Предварительно (самостоятельно, до начала занятий) ознакомиться с основами технической термодинамики, изложенными в §§ 1.1 - 1.6. (стр.16-29). Необходимо обратить внимание на следующее:
а) термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах и сопровождающихся тепловыми эффектами.
Макроскопической системой (термодинамической системой, рабочим телом в тепловых двигателях) называется любой материальный объект, состоящий из большого числа частиц.
Термодинамика опирается на фундаментальные законы (начала), которые получаются путём обобщения наблюдений над процессами, протекающими в природе. Первое начало является законом сохранения и превращения энергии для изолированной системы. Второе начало указывает направление процессов обмена энергией, протекающих в природе. В качестве третьего начала принимается принцип недостижимости абсолютного нуля.
Техническая термодинамика (есть также химическая термодинамика, термодинамика биологических систем и т.п.) занимается разработкой теории тепловых двигателей и установок. Другими словами техническая термодинамика – раздел термодинамики, занимающийся приложениями законов термодинамики в теплотехнике.
б) Свойства термодинамической системы (или рабочего тела в тепловых двигателях) характеризуются некоторыми величинами, которые принято называть термодинамическими параметрами. Наиболее важные из них – абсолютное давление, абсолютная температура и объём.
Связь между параметрами равновесного состояния рабочего тела выражается уравнением состояния. Для реальных рабочих тел найдено более сотни различных видов уравнений состояния. Наиболее простым является уравнение состояния идеального газа. Идеальным газом считают газ, размерами молекул которого и силами взаимодействия между ними можно пренебречь. Молекулы такого газа обладают только кинетической энергией (прямо пропорциональной абсолютной температуре). Это уравнение имеет следующий вид:
P·V = (m/μ) · R·T (1)
Читается оно следующим образом: для данной массы газа (m) произведение давления на объём прямо пропорционально абсолютной температуре. Коэффициент пропорциональности R называют газовой постоянной ( R = 8314 дж/ кмоль °К, (2) μ – молярная масса, кг/кмоль). Уравнение (2) получило название уравнения Клапейрона-Менделеева.
При переходе идеального газа (реальный газ, например воздух, при нормальных условиях можно с небольшой погрешностью считать идеальным) из одного равновесного состояния в другое совершается термодинамический процесс.
К основным термодинамическим процессам относятся: изохорный, изотермический, изобарный и адиабатный. в) При протекании термодинамического процесса тела обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами. 1-й способ реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел, либо лучистым переносом внутренней энергии излучающих тел путем электромагнитных волн. При этом энергия передается от более нагретого тела к менее нагретому. Количество энергии, переданной этим способом от одного тела к другому, называется количеством теплоты – Q , а способ – передача энергии в форме теплоты. 2-й способ связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления, То есть передача энергии происходит при условии перемещения всего тела или его части в пространстве. При этом количество переданной энергии называется работой – L , а способ- передача энергии в форме работы. Количество энергии, полученной телом в форме работы называется работой, совершенной над телом, а отданную энергию – затраченной телом работой. Количество теплоты, полученное (отданное) телом и работа, совершенная (затраченная) над телом, зависят от условий перехода тела из начального состояния в конечное, т.е. зависят от характера термодинамического процесса. В общем случае внутренней энергией называется совокупность всех видов энергий, заключенной в теле (или системе тел). Эту энергию можно представить как сумму отдельных видов энергий: кинетической энергии молекул (поступательного и вращательного движения молекул); колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии молекул. г) В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. При этом знание абсолютных значений внутренней энергии не требуется. Поэтому внутренней энергией для идеальных газов называют кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов дополнительно включают потенциальную энергию молекул. Первый закон термодинамики является основой термодинамической теории и имеет огромное прикладное значение при исследовании термодинамических процессов. Этот закон является законом сохранения и превращения энергии: "энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических процессах". Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии термодинамической системы: "теплота, подведенная к системе, расходуется на изменение энергии системы и совершение работы". Уравнение первого закона термодинамики имеет следующий вид: Q = (U2 – U1) + L, (3) где Q - количество теплоты, подведенной (отведенной) к системе; L - работа, совершенная системой (над системой); (U2 – U1) =∆U - изменение внутренней энергии в данном процессе. Если подводится бесконечно малое количество теплоты, то δQ=dU+δL (4) .
Внимание:
это запись
первого начала в дифференциальной
форме, в то время как формулу (3)
называют записью
первого начала в интегральной форме.
В таком виде первое начало используется
при анализе так называемых равновесных
процессов, когда давление внутри
термодинамической системы и во внешней
среде одинаковы. Единственным видом
работы в таком процессе является
механическая работа (работа изменения
объёма) δ L = P·dV.
L=
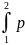 ·dV.
(6) Удельная работа l
= L/m
=
·dv;
(7) q = Q /m= ∆u+
l. (8)
Работу можно найти, если известна
зависимость Р от V.
А для этого надо знать, какой
термодинамический процесс при этом
совершила система. Если:
Q > 0 –
теплота подводится к системе; Q < 0 –
теплота отводится от системы;
L > 0
–работа совершается системой; L < 0 –
работа совершается над системой.
·dV.
(6) Удельная работа l
= L/m
=
·dv;
(7) q = Q /m= ∆u+
l. (8)
Работу можно найти, если известна
зависимость Р от V.
А для этого надо знать, какой
термодинамический процесс при этом
совершила система. Если:
Q > 0 –
теплота подводится к системе; Q < 0 –
теплота отводится от системы;
L > 0
–работа совершается системой; L < 0 –
работа совершается над системой.
Если давление
внешней среды не равно давлению внутри
термодинамической системы, то работа,
совершаемая термодинамической системой
(её называют по разному- техническая,
полезная внешняя, работа по изменению
давлении) определяется, как L*
= -
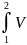 dP.
l* =
-
dP.
l* =
-
 dP
(9) По определению энтальпии I
= U + P·V.
(10) Удельная энтальпии i
= u + p·v
(11). Первое
начало термодинамики с учётом
ф-л (9) - (11) можно записать в виде: Q
= ∆I + L*;
(12) q = ∆i
+ l*
(13).
dP
(9) По определению энтальпии I
= U + P·V.
(10) Удельная энтальпии i
= u + p·v
(11). Первое
начало термодинамики с учётом
ф-л (9) - (11) можно записать в виде: Q
= ∆I + L*;
(12) q = ∆i
+ l*
(13).
Удельные значения величин, входящих в приведенные выше уравнения, находятся делением их значений на массу рабочего вещества: u= U/m ; i = I/m. v=V/m и т. д.
Все процессы рассматриваются как обратимые. Это означает, что при совершении подобных процессов, как в прямом, так и в обратном направлении, термодинамическая система возвращается в исходное состояние без каких- либо изменений в окружающей среде. При необратимых процессах система уже не может вернуться в исходное состояние без изменений в окружающей среде.
д) Саади Карно ещё в начале 19 века показал в своих работах, что тепловой двигатель может совершать полезную работу, если совершает замкнутый процесс или цикл. В результате такого процесса рабочее тело должно возвратиться в первоначальное состояние. Совершаемый рабочим телом цикл можно представить состоящим из нескольких простых процессов. Изучая каждый процесс в отдельности, можно определить все необходимые параметры и функции состояния , а затем рассчитать полезную работу и коэффициент полезного действия конкретного теплового двигателя. Полезная работа за цикл определяется сложением работ всех процессов, из которых состоит цикл, с учётом их знака: (+) или (-) В этом и заключается основная задача технической термодинамики в применении к тепловым агрегатам: умение проводить теплотехнические расчёты и находить нужные параметры.
е) для термодинамических расчётов используют таблицы и термические диаграммы. Расчёты по данным таблиц более точны, по диаграммам - более просты. Для водяного пара удобной диаграммой является диаграмма i-s.
Она строится на основе табличных данных и каждая её точка позволяет определить пять параметров и функций состояния как влажного, так и перегретого пара: давление, удельный объём, температуру, удельные энтальпию и энтропию. Удельную внутреннюю энергию можно найти, используя ф-лу (11). Если указан процесс, который совершает пар, и заданы начальные и конечные его параметры , то можно рассчитать работу процесса (ф-ла 7) и определить теплоту ( ф-ла 8). Используя ф-лы (9), (13), можно рассчитатьтехническую работу пара, поступающего на лопатки турбины.
ж) Применение основных уравнений технической термодинамики к циклу Ренкина для паровой турбины , позволяет получить следующие выражения для расчёта её термической мощности и к.п.д.: Nт = (i1 – i2)· М , (Вт) (14); t = (i1 – i2)/( i1 – i3) (15), i3 – энтальпия воды при давлении Р2.
.
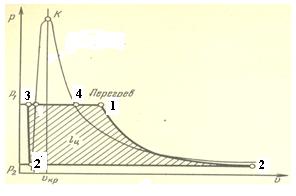 Рис.
1. Цикл Ренкина на перегретом паре (
диаграмма Р-v).
Рис.
1. Цикл Ренкина на перегретом паре (
диаграмма Р-v).
Прямая 2’ -3 изображает изохорный процесс сжатия воды до конечного давления пара Р1. Вода практически несжимаема, поэтому процесс сжатия является изохорным. Эту работу сжатия совершает насос. Теплота, в которую превращается работа по сжатию, гораздо меньше теплоты q1, которая идёт на превращение воды в пар и его перегрев, поэтому ею можно пренебречь, а процесс считать одновременно и адиабатным. Теплота q1 подводится в результате 3-х процессов: 3-4 изобарный процесс подвода теплоты, в результате которого вода доводится до кипения и превращается в пар при постоянном давлении и постоянной температуре; 4-1 изобарный перегрев пара. Из пароперегревателя пар поступает в турбину. Этот быстро протекающий процесс можно считать адиабатным (без подвода и отвода теплоты): 1-2 адиабатное расширение пара в турбине, в результате которого совершается полезная работа. Пар становится влажным и поступает в конденсатор. Здесь он охлаждается проточной водой (изобарно-изотермический процесс 2-2’ ) и превращается в воду, при этом от него отводится тепло q2; цикл завершается.
Выполнение работы.
Процесс расширения пара в турбине - адиабатный. Проведём полный термодинамический расчёт адиабатного процесса, используя i - s диаграмму.
Задание 1.
Изучить диаграмму i-s, т.е. определить изображение на ней основных термодинамических процессов (расположение изобар, изохор, изотерм, адиабат), а так же расположение кривых степени сухости ( х=1 и др.) для влажного пара.
Изобары (сплошные линии) идут из правого верхнего угла в левый нижний. Единицы измерения Мпа (1 Мпа = 106 Па= 10 бар).
Изохоры- пунктирные линии) начинаются там же, где изобары, идут так же из правого верхнего угла в левый нижний, но круче.
Изотермы в области влажного пара совпадают с изобарами, но на кривой х=1 (отделяющей пар влажный от сухого перегретого) раздваиваются и идут вправо.
Адиабаты (изоэнтропы, линии равной энтропии)- вертикальные прямые.
Выполнение задания.
Изучили диаграмму i-s, нашли расположение на ней изобар, изохор, изотерм, адиабат, кривых степени сухости.
Задание 2.
Пар, начальные параметры которого Р1 = 1 Мпа, Т1=250 0С, в результате адиабатного расширения переходит в другое равновесное состояние с параметрами равным Р2 = 0,1 Мпа, температурой Т2.
Определить : удельные объёмы пара в начальном v1 и конечном состояниях, v2 , конечную температуру Т2, изменения энтальпии, энтропии, внутренней энергии, а так же теплоту и работу процесса.
Выполнение задания. Находим на диаграмме кривые линии, изображающие изобару Р1 = 1 МПа и изотерму Т1 = 250° С. На их пересечении отмечаем точку 1. Она характеризует начало адиабатного процесса. Опускаем из неё перпендикуляр на ось энтропии (горизонтальная ось), округляем значения до цены деления клетки (0,1 кДж/кг град), или половины клетки (0,05 кдж/кг град) и находим начальное значение энтропии: s1 (кДж/кг град) . Значение удельного объёма находим по ближайшей изохоре (слева или справа от точки, а возможно и к середине отрезка между двумя изохорами; в этом случае складываем значения изохор и делим на 2) ; v1 ( м3/кг) . Опускаем перпендикуляр на ось энтальпии (вертикальная ось) и находим значения i1 (кДж/кг). Результат округляем до цены деления клетки (40 кДж/кг или половины клетки 20 кдж/кг).Начальное значение удельной внутренней энергии определяем по формуле (9) i = u + p· v; u = i – p·v; u1 = i1 – p1· v1 . Следует обратить внимание на то, что энтальпия выражается в кДж/кг, а произведение p1· v1 . даёт дж/кг, если давление перевести в Па=н/м2 из Мпа= 106 Па, а удельный объём брать в м3/кг. Полученные значения p1· v1 . следует поделить на 103, для перевода дж в кДж. Вторая точка на диаграмме, характеризующая окончание адиабатного процесса, находится на пересечении адиабаты (изоэнтропы) s1= s2 и изобары P2 . Находим конечное значение температуры, удельного объёма, внутренней энергии (как и для первой точки): i2 ; v2; Т2; u2 = i2 – p2· v2. Внимание: для нахождения температуры точек влажного пара необходимо по изобаре, проходящей через эту точку(или ближайшей изобаре) подняться до кривой х=1 и найти ближайшую изотерму, отходящую от точки пересечения данной изобары и кривой х=1. Дело в том, что во влажном паре изотермы и изобары совпадают, а на диаграмме показывают изобару и не показывают изотерму.
В адиабатном процессе теплота не отводится и не подводится к рабочему телу (пару), т. е. q = 0 и удельная механическая работа (изменения объёма), согласно первому началу термодинамики в форме (ф-ла 8): q=Δu+l; l= q –Δu = 0 – Δu = - Δu = - (u2 – u1 ) = u1 – u2 . Удельная техническая работа (работа изменения давления) определяется по первому началу в виде (см. ф-лу 13): q= (i1 –i2) + l* ; отсюда для . q= 0 . l* = i1 –i2 .
Работу в адиабатном процессе можно было бы найти и по формулам (1-46) –(1-50), как для реальных газов, так и идеальных (заменой произведения P1· 1 на R·T1).
1 = i1 = s1=
u1 = 2 = i2 =
s2= T2= u2=
l = - Δu = - (u2 – u1 ) = u1 – u2 =
Задание 3.
Провести расчёт термических к.п.д и мощности паровой турбины , используя i – s диаграмму.
Условия задания: паровая турбина расходует M = 50 кг/с пара. Значения давления пара и его температуры на входе в турбину и выходе из неё в конденсатор примем равными Р1 = 10 МПа, Т1= 5500С, Р2= 0,005 МПа. Процесс расширения пара в турбине считать адиабатным. Это означает, что s1= s2.
Расчёты проводятся по формулам (14) и (15).
Выполнение задания. Как и в предыдущем случае, находим точку на диаграмме, характеризующую начальное состояние пара. Она находится на пересечении изобары Р1 = 10 МПа и изотермы Т1= 5500С. Опуская из неё перпендикуляры на оси энтальпии и энтропии, находим значения i1 и s1= s2.
Вторая точка, характеризующая конечное состояние пара, лежит на пересечении изобары Р2= 0,005 МПа и изоэнтропы (адиабаты) s2= s1. Опуская из неё перпендикуляр на ось энтальпии, находим значение i2.
Рассчитываем мощность турбины по формуле (12) и термический к.п.д. по формуле (13). Значение удельной энтальпии воды i3, полученной при конденсации пара, находим из таблиц.
i1 = s1= i2 = i3 = i2’ =
Nт = (i1 – i2)· М = t = (i1 – i2)/( i1 – i2’) = При отчёте необходимо представить расчёты одного из термодинамических процессов, выполненные самостоятельно. Номер задания (см.ниже) получить у преподавателя.
Задание l Пар из состояния 1 (Р1 =0,05 МПа, Т1 = 650 0С) переходит в состояние 2 (Р2 =0,05 МПа, Т2 = 300 0С), совершая термодинамический процесс (определить, какой? ). Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 2 Пар из состояния 1 (v1 = 5,0 м3 / кг , Т1 = 700 0С) переходит в состояние 2 (v2 = 5,0 м3 /кг, Т2= 2000С ), совершая термодинамический (определить, какой? ) процесс. Используя диаграммму i-s, найти неизвестные параметры и функции состояния (давление, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание З Пар из состояния 1 (v1 = 5,0 м3 / кг , Т1 = 400 0С) переходит в состояние 2 (v2 =0,5 м3 / кг , Т2 = 400 0С), совершая термодинамический (определить, какой? ) процесс. Используя диаграмму i-s, найти неизвестные параметры и функции состояния (давление, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 4 . Пар из состояния 1 (Р1 =0,5 МПа, S1 = 8,5 кдж/кг град) переходит в состояние 2 (Р2 =0,05 МПа, S2 = 8,5 кдж/кг град), совершая термодинамический (определить, какой? ) процесс. Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, температуру, энтальпию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 5 Пар из состояния 1 (Р1 = 1,0 МПа, Т1 = 600 0С) переходит в состояние 2 (Р2 =1,0 МПа, Т2 = 300 0С), совершая термодинамическцй (определить, какой? ) процесс. Используя диаграмму i-s, найти неизвестные параметры и функции состояния. (объём, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 6 Пар из состояния 1 (v1 = 1,0 м3 / кг , Т1 = 600 0С) переходит в состояние 2 (v2 = 1,0 м3 / кг, Т2= 3000С), совершая термодинамический (определить, какой? )процесс. Используя диаграмму i-s, найти. неизвестные параметры и функции состояния (давление, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 7 Пар из состояния 1 (Р1 =2,0 МПа, Т1 = 700 0С) переходит в состояние 2 (Р2 =0,1 МПа, Т2 = 700 0С), совершая термодинамический (определить, какой? ) процесс. Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 8 . Пар из состояния 1 (Р1 =1,0 МПа, S1 = 8,0 кдж/кг град) переходит в состояние 2 (Р2 =0,1 МПа, S2 = 8,0 кдж/кг град), совершая термодинамический (определить, какой? ) процесс. Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, температуру, энтальпию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 9 Пар из состояния 1 (Р1 =2,0 МПа, Т1 = 500 0С) переходит в состояние 2 (Р2 =2,0 МПа, Т2 = 400 0С), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса.
Задание 10 Пар из состояния 1 (v1 = 2,0 м3 / кг , Т1 = 500 0С) переходит в состояние 2 (v2 = 2,0 м3 / кг, Т2= 2000С), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти. неизвестные параметры и функции состояния (давление, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса. Задание 11 Пар из состояния 1 (v1 = 10,0 м3 /кг , Т1 = 400 0С) переходит в состояние 2 (v2 = 1,0 м3 / кг, Т2= 4000С), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти. неизвестные параметры и функции состояния (давление, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 12 . Пар из состояния 1 (Р1 =10,0 МПа, S1 = 7,0 кдж/кг град) переходит в состояние 2 (Р2 =1,0 МПа, S2 = 7,0 кдж/кг град), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, температуру, энтальпию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса
Задание 13 Пар из состояния 1 (Р1 =1,0 МПа, Т1 = 600 0С) переходит в состояние 2 (Р2 =1,0 МПа, Т2 = 300 0С), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса.
Задание 14 Пар из состояния 1 (v1 = 1,0 м3 / кг , Т1 = 600 0С) переходит в состояние 2 (v2 = 1,0 м3 / кг, Т2= 3000С), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти. неизвестные параметры и функции состояния (давление, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса.
Задание 15 Пар из состояния 1 (Р1 = 2,0 МПа, Т1 = 700 0С) переходит в состояние 2 (Р2 =0,1 МПа, Т2 = 700 0С), совершая термодинамический процесс (определить, какой? ). Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса.
Задание 16 . Пар из состояния 1 (Р1 =1,0 МПа, S1 = 8,0 кдж/кг град) переходит в состояние 2 (Р2 =0,1 МПа, S2 = 8,0 кдж/кг град), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти неизвестные параметры и функции состояния (объём, температуру, энтальпию, нутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса.
Задание 17 Пар из состояния 1 (v1 = 0,5 м3 / кг , Т1 = 600 0С) переходит в состояние 2 (v2 = 0,5 м3 / кг, Т2= 4000С), совершая термодинамический процесс(определить, какой? ). Используя диаграмму i-s, найти. неизвестные параметры и функции состояния (давление, энтальпию, энтропию, внутреннюю энергию) для первого и второго состояний, а также теплоту и работу процесса.
Выполнение самостоятельного задания.
Заданы:
начальные параметры (и функции)
конечные параметры (и функции)
процесс
Находим первую точку на диаграмме i-s, на пересечении __________________________________________________________________
Находим неизвестные начальные параметры:
Находим незвестные начальные функции состояния :
Находим вторую (конечную) точку на диаграмме i-s, на пересечении ____________________________________________________________________
Находим неизвестные конечные параметры
и функции:
Находим работу (механическую) процесса:
Находим теплоту процесса:
Лабораторная работа № 2.
Измерение температур. 1. Общие сведения об измерении температур.
Температура является одним из важнейших параметров технологических процессов. Температура может быть определена как параметр теплового состояния. Значение этого параметра обуславливается средней кинетической энергией поступательного движения молекул данного тела, которая может сильно отличаться от кинетической энергии каждой отдельной молекулы тела. Поэтому понятие температуры применимо только к телу, состоящего из большого числа молекул ( в применении к отдельным молекулам оно бессмысленно).
Возможность измерять температуру термометром основывается на явлении теплового обмена между телами с различной степенью нагретости и на изменении физических (термометрических ) свойств вещества при нагревании. Следовательно, для создания термометра и построения температурной шкалы казалось бы, возможно выбрать любое термометрическое свойство, характеризующее состояние того или иного вещества и на основании его изменений построить шкалу температур. Однако сделать такой выбор не так легко, так как термометрическое свойство должно быть однозначно изменяться с изменением температуры, не зависеть от других факторов и допускать возможность измерение его изменений сравнительно простым и удобным методом.
В действительности нет ни одного термометрического свойство, которое в полной мере можно удовлетворить этим требованиям во всём интервале измеряемых температур.
Международным комитетом мер и весов 1968 г. была принята Международная практическая температурная шкала МПТИ–68 (первая международная шкала температур - МТИ - была принята в 1927 г.). Эта шкала основана на 2-х постоянных и воспроизводимых температурах фазовых равновесий - реперных точках, которым присвоены определённые числовые значения, а также на приборах и формулах, определяющих связь между температурой и показаниями этих приборах, градуированных в указанных реперных точках.
Например, равновесие между твёрдой, жидкой и парообразной фазами воды существуют при 0,01 °С, а точка кипения воды 100°С, точка затвердения серебра 961,3 °С, а точка затвердения золота 1064,43 °С, равновесие между твёрдой, жидкой и парообразной фазами равновесного водорода (тройная точка) - при (-259,43 °С). В соответствии с решением XVIII Генеральной конференции по мерам и весам (1987) с 1990 введена новая Международная температурная шкала (МТШ-90), в которой значение температуры тройной точкой воды сохраняется, а значения других реперных точек уточнены и приближены к их истинным термодинамическим температурам; при этом °С меньше 0К на 3·10-4. В ряде стран (напр., Австралия, Великобритания, Канада, США) продолжают применять средства измерения температур, градуируемые в °F (градус Фаренгейта) или °R(градус Реомюра).
Пересчёт температуры между основными шкалами
Т0К= Т0С + 273,15 = (Т0F +459,67)/1,8 Т0F= Т0К · 1,8 - 459,67= Т0C· 1,8+32
Т0C= Т0К – 273,15 = (Т0F – 32)/1,8
(Любопытно отметить, что температура −40 °F соответствует температуре −40 °C).
Шкала Реомюра предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R); 1 °R = 1,25 °C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора. На практике для измерения температур наиболее широко используются термометрические свойства: тепловое расширение жидкостей, изменение электрического сопротивления металлов и полупроводников с температурой, возникновение термоЭДС.
