
- •Дніпродзержинський державний технічний університет
- •Конспект лекцій
- •«Аналітична хімія та інструментальні методи аналізу»
- •«Кількісний аналіз. Хімічні методи кількісного аналізу»
- •6.051401 „Біотехнологія»,
- •6.051301 “Хімічна технологія»
- •2.1 Кількісний аналіз. Метрологічні характеристики методів аналізу
- •2.2 Гравіметрія(ваговий аналіз)
- •2.3 Титриметрія(об’ємний аналіз)
- •2.4 Кислотно-основне титрування
- •2.5С принципи розрахунку кривих титрування
- •2.6 Окисно-відновне титрування
- •2.7С методи редоксиметрії
- •2.8С методи осадження в титриметрії
- •2.9 Комплексонометрія
- •Література
- •51918 М. Дніпрдзержинськ,
2.3 Титриметрія(об’ємний аналіз)
Суть та класифікація. Вимоги до реакцій в титриметрії. Способи титрування: прямі та непрямі. Способи приготування стандартних розчинів. Техніка роботи. Методи визначення кінцевої точки титрування. Розрахунки в титриметрії.
Титриметрія - метод кількісного хімічного аналізу, який засновано на вимірюванні об’єму розчину реактиву точно відомої концентрації, яка необхідна для взаємодії з даною кількістю речовини, що визначається. Розчин реактиву точно відомої концентрації зветься стандартним, титрованим, робочим розчином, чи титрантом. Титрування – поступове, контролюємо додавання стандартного розчину к розчину, що аналізується, до досягнення точки еквівалентності (точки кінця титрування) – моменту у якому кількості речовин, що взаємодіють, еквівалентні.
В титриметрії в залежності від типу рівноваги реакцій, виділяють:
- кислотно-основне титрування(метод нейтралізації);
- окисно-відновне титрування(оксидиметрія, редоксиметрія);
- метод осадження(седиметрія);
- метод комплексоутворення.
Реакції,
що використовуються у титрометрії,
повинні відповідати таким вимогам: бути
стехіометричними, перебігати швидко і
бажано при кімнатній температурі,
перебігати кількісно (константа рівноваги
![]() 108),
зайві речовини, які присутні у розчині,
не повинні заважати титруванню, точка
еквівалентності повинна фіксуватися
тим чи іншим чином різко і точно.
108),
зайві речовини, які присутні у розчині,
не повинні заважати титруванню, точка
еквівалентності повинна фіксуватися
тим чи іншим чином різко і точно.
В титриметрії також розрізняють:
- пряме титрування, коли аналізуєма речовина безпосередньо титрується стандартним розчином;
- зворотне (титрування по залишку) титрування, коли титрується(другим стандартним розчином) та частина допоміжного(першого) стандартного розчину, який береться у надлишку, що не взаємодіяла з аналізуємою речовиною;
- титрування замісника, коли титрується(другим стандартним розчином) речовина, що утворилася при взаємодії аналізуємого розчину з першим стандартним розчином, що береться в надлишку.
Стандартні розчини готують за точною наважкою, по установчим розчинам (якщо приготувати стандартний розчин за точною наважкою неможливо) і з фіксаналів (стандарт титри, нормо дози). При приготуванні стандартних розчинів за установчими речовинами спочатку готують стандартний розчин приблизної концентрації, а точну концентрацію встановлюють за розчином установчої речовини, який готують за точною наважкою.
Для титрування збирають установку яка складається з бюретки, штативу, воронки і конічної колби. Бюретка заповнюється стандартним розчином через воронку і цей розчин по краплям додають до розчину з речовиною, що визначається, і який знаходиться у колбі для титрування, до
досягнення точки кінця титрування. Витрачений об’єм реактиву Vст.р., який пішов на титрування до точки еквівалентності, точно фіксується і використовується для визначення вмісту речовини.
Точку кінця титрування можна визначити такими засобами:
1.По зміненню кольору розчину, якщо аналізуєма речовина, титрант чи продукти реакції забарвлені (наприклад у перманганатометрії розчин перманганату калію має червоно-малиновий колір і при титруванні зайва крапля його забарвлює розчин у світло-рожевий колір, що свідчить про досягнення точки кінця титрування).
2.За допомогою речовин, які змінюють колір при досягненні певного значення якогось параметру, що змінюється в процесі титрування (наприклад при кислотно-основному титруванні це рН розчину). Такі речовини звуться індикаторами.
3.Інструментальними методами (потенціометричним, кулонометричним, фотометричним), будуючи і аналізуючи криву титрування.
Розрахункові формули методу титриметрії (пряме титрування) базуються на законі еквівалентів – кількість моль-еквівалентів визначаємої речовини дорівнює у точці еквівалентності кількості моль-еквівалентів стандартного розчину.
Запишемо еквівалентні концентрації визначаємої речовини і стандартного розчину:
Nв.р.
=
![]() ,
Nст.р.
=
,
Nст.р.
=
![]() ,
,
У точці еквівалентності:
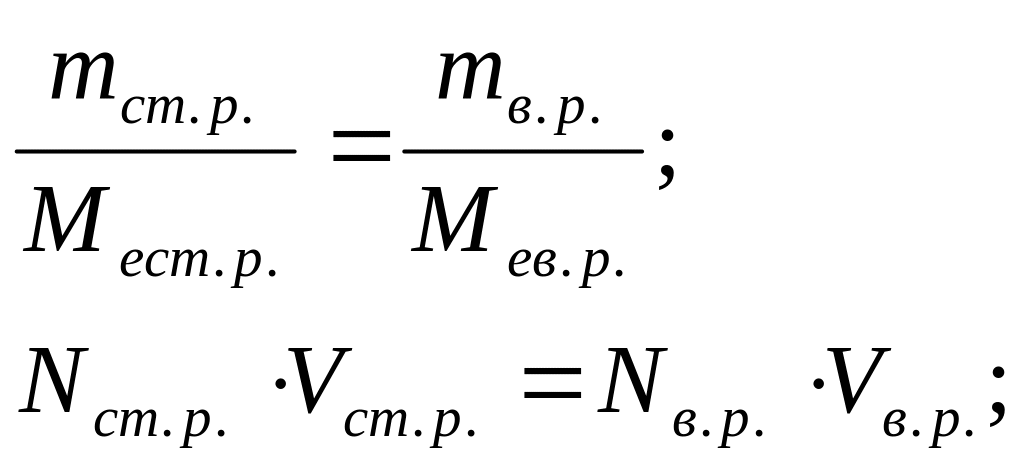
![]()
![]() ;
;
![]() ;
;
![]() ;
;![]() ;
;
![]() ;
;
![]()
де М – молярна маса речовини, г/моль;
Ме – молярна маса еквіваленту, г/мольекв;
N – еквівалентна концентрація, моль-екв./л;
Тст.р.- титр стандартного розчину, г/мл;
Тст.р/в.р.- титр стандартного розчину за визначаємою речовиною, гв.р./млст.р;
Vст.р.-об'єм стандартного розчину у точці еквівалентності, мл;
Vв.р. - об'єм розчину визначаємої речовини, мл;
mв.р. – кількість речовини, г;
g – наважка речовини, г;
Va – об’єм аліквотної частини;
Vk – об’єм мірної колби;
Nт.ст.р. – теоретичне значення еквівалентної концентрації стандартного розчину;
Кст.р. = Nст.р./Nт.ст.р. – коефіцієнт на поправку концентрації стандартного розчину;
- масова частка речовини, %.
При розрахунках титри і еквівалентні концентрації визначаються з чотирма значущими цифрами.
Ці формули використовуються і при розрахунках результатів титрування замісника.
Розрахунки за методом зворотного титрування виконуються за формулою:
![]() ,
г,
,
г,
де індекс ст.р.1 – відноситься до стандартного розчину, який узятий в надлишку, а індекс ст.р.2 – до стандартного розчину, який витрачено на титрування.
В процесі титрування при додаванні титранту відбувається змінення концентрації реагуючих речовин, яке супроводжується зміненням якого-небудь параметру. В кислотно-основному титруванні це змінення рН, в окисно-відновному – змінення окисно-відновного потенціалу розчину. Змінення аналітичного сигналу можливо зобразити графічно в залежності від кількості доданого стандартного розчину.
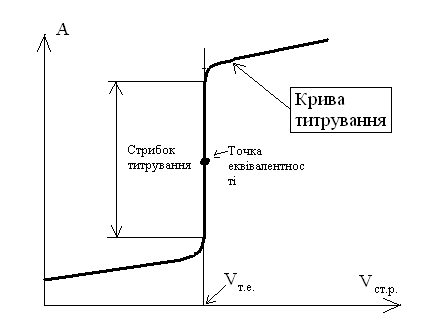
Рисунок 2.2 – Крива титрування
Лінія, яка зображує хід змінення якої-небудь властивості розчину у процесі титрування зветься кривою титрування(рисунок 2.2). Вона дозволяє простежити змінення властивості розчину у різні моменти титрування, встановити точку еквівалентності, об’єм стандартного розчину у точці еквівалентності – Vт.е. і правильно вибрати індикатор.
При будуванні кривої титрування визначають значення параметру, що змінюється, в залежності від концентрації розчину за відповідними розрахунковими формулами, які залежать від типу реакції, яка використовується. Розрахунок концентрації розчину у різні моменти титрування виконується наступним чином.
До початку титрування концентрація розчину дорівнює початковій концентрації аналізуємого розчину.
До точки еквівалентності у розчині відсутній титрант, а присутні речовина, що визначається, і продукт її взаємодії з титрантом. З додаванням титранту кількість речовини, що визначається, зменшується еквівалентно кількості титранту і в загальному вигляді концентрація речовини, що визначається, може бути розрахована за формулою:
![]() ,
,
де Nв.р* – еквівалентна концентрація розчину речовини, що визначається, у даний момент, моль-екв./л;
Nв.р. – початкова еквівалентна концентрація розчину речовини, що визначається, моль-екв./л;
Nст.р. – еквівалентна концентрація стандартного розчину, моль-екв./л;
Vст.р.- об'єм доданого стандартного розчину, мл;
Vв.р. - об'єм розчину речовини, що визначається, мл;
В точці еквівалентності у розчині немає ні речовини, що визначається, ні титранту, а є лише продукти їх взаємодії.
Після точки еквівалентності у розчині будуть присутні лише титрант і продукти його взаємодії з речовиною, що визначалася, і концентрація розчину буде залежати від кількості доданого титранту - Vст.р. і кількості речовини, що визначалася:
![]() .
.
де Nст.р.* – еквівалентна концентрація речовини стандартного розчину у даний момент, моль-екв./л;
Контрольні питання до теми 2.3
3.1.Що таке титриметрія?
3.2.Який метод титрування засновано на протолітичній рівновазі?
3.3.Який метод титрування засновано на рівновагі розчин-осад?
3.4.Який метод титрування засновано на реакціях окислення-відновлення?
3.5.Який метод титрування засновано на рівновазі утворення комплексних сполук?
3.6Які вимоги до реакцій, які використовуються в титриметрії?
3.7.Установка і техніка роботи при титруванні.
3.8.При якому методу титрування титрант безпосередньо додають до розчину?
3.9.При якому методу титрування 1-ий стандартний розчин у надлишку додають до розчину аналізуємої речовини, а ту його кількість, що не прореагувала, знаходять титруючи залишок другим стандартним розчином?
3.10.При якому методу титрування 1-ий стандартний розчин у надлишку додають до розчину аналізуємої речовини, а другим стандартним розчином визначають кількість речовини, що утворилася, яка еквівалентна кількості визначаємої речовини?
3.11.Як готують стандартні розчини в титриметрії?
3.12.Якими засобами можна визначити точку кінця титрування?
3.13.На чому засновані розрахунки в титріметрії?
3.14.Що таке крива титрування? Що вона дозволяє визначити?
3.15.Як розраховується концентрація розчину у різні моменти титрування?
