
- •Дніпродзержинський державний технічний університет
- •Конспект лекцій
- •«Аналітична хімія та інструментальні методи аналізу»
- •«Кількісний аналіз. Хімічні методи кількісного аналізу»
- •6.051401 „Біотехнологія»,
- •6.051301 “Хімічна технологія»
- •2.1 Кількісний аналіз. Метрологічні характеристики методів аналізу
- •2.2 Гравіметрія(ваговий аналіз)
- •2.3 Титриметрія(об’ємний аналіз)
- •2.4 Кислотно-основне титрування
- •2.5С принципи розрахунку кривих титрування
- •2.6 Окисно-відновне титрування
- •2.7С методи редоксиметрії
- •2.8С методи осадження в титриметрії
- •2.9 Комплексонометрія
- •Література
- •51918 М. Дніпрдзержинськ,
2.4 Кислотно-основне титрування
Методи кислотно-основного титрування, їх характеристика: стандартні розчини, первинні стандарти. Визначення придатності методу. Визначення точки еквівалентності. Кислотно-основні індикатори. Іонно-хромофорна теорія індикаторів. Показник титрування та інтервал переходу індикатора. Вибір індикатору.
В основу кислотно-лужного титрування покладена реакція нейтралізації:
H3O+
+ OH-
![]() 2H2O,
чи
H+
+ OH-
H2O.
2H2O,
чи
H+
+ OH-
H2O.
Метод дозволяє кількісно визначати сильні і слабкі кислоти і основи, а також деякі солі, що гідролізуються. Стандартними розчинами використовують розчини сильних кислот (HCl, H2SO4) і луги (NaOH, KOH) з концентрацією 1; 0,5; 0,1; 0,01 моль/л. Тому відрізняють методи ацидиметрії (титрант-кислота) і алкаліметрії (титрант-основа).
Первинними стандартами (установчими речовинами) використовують Na2B4O7*10H2O, H2C2O4*2H2O, Na2CO3, Na2C2O4.
Придатність методу визначається перш за все константою рівноваги, яка повинна бути Кр>108.
При
визначенні слабких основ чи кислот це
виконується, якщо константа дисоціації
більш ніж КД
10-6,
а при визначені солей, що гідролізуються,
константа дисоціації слабкої кислоти,
чи слабкої основи, яка утворює соль,
менш ніж
![]() .
Наприклад, цим методом можна визначити
оцтову кислоту і бікарбонат натрію:
.
Наприклад, цим методом можна визначити
оцтову кислоту і бікарбонат натрію:
![]()
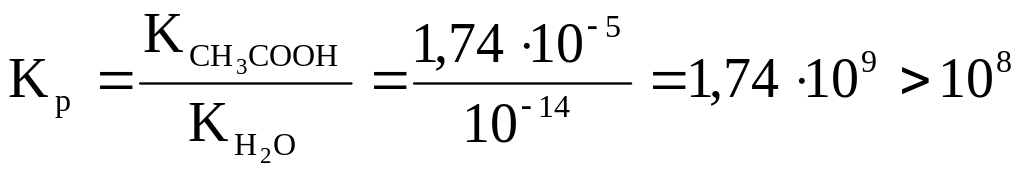
![]()
![]()
але неможливо, з достатньою точністю визначити ацетат натрію:
![]()
![]()
Суміші кислот і основ можна визначати, якщо їх константи іонізації відрізняються більш ніж на 4 порядки.
Слабкі кислоти та луги, як титранти, звичайно не використовують, так як у цьому разі неможливо досягнути необхідної величини Кр. Наприклад, якщо для титрування розчину аміаку використовувати оцтову кислоту:
![]()
![]() =
=![]() <108.
<108.
Реакції нейтралізації не супроводжуються видимими зовнішніми ефектами, тому для фіксування точки кінця титрування використовують фізичні методи(Потенціометрію, кондуктометрію), або сполуки, які змінюють свій колір у вузькому інтервалі рН, який не залежить від природи реагуючих речовин, а залежить від природи сполуки. Такі сполуки звуть кислотно-основними індикаторами.
Згідно іоно-хромофорній теорії в розчинах кислотно-основних індикаторів мають місце дві рівноваги:
1.Рівновага між не дисоційованими молекулами і іонами, яка встановлюється у розчині індикаторів, які є слабими органічними кислотами чи основами. Наприклад, у розчині фенолфталеїну:
HInd H+ + Ind-.
2.Зміна кольору індикатору є наслідком внутрішньо молекулярного перегрупування, у результаті чого змінюється будова молекули індикатора. Перегрупування залежить від величини рН розчину, є оборотним процесом і називається таутомерною ізомерією. Речовини, які здатні змінювати колір звуться хромофорами. При цьому склад індикатора не змінюється, а змінюється його будова. Отже індикатор може перебувати у двох таутомерних формах(різної будови, а тому і різного кольору), між якими встановлюється рівновага, наприклад, бензольна структура перетворюється у хіноїдну(рисунок 2.3).
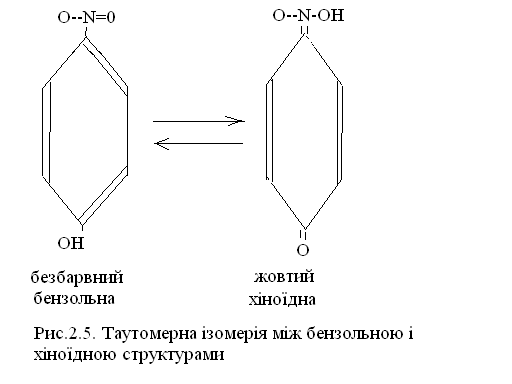
Рисунок 2.3 – Таутомерна ізомерія між бензольною і хіноїдною структурами
Таким чином зміна кольору індикатору – це наслідок зміни співвідношення кількостей речовин молекулярної і іонної форм індикатора, яка відбувається під впливом кислот і основ і перетворення хромофорних груп.
Взагалі ці перетворення можна представити схемою для індикатора п-нітрофенолу(рисунок 2.4).
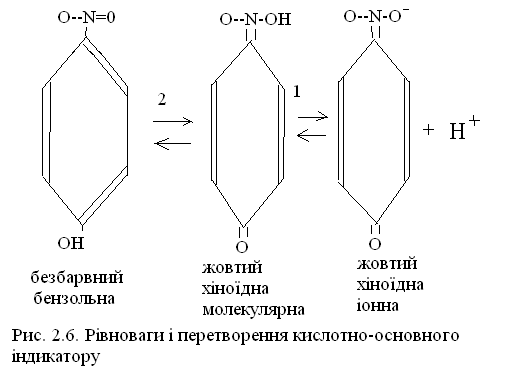
Рисунок 2.4 – Рівноваги і перетворення кислотно-основного індикатору
Додавання кислоти здвине рівновагу 1 вліво, при цьому збільшиться концентрація хіноїдної форми, яка приведе к здвигу рівноваги 2 вліво і жовта хіноїдна форма буде переходити в бензольну безбарвну форму.
Рівновага дисоціації індикатора встановлюється швидко, а процес таутомерного перетворення проходить у часі, тому зміна кольору індикатору відбувається не завжди швидко, що доказує наявність таутомерії.
Область значень рН, у якій видно зміну кольору індикатору, зветься інтервалом переходу індикатору - рНHInd. Колір розчину індикатору залежить від співвідношення концентрацій молекулярної і іонної форм. Розглянемо змінення забарвлення для індикатору фенолфталеїн(KHind = 1*10-9, рКHInd = 9). Якщо індикатор дисоціює за рівнянням:
HInd H+ + Ind-,
безбарвний червоний
константа дисоціації дорівнює:
КHind
=
![]() .
.
Звідки можна написати: KHind/[H+]=[Ind-]/[Hind].
Якщо рН=8, Н+ = 10-8, КHind /[H+] 10-9/10-8 =10-1, [Ind-] / [Hind] = 10-1, концентрація забарвленої форми у 10 разів менше ніж безбарвної і розчин буде ледь рожевим.
Якщо рН=9, Н+ = 10-9, КHind /[H+] =1, [Ind-] / [Hind] = 1, концентрація забарвленої форми дорівнює безбарвній і розчин буде рожевим.
Якщо рН=10, Н+ = 10-10, КHind /[H+] =10, [Ind-] / [Hind] = 10, концентрація забарвленої форми у 10 разів більше ніж безбарвної і розчин буде малиново-червоним.
Таким чином, змінення забарвлення індикатора з’являється при відношенні форм індикатору 1/10, чи 10/1, або зміненням рН на одиницю.
Знаючи
константу індикатору можна приблизно
розрахувати інтервал переходу рНHInd,
наприклад для фенолфталеїну це: рНHInd
=рКHInd![]() 1=9
1,
1=9
1,
Точні дані о індикаторах і їх інтервалах переходу наведені у довідниках. Наприклад, для метилового рожевого інтервал переходу червоний – 3,1 – 4,4 –жовтий, для фенолфталеїну безбарвний – 8,2 – 10 – пурпурний. Придатність індикатора для титрування визначається за показником титрування рТ– це те значення рН у межах інтервалу переходу індикатора, при якому відбувається різка зміна кольору індикатору. Значення рТ приблизно дорівнює рКInd.
При виборі індикатора і при титруванні дотримуються наступних основних правил.
1.Індикатор повинен змінювати колір як найближче до точки еквівалентності рНт.е.~ рТHind.
2.Титр стандартного розчину встановлювати і використовувати розчин в присутності одного і того ж індикатору.
3. Брати одну і ту ж кількість індикатору(1-2 краплі) і повторювати титрування до отримання однакових результатів.
4.Титрувати при встановленні титру і визначені до появи однакового відтінку забарвлення.
Відзначимо,
що точка еквівалентності не завжди
відповідає точці нейтральності і у
різних випадках титрування закінчують
при різних значеннях рН,
які залежать від природи реагуючих між
собою речовин. Для правильного визначення
індикатора будують криві титрування,
які також дають можливість визначити
і придатність кислотно-основного
титрування по значенню стрибка титрування.
Так, наприклад, якщо концентрація
розчинів менш ніж 0,001н, то стрибок
титрування зникає і титрування стає
неможливим. Також неможливо з цієї
причини визначати слабкі кислоти і луги
з КД![]() 10-8.
10-8.
Контрольні питання до теми 2.4
4.1.На якій реакції засновано метод кислотно-основного титрування?
4.2.Стандартні розчини і первинні стандарти методу кислотно-основного титрування.
4.3.Чим визначається придатність методу кислотно-основного титрування?
4.4.Можливо або ні визначити вміст гідроксиду амоніаку методом кислотно-основного титрування використовуючи стандартний розчин HCl?
4.5.Можливо або ні визначити вміст гідроксиду амоніаку методом кислотно-основного титрування використовуючи стандартний розчин CH3COOH?
4.6.У чому сутність іоно-хромофорної теорії кислотно-основних індикаторів?
4.7.Що таке інтервал переходу індикатору?
4.8.При яких умовах кислотно-основний індикатор змінює свій колір?
4.9.Що таке показник титрування кислотно-основного індикатору? Чому він дорівнює?
4.9.Яких правил дотримуються при виборі індикатору і при титруванні?
