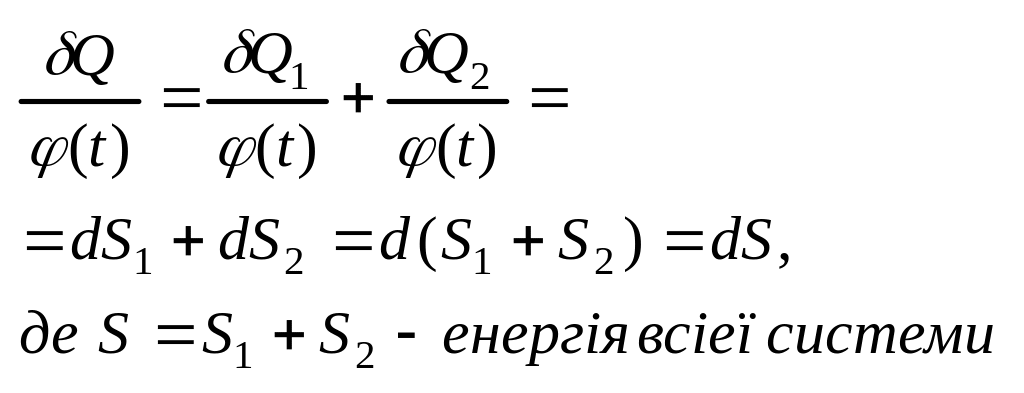- •1. Постулати термодинаміки, їх значення для обґрунтування термодинаміки.
- •2. Другий постулат термодинаміки. Рівняння стану, їх виведення для ід. Газу і парамагнетика.
- •3. Перше начало термодинаміки. Робота, енергія, теплота.
- •4. Друге начало термодинаміки для квазістат. Процесів. Мат. Обґрунтування існування ентропії.
- •5. Начало термодинаміки для нестац. Процесів. Імовірнісний зміст ентропії.
- •6. Зв'язок термічного і калорічного рівняння стану, приклади його застосування.
- •7. Заг. Властивості термодинамічних потенціалів, їх обґрунтування.
- •8.Термодинамічні потенціали для систем зі змінною кількістю частинок. Хім. Потенціал.
- •9. Загальні умови рівноваги і стійкості
- •11. Умови стійкості однорідної системи. Детермінанти і коефіцієнти стійкості.
- •12. Перша лема Гібса. Стат. Зміст коефіцієнтів стисливості. Відносна флуктуація енергії.
- •13. Третє начало термодинаміки
1. Постулати термодинаміки, їх значення для обґрунтування термодинаміки.
Тд-ка вивчає стан системи у рівновазі і при малому відхиленні від рівноваги, тобто нерівноважні процеси не вивчаються. Тд. рівновага означає, що:
1) Всі вел-ни на залежать від часу;
2) Люба система самостійно не вийде із стану рівноваги.
Якщо ці дві умови виконуються, то система знаходиться у рівновазі. Тд-ка базується на трьох постулатах і трьох началах.
Постулат 1
Люба ізольована система обов’язково прийде у стан тд. рівноваги. Цей стан буде називатися середнім значенням системи.
Постулат 2
Стан системи визначається сукупністю зовн. параметрів і темп-р.
![]()
Цей постулат вперше вводить темп-ру.
Постулат 3.
Енергія усієї (макроскопічної) системи складається із суми енергій її мікроскоп. частин.
Темп-ра
– це інтенсивний параметр. Тд-ка розглядає
внутр. енергію, яка складається з енергії
всіх взаємодій між частинками, енергії
в полі, рівнів енергії. Внутр. енергія![]() є
ф-цією стану системи:
є
ф-цією стану системи:
![]()
Таким чином зміна при зміні стану не залежить від шляху зміни стану. Зміна відбувається у формі роботи і формі тепла. Якщо зміна відбулася при зміні зовн. параметрів, то маємо роботу, а якщо без зміни зовн. параметрів – то теплоту. І робота, і теплота є формами зміни енергії, але енергією вони не являються. Робота і теплоті є ф-ціями процесу. Робота при ізохорному процесі одня, а при ізобарному – інша. Робота, теплота і енергія пов’язані між собою 1 началом тд-ки. Взаємодія між формами зміни енергії описується 2 началом тд-ки.
Стан
системи визначається двома видами
рівнянь стану. Їх існування витікає з
2го постулату тд-ки. Ф-ція стану визначається
повним диференціалом![]() ,
а ф-ція процесу – зміною
,
а ф-ція процесу – зміною
![]() ,
наприклад
,
наприклад![]() .
Ел-нтарна робота:
.
Ел-нтарна робота:
![]() де
де
![]() -
узагальнена тд. сила (
-
узагальнена тд. сила (![]() );
);
![]() -
тд. к-ната (
-
тд. к-ната (![]() ).
).
Якщо
на систему діє багато сил (система
знаходиться під тиском
![]() і у ел. полі
і у ел. полі
![]() ),
то робота дорівнює:
),
то робота дорівнює:
![]()
2. Другий постулат термодинаміки. Рівняння стану, їх виведення для ід. Газу і парамагнетика.
Якщо система задається внутр. енергією, то ї стан задається таким чином:
![]()
і таке рівняння наз-ть калорічним рівнянням стану.
Якщо стан системи задається тд. силами, то по 2му постулату:
![]() -
термічне рівняння
-
термічне рівняння
Кількість
цих рівнянь дорівнює кількості тд. сил.
Для того, щоб визначити тд. стан системи,
треба задати
![]() рівняння
стану. Розглянемо
рівняння
стану. Розглянемо
![]() систему
(на неї діє
,
параметрами стану є
систему
(на неї діє
,
параметрами стану є
![]() ).
Маємо рівняння стану:
).
Маємо рівняння стану:
![]()
і термічне рівняння:
![]()
Стан системи описується 2ма рівняннями. Якщо газ ідеальний, то для одного моля:
![]()
3. Перше начало термодинаміки. Робота, енергія, теплота.
Якщо система ізольована, то її енергія не змінюється. 1 начало тд-ки:
![]()
де
![]() -
дві форми енергії.
-
дві форми енергії.
![]()
Формули для роботи, теплоти, енергії:
4. Друге начало термодинаміки для квазістат. Процесів. Мат. Обґрунтування існування ентропії.
Квазістатичні процеси ідуть так повільно, що в деякий інтервал часу можна вважати, що деяка фіз. вел-на є сталою. Біля кожного стану рівноважної однорідної системи будуть існувати такі стани, які недосяжні адіабатично. Нехай є стани 1 і 2:
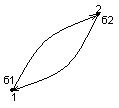
За 1шим началом тд-ки (до переходу 1-2):
![]()
Після адіабатичного переходу 1-2:
![]()
Складемо ці рівняння:
![]()
Робота була виконана без компенсації, а цього бути не може. Отже із стану 2 в 1 адіабатично перейти не можна. Робимо висновок, що існує деяка нова ф-ція стану:
![]() -
ентропія, де
-
ентропія, де
![]() -
емпірична темп-ра,
-
емпірична темп-ра,
![]() -
зовн. параметри,
-
зовн. параметри,
![]() -
параметри стану. В нашому процесі
-
параметри стану. В нашому процесі
![]() .
.
В
стані 1![]() ,
в стані 2
,
в стані 2
![]() ,
тобто перейти з стану 2 в 1 при
,
тобто перейти з стану 2 в 1 при![]() неможливо.
при адіабатному процесі
неможливо.
при адіабатному процесі
![]() .
.
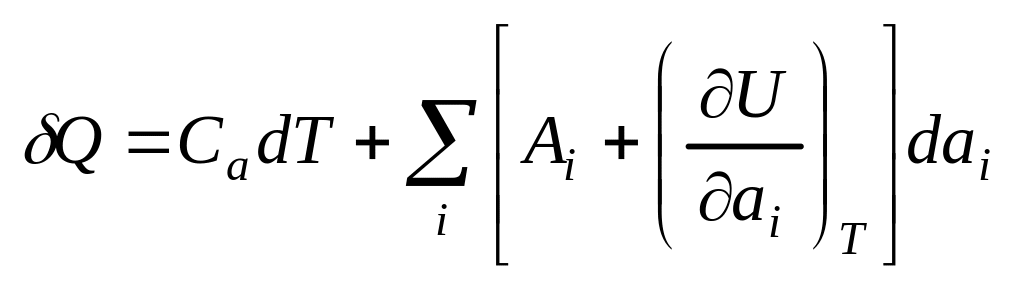
і![]() ,
і
,
і![]() залежать
від
залежать
від![]() сукупності
параметрів, тобто
сукупності
параметрів, тобто![]() .
Вони одночасно дорівнюють нулю в
адіабатному процесі.
.
Вони одночасно дорівнюють нулю в
адіабатному процесі.
![]()
![]() де
де
- ф-ція стану, - ф-ція процесу.
З
мат. аналізу відомо, що якщо ф-ція не є
повним диференціалом, то її можна зробити
повним диференціалом. Якщо виберемо
такй множник, що залежить лише від
:![]() ,
то можна
показати,
що вигляд функції
,
то можна
показати,
що вигляд функції
![]() буде
різним в залежності від того, яку
емпіричну температуру ми виберемо. Для
різних емпіричних температур функції
буде
різним в залежності від того, яку
емпіричну температуру ми виберемо. Для
різних емпіричних температур функції
![]() матимуть
різний вигляд
матимуть
різний вигляд
![]() але
абсолютна температура, що відповідає
цим емпіричним, є однією і тією самою.
але
абсолютна температура, що відповідає
цим емпіричним, є однією і тією самою.
![]()
Якщо
![]() ,
то функція стану зветься ентропією.
,
то функція стану зветься ентропією.
![]() -
визначення 2-го начала термодинаміки.
-
визначення 2-го начала термодинаміки.
![]() ,
де Т- термодинамічна сила, S-координата.
,
де Т- термодинамічна сила, S-координата.![]() .
Якщо процес адіабатичний
то
.
Якщо процес адіабатичний
то
![]()
![]()
Тобто
при квазістатичних процесах в ізольваній
системі
![]() не
змінюється.
не
змінюється.
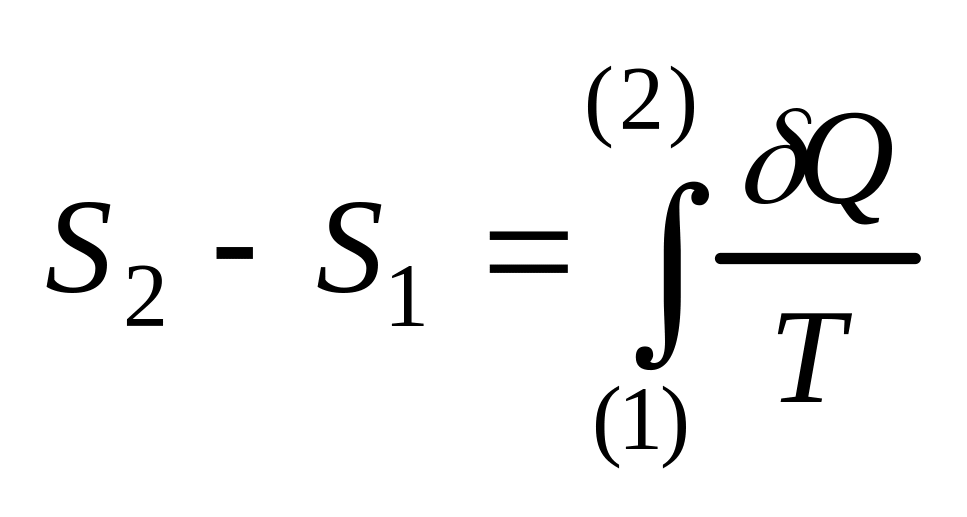 -
формула для обчислення ентропії, (1)
-
формула для обчислення ентропії, (1)
і (2) – стани.
2-м
началом термодинаміки обчислюємо
абсолютне значення
,
а її зміну. Для того, щоб знайти абсолютне
значення
,
треба ввести деякий детермінований
стан.(тобто стан в якому ми знаємо
значення
).
Таким чином є стан біля абсолютного
нуля (![]() ).
Тоді інтеграл береться від (0).
).
Тоді інтеграл береться від (0).
З
принципу адіабатичної недосяжності
отримали, що диференційну форму![]() можна
зробити повним диференціалом діленням
на інтегруючий дільник
можна
зробити повним диференціалом діленням
на інтегруючий дільник
![]() .Покажемо,
що серед усіх
існують
такий, що залежить лише від емпіричної
температури t,
тобто
.Покажемо,
що серед усіх
існують
такий, що залежить лише від емпіричної
температури t,
тобто
![]() ,
і визначає ентропію
,
і визначає ентропію![]() системи,
причому головне значення
системи,
причому головне значення
![]() не
залежить від вибору
.
не
залежить від вибору
.
Існування
.
Нехай є дві підсистеми, що знаходяться
в тепловій рівновазі. Стан 1-ї визначається
параметрами
![]()
другої![]() всієї
системи в
цілому
–параметрами
всієї
системи в
цілому
–параметрами
![]()
![]() .
Нехай в деякому рівноважному процесі
системам надали теплоти
.
Нехай в деякому рівноважному процесі
системам надали теплоти
![]() і
і
![]() ,
,
![]() (1)
(1)
Усі
ці елементи головні:
![]()
![]() ,
де
,
де
![]()
![]()
![]() -
інтегруючі дільники;
-
інтегруючі дільники;
![]() і
і
![]() -
функції стану систем, їх можна взяти в
якості незалежних змінних кожної з
систем, наприклад замість
-
функції стану систем, їх можна взяти в
якості незалежних змінних кожної з
систем, наприклад замість
![]() і
і![]() :
:
![]()
![]()
![]()
![]()
(3)
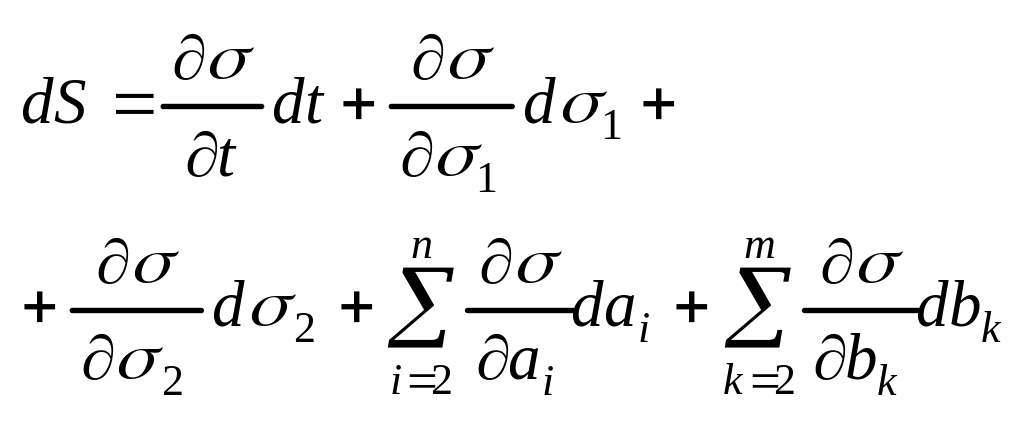
З
(1) і (2) маємо
![]() (4)
(4)
З
(3) і (4) маємо
![]()
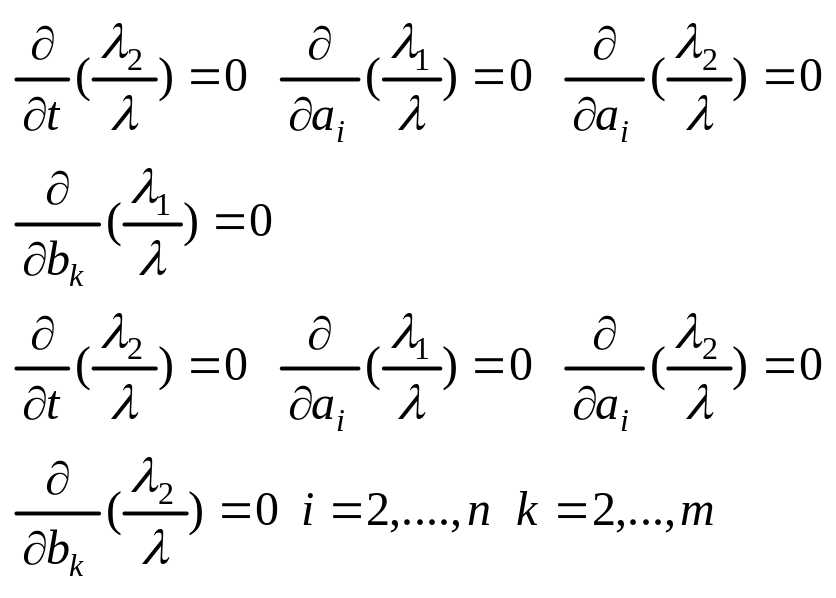
З 3 – ї і 4 – ї рівності маємо
![]()
![]()
![]()
Оскільки
![]() не
залежить від
не
залежить від
![]() ,
а
,
а
![]() від
від
![]() то
з рівностей 5-8 маємо , що
то
з рівностей 5-8 маємо , що
![]() не
залежить від
і
,
від
,
від
.Тоді
не
залежить від
і
,
від
,
від
.Тоді
![]()
![]()
![]()
Функції
![]() і
і![]() ,
,![]() довільні.
Можемо підібрати функції
довільні.
Можемо підібрати функції
![]() так,
що
так,
що
![]()
є
однаковим для всіх систем, що знаходяться
в тепл. рівновазі. Функція
![]() ,
що визначається рівнянням
,
що визначається рівнянням
![]()
![]() називається
ентропією 1-ї системи, відповідно
називається
ентропією 1-ї системи, відповідно
![]() ,
що
,
що
Ввиводиться
з рівняння
![]()