
- •1. Постулати термодинаміки, їх значення для обґрунтування термодинаміки.
- •2. Другий постулат термодинаміки. Рівняння стану, їх виведення для ід. Газу і парамагнетика.
- •3. Перше начало термодинаміки. Робота, енергія, теплота.
- •4. Друге начало термодинаміки для квазістат. Процесів. Мат. Обґрунтування існування ентропії.
- •5. Начало термодинаміки для нестац. Процесів. Імовірнісний зміст ентропії.
- •6. Зв'язок термічного і калорічного рівняння стану, приклади його застосування.
- •7. Заг. Властивості термодинамічних потенціалів, їх обґрунтування.
- •8.Термодинамічні потенціали для систем зі змінною кількістю частинок. Хім. Потенціал.
- •9. Загальні умови рівноваги і стійкості
- •11. Умови стійкості однорідної системи. Детермінанти і коефіцієнти стійкості.
- •12. Перша лема Гібса. Стат. Зміст коефіцієнтів стисливості. Відносна флуктуація енергії.
- •13. Третє начало термодинаміки
5. Начало термодинаміки для нестац. Процесів. Імовірнісний зміст ентропії.
Для нерівноважної системи:
![]()

Перейдемо зі стану 1 в стан 2 нестатично, а потім квазістатично. В першому випадку повернутись в стан 1, не змінюючи окіл, неможливо, а у другому – можливо.
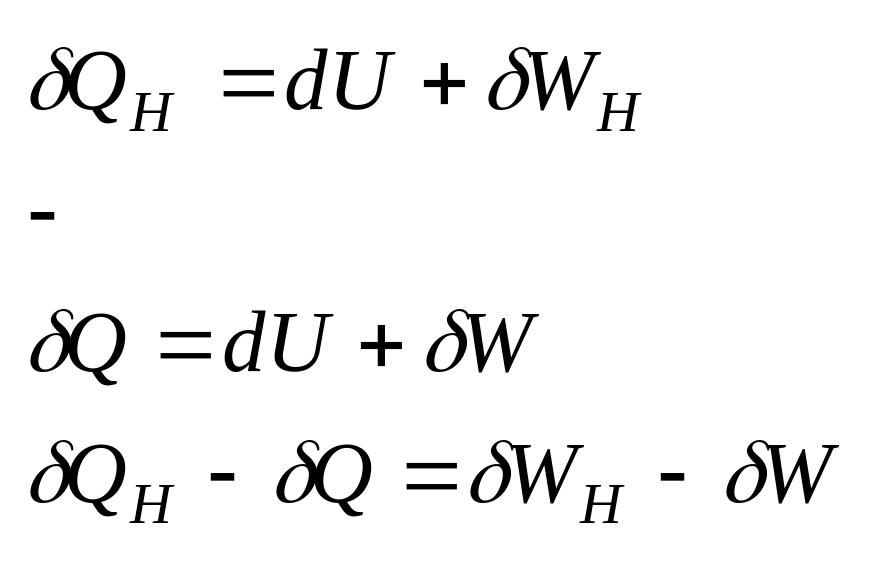
У другому випадку системі надали тепло, і вона виконала роботу. Робота призвеладо виділення тепла
![]()
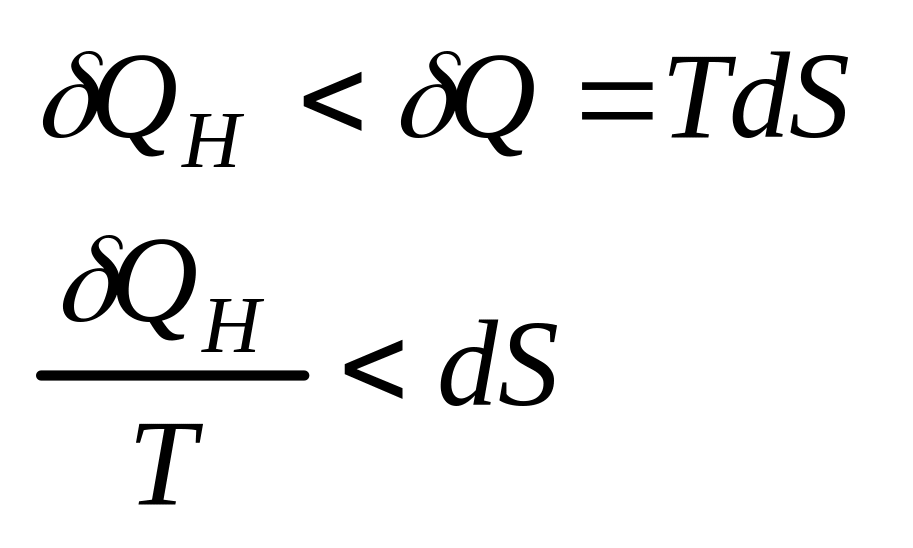
Якщо
система адіабатично ізольована, то
![]() .
Тоді
.
Тоді
![]() .
В неізольованій системі можна примусити
спадати.
Нерівність Клазіуса:
.
В неізольованій системі можна примусити
спадати.
Нерівність Клазіуса:
![]()
Ентропія
– ф-ція стану, і цей інтеграл не є мірою
зміни ентропії. Для того, щоб обчислити
![]() ,
систему треба перевести зі стану 1 в
стан 2 рівноважно.
,
систему треба перевести зі стану 1 в
стан 2 рівноважно.
Співвідношення Планка-Гіббса:
![]() ,
де
,
де
![]() -
тд. ймовірність. Це число мікростанів
системи, які відповідають одному й тому
ж макростану.
-
тд. ймовірність. Це число мікростанів
системи, які відповідають одному й тому
ж макростану.
6. Зв'язок термічного і калорічного рівняння стану, приклади його застосування.
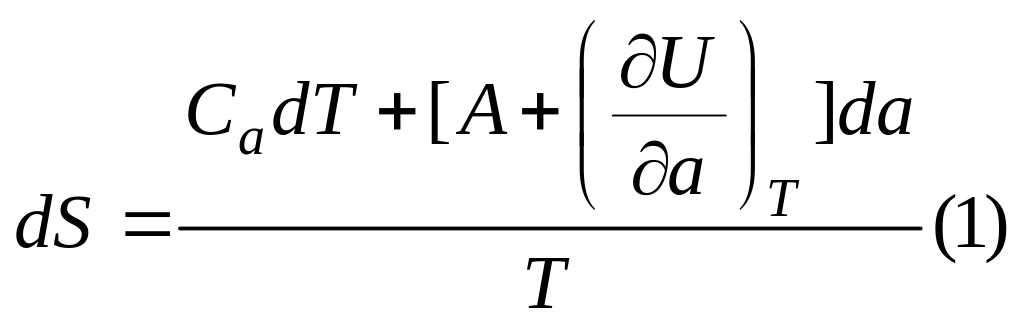
S-функція стану .
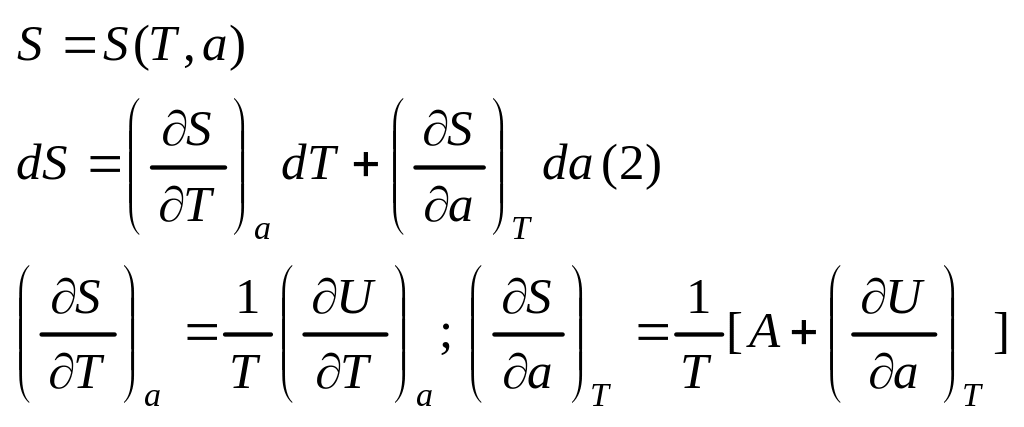 Виконаємо
ту властивість, що мішані похідні
дорівнюють :
Виконаємо
ту властивість, що мішані похідні
дорівнюють :
![]()
(*)![]() -
зв'язок термічного і калорійного рівняння
стану. Це рівняння буде використано для
отримання калорічного рівняння із
термічного.
-
зв'язок термічного і калорійного рівняння
стану. Це рівняння буде використано для
отримання калорічного рівняння із
термічного.
Термічне рівняння стану як правило відомо.
Калорічне знаходиться важко.
(*) (для P-V-T системи)
![]()
P=P(T,V)-дано
U=U(T,V)-знайти
рV=RT
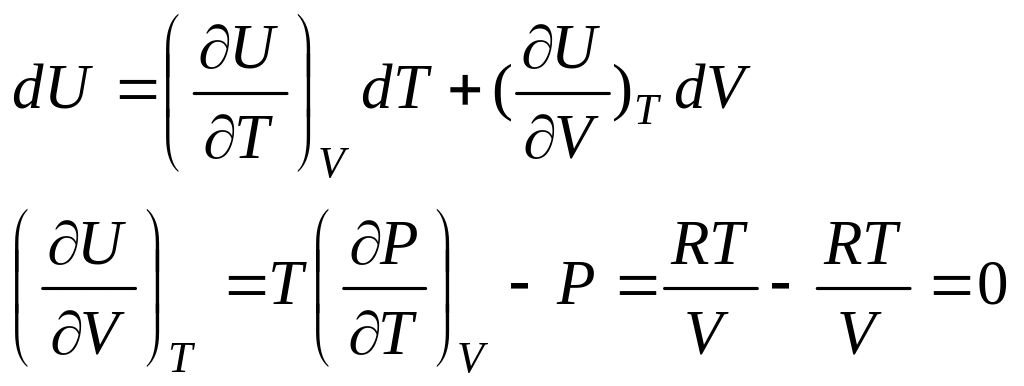
![]() для
ідеального газу
для
ідеального газу
![]()
![]() -
калорічне рівняння
-
калорічне рівняння
Внутрішня енергія дуже розрідженого ідеального газу не залежить від об’ему . Для газу Ван-дер-Ваальса
![]() а
і б сталі В-д-В
а
і б сталі В-д-В
При рівноважних процесах ентропія постійна.
7. Заг. Властивості термодинамічних потенціалів, їх обґрунтування.
Термодинаміка має технічний метод (циклів), аналітичний (потенціалів). Термодинамічні потенціали (або характеристичні функції) описують власні стани у певних умовах. Всі потенціали мають 3 загальні властивості:
1)вони є однозначними функціями стану;
2)зменшення потенціалу дорівнює роботі, яку виконує система у певних умовах;
3)всі потенціали в стані рівноваги мінімальні.
Щоб ввести потенціали, будемо виходити з основного рівняння термодинаміки P-V-T системи:
![]()
1)Умови виділення системи з околу:
S, V=const (це незалежні змінні)
U=U(S,V) (у цьому ізольованому околі ідуть лише адіабатичні і ізохорні процеси)
dU=TdS-PdV (#) – диференціальне співвідношення для повної енергії.
2)Якщо розглянемо адіабатичний процес, то
dU=-PdV=![]()
![]() (робота
= зменшенню потенціалу внутрішньої
енергії).
3(#):
(робота
= зменшенню потенціалу внутрішньої
енергії).
3(#):
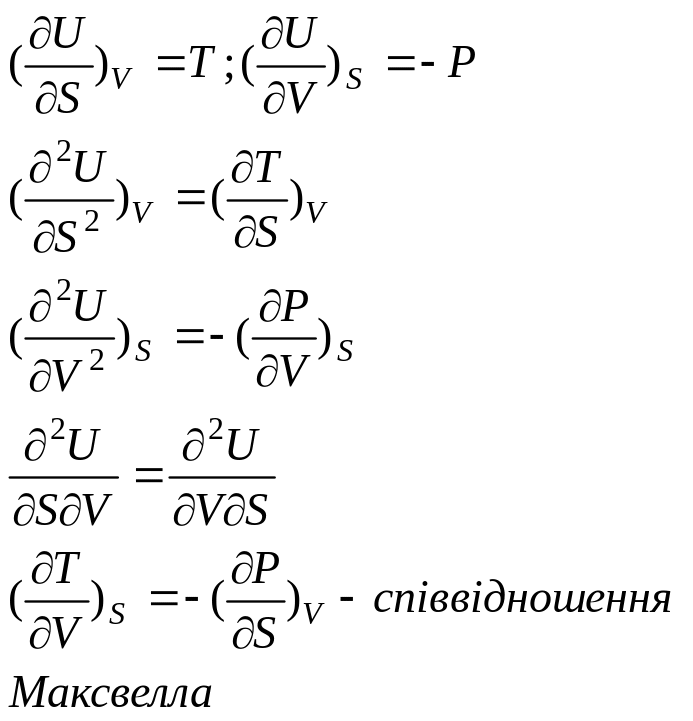
Системи характеризують CP, CV стисливість (P(T),P(V)), T(P), T(V).

Ці висновки відрізняються ізохорним і адіабатичним процесами.
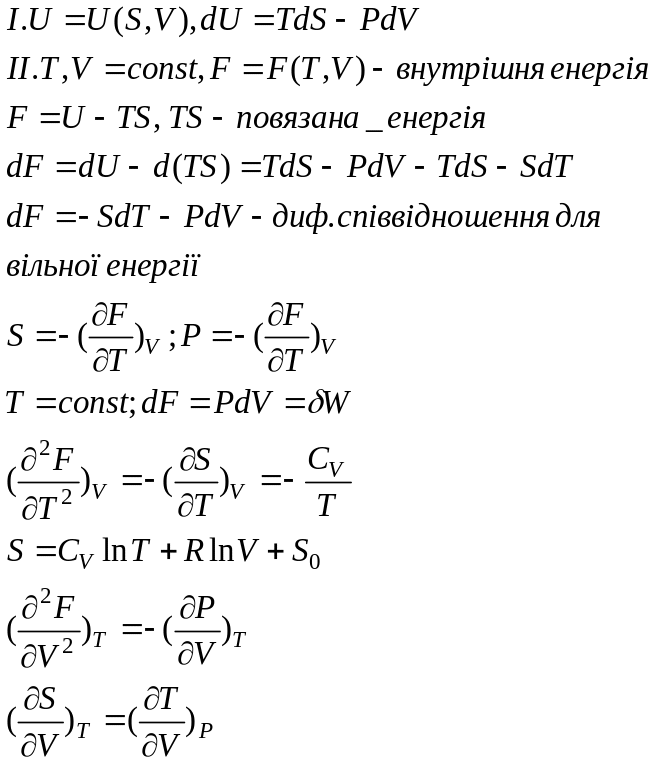
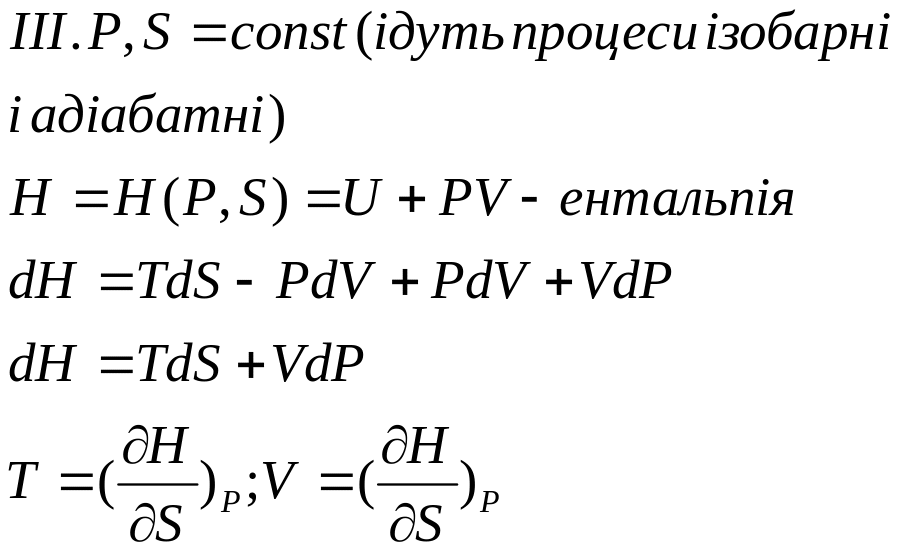
Робота при певних умовах дорівнює зменшенню потенціалу.
Якась енергія
![]()
U – енергія газу
PV – енергія поршня
![]()
При
адіабатному процесі S=const,
![]()
Для поширеної системи робота є –VdP. Бачимо, що ця енергія і є ентальпія.

IV. Незалежні змінні T, P=const (ці умови легше всього підтримувати практично)
![]() -
енергія Гібса
-
енергія Гібса
![]()
![]()
Якщо
![]() ,
то
,
то
![]()
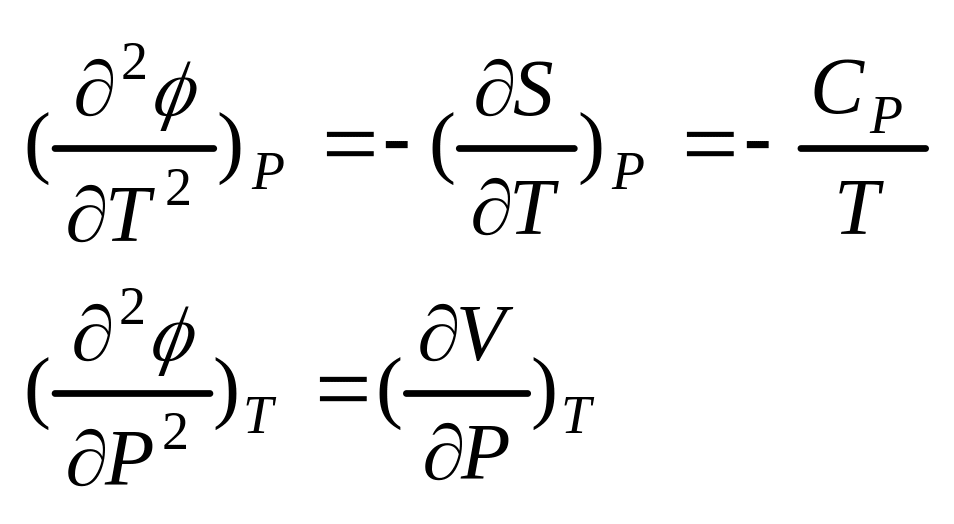
![]() -
рівність Максвела
-
рівність Максвела
Потенціали дають можливість знайти величини системи у певних умовах(знайти термічне поширення, стисливість…)
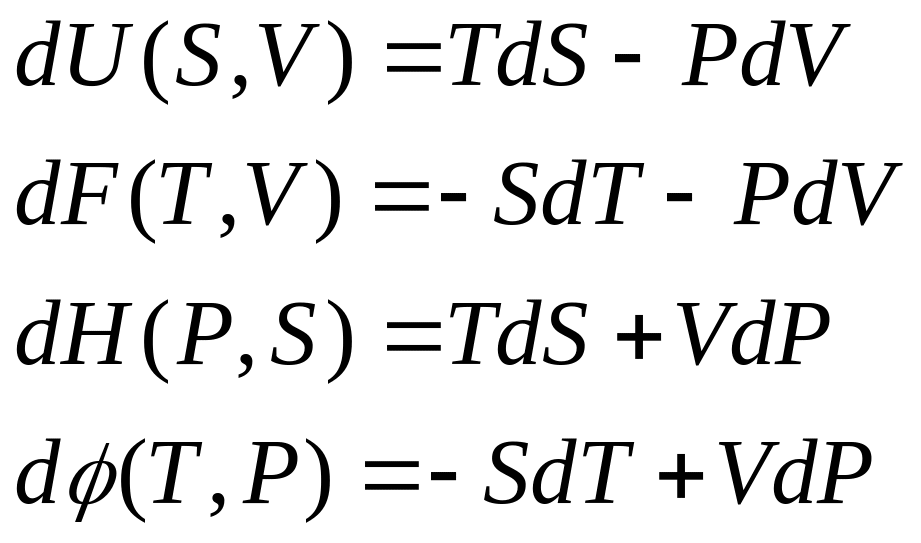
Т.д потенціали для P-V-T системи при сталій кількості частинок. Всі потенціали з осн. рівняння термодинаміки для квазістатичних процесів.
