
- •1)Биогенные элементы.Классификация, участие в химических процессах в организме.
- •2) Человек и биосфера. Понятие об эндемических заболеваниях, микроэлементозах.
- •3) Характеристика кислотно-основных, о-в, комплексообразовательных свойств соединений s, p, d-элементов.
- •2.3.1. Окислительно-восстановительные свойства
- •2. 3. 2. Кислотно-основные свойства (свойства оксидов и гидроксидов, образуемых d–элементами)
- •2.3.3. Реакции комплексообразования
- •4) Химические св-ва одно-, двух- и трёхатомных спиртов, кислотно-основные, электрофильные-с-алкилирование, с-ацетилирование, окисления. Написать уравнения реакций.
- •Свойства спиртов
- •Реакции с разрывом связи о—н:
- •Реакции, сопровождающиеся разрывом связи с—о:
- •5) Химические свойства одно-, двух- и трёхатомных фенолов, кислотно-основные, электрофильные: с-алкилирование, с-ацетилирование, окисление, восстановление. Напишите уравнения реакций.
- •9. Химические свойства фенола (карболовой кислоты)
- •I. Свойства гидроксильной группы
- •II. Свойства бензольного кольца
- •2). Гидрирование фенола
- •III. Качественная реакция - обнаружение фенола
- •6) Химические свойства кетонов, альдегидов: реакции нуклеофильного присоединения, восстановления, окисления. Уравнения реакций.
- •10) Олигосахариды.Дисахариды мальтоза, целлобиоза, лактоза, сахароза.Строение, номенклатура, цикло-оксо-таутомерия. Восстанавливающие свойства. Гидролиз кислотный и ферментативный.
- •2. Дисахариды
- •2.1. Строение
- •2.2. Химические свойства
- •13) Строение, номенклатура, стереоизомерия аминокислот.Классификация аминокислот: химические (по природе радикала и содержащихся в нём заместителей, по полярности радикалов) и биолгическая.
- •3.3. Кислотно-основные свойства.
- •15) Строение, номенклатура, образование аминокислот из кетокислот (восстановительное амминирование и трансамминирование)
- •3.4. Реакции аминокислот in vivo
- •17) Понятие о белках.Классификация белков(химическая и биологическая) Биологическая роль белков. Строение и свойства пептидной связи.
- •18) Уровни структурной организации белков. Уровни организации
5) Химические свойства одно-, двух- и трёхатомных фенолов, кислотно-основные, электрофильные: с-алкилирование, с-ацетилирование, окисление, восстановление. Напишите уравнения реакций.
Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):
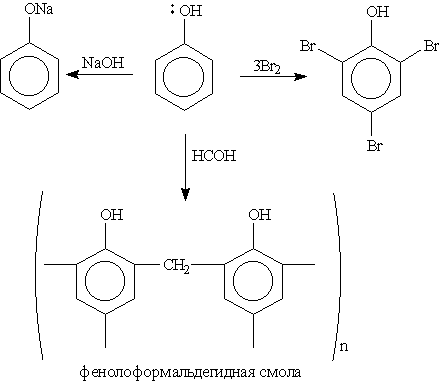
1. Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название “карболовая кислота”):
![]()
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол — такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:
![]()
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов фонолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
![]()
3. Галогенирование. При действии на фенол бромной воды образуется осадок 2,4,6-трибромфенола:
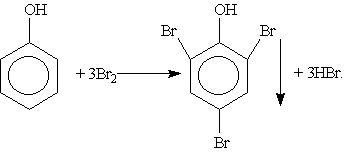
Это — качественная реакция для обнаружения фенола.
4. Нитрование. Под действием 20% -ной азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. Если нитровать фенол концентрированной азотной кислотой, то образуется 2,4,6-тринитрофенол — сильная кислота (пикриновая).
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:
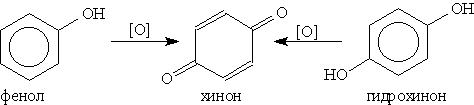
ИЛИ
9. Химические свойства фенола (карболовой кислоты)
I. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
С активными металлами-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
фенолят натрия
Со щелочами -
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2-, Br-)
C6H5-OH< п-нитрофенол < 2,4,6-тринитрофенол |
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
