
- •1)Биогенные элементы.Классификация, участие в химических процессах в организме.
- •2) Человек и биосфера. Понятие об эндемических заболеваниях, микроэлементозах.
- •3) Характеристика кислотно-основных, о-в, комплексообразовательных свойств соединений s, p, d-элементов.
- •2.3.1. Окислительно-восстановительные свойства
- •2. 3. 2. Кислотно-основные свойства (свойства оксидов и гидроксидов, образуемых d–элементами)
- •2.3.3. Реакции комплексообразования
- •4) Химические св-ва одно-, двух- и трёхатомных спиртов, кислотно-основные, электрофильные-с-алкилирование, с-ацетилирование, окисления. Написать уравнения реакций.
- •Свойства спиртов
- •Реакции с разрывом связи о—н:
- •Реакции, сопровождающиеся разрывом связи с—о:
- •5) Химические свойства одно-, двух- и трёхатомных фенолов, кислотно-основные, электрофильные: с-алкилирование, с-ацетилирование, окисление, восстановление. Напишите уравнения реакций.
- •9. Химические свойства фенола (карболовой кислоты)
- •I. Свойства гидроксильной группы
- •II. Свойства бензольного кольца
- •2). Гидрирование фенола
- •III. Качественная реакция - обнаружение фенола
- •6) Химические свойства кетонов, альдегидов: реакции нуклеофильного присоединения, восстановления, окисления. Уравнения реакций.
- •10) Олигосахариды.Дисахариды мальтоза, целлобиоза, лактоза, сахароза.Строение, номенклатура, цикло-оксо-таутомерия. Восстанавливающие свойства. Гидролиз кислотный и ферментативный.
- •2. Дисахариды
- •2.1. Строение
- •2.2. Химические свойства
- •13) Строение, номенклатура, стереоизомерия аминокислот.Классификация аминокислот: химические (по природе радикала и содержащихся в нём заместителей, по полярности радикалов) и биолгическая.
- •3.3. Кислотно-основные свойства.
- •15) Строение, номенклатура, образование аминокислот из кетокислот (восстановительное амминирование и трансамминирование)
- •3.4. Реакции аминокислот in vivo
- •17) Понятие о белках.Классификация белков(химическая и биологическая) Биологическая роль белков. Строение и свойства пептидной связи.
- •18) Уровни структурной организации белков. Уровни организации
13) Строение, номенклатура, стереоизомерия аминокислот.Классификация аминокислот: химические (по природе радикала и содержащихся в нём заместителей, по полярности радикалов) и биолгическая.
Стереоизомерия. Принцип построения аминокислот, т. е. нахождение у одного и того же атома углерода двух различных функциональных групп, радикала и атома водорода, уже сам по себе предопределяет хиральность альфа-атома углерода. Исключение составляет простейшая аминокислота глицин Н2N-СН2-СООН, не имеющая углеводородного радикала R и соответственно центра хиральности. Относительная конфигурация аминокислот определяется как и у гидроксикислот по конфигурационному стандарту — глицериновому альдегиду — с использованием гидроксикислого ключа. Расположение в стандартной проекционной формуле Фишера аминогруппы слева (подобно ОН-группе в L-глицериновом альдегиде) ответствует L-конфигурации, справа — D-конфигурации хирального атома углерода. По R,S-системе обозначений углеродный атом у всех аминокислот L-ряда имеет S-, а у D-ряда — R-конфигурацию (исключение составляет цистеин).
Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные аминокислоты принадлежат к L-ряду.

Изолейцин, треонин, 4—гидроксипролин — содержат в молекуле по два центра хиральности. Эти аминокислоты могут существовать в виде четырех диастереомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Из этих четырех стереоизомеров для построения белков человеческого организма используется только один.
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде:
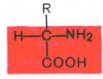
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (рI) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.
14) Кислотно-основные свойства альфа-аминокислот. Понятие об изоэлектрическом состоянии и изоэлектрической точке, электрофоретическом разделении аминокислот.Поясните на примере глицына, лизина, глутаминовой кислоты.
