
1. Предмет и методы термодинамики. Основные понятия и определения. Параметры состояния и уравнение состояния идеальных газов. Термодинамика рассматривает закон сохранения энергии применительно к процессам сопровождающимся выделением или поглощением теплоты – общие тепловые процессы. Термодинамика основана на 3х. законах: 1) Частный случай закона превращения и сохранения энергии. 2) Рассматривает направление процесса. 3) Определяет недостижимость абсолютного нуля температур. Различают термодинамику: 1) Общую в её курсе разрабатывают теоритические основы термодинамики. 2) Химическая термодинамика рассматривает хим. и физикохим. превращения в различных процессах. 3) Техническая термодинамика рассматривает закономерности взаимного превращения теплоты в работу, устонавливает взаимосвязь между тепловыми, механическими и хим. процессами кот. совершаются в тепловых и холодильных машинах. 4) Изучает рабочии тела и их св-ва.
Удельный объем–величина, определяемая отношением объема вещества к его массе, υ = V / m , [м3/кг]
Плотность вещества–величина, определяемая отношением массы к объему вещества, ρ = m / V , [кг/м3]
Давление–с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа о стенку сосуда, в котором заключен газ, Р = F / S , [Па] = [Н/м2]. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды. Абсолютное давление (Р)– давление отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является т/д параметром состояния. Абсолютное давление определяется: 1). При давлении сосуда больше атмосферного:
Р = Ри + Ро ; 2). При давлении сосуда меньше атмосферного: Р = Ро + Рв ; где Ро – атмосферное давление; Рв – давление вакуума.
Температура–характеризует степень нагретости тел, представляет собой меру средней кинетической энергии поступательного движения его молекул. Чем больше средняя скорость движения, тем выше температура тела. Tну=0.
Идеальный газ-газ состоящий из движущихся частиц размер которых мал по сравнению с обьемом газа и силами взаимодействия между которыми можно принибреч.
Закон Бойля-Мариота Т=const, m= const следовательно pV= const.
Закон Гей-Люсака р= const, m= const след. V/T= const.
(P*V)/T= const, PV=RT-уравнение для 1го кг вещества. R=8314/M – удельная газовая постоянная.
PV=mRT – для произвольной массы вещества.
2.Смеси идеальных газов. Способы задания, расчет основных характеристик. Смесью наз. Химически нереагирующие газы подчиняющиеся закону Дальтона-(Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.). Давление в смеси = сумме парциальных давлений, компонент смеси. Парциальным наз. Давление которое имел бы газ занимая весь объём смеси в отсутствии других газов при температуре смеси.
Рсм
= ΣPi
, gi=mi/mсм
, ri=Vi(n)/Vсм
, Vi(n)-
порациональней объём компоненты.
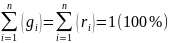 .
На основании уравнения состояния
получают Pi/
Рсм=
Vсм/
Vi=µi/
µсм=Rсм/Ri.
µсм
– молярная масса.
.
На основании уравнения состояния
получают Pi/
Рсм=
Vсм/
Vi=µi/
µсм=Rсм/Ri.
µсм
– молярная масса.
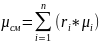 .
.
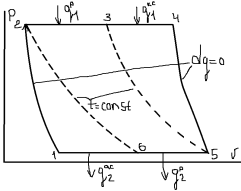
16. ТДА цикла д.в.с. с подводом теплоты при V=const. Цикл Отто. Поршень компрессора движется в право, раб. Объем заполняется топливовоздушной смесью (0-1). При обратном движении поршня смесь сжимается процесс происходит очень быстро и теплота выделившееся при сжатии не успевает рассеяться через стенки цилиндра. Поэтому процесс 1-2 считают адиабатным (S) сжатием.

1-2:
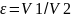 ,
Ɛ-степень сжатия, представляет собой
отношение удельных объемов в начале и
в конце адиабатного сжатия. В т2 Происходит
зажигание рабочей смеси. Хорошо
подогретая смесь сгорает почти мгновенно
и поршень неуспевает отклониться от
своего положения поэтому процесс 2-3
счит. изохорным (V)
подводом теплоты. 2-3:
,
Ɛ-степень сжатия, представляет собой
отношение удельных объемов в начале и
в конце адиабатного сжатия. В т2 Происходит
зажигание рабочей смеси. Хорошо
подогретая смесь сгорает почти мгновенно
и поршень неуспевает отклониться от
своего положения поэтому процесс 2-3
счит. изохорным (V)
подводом теплоты. 2-3:
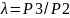 ,
,
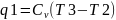 ,
,
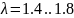 .
В результате возросшего давления
поршень перемешается в право, раб. Тело
расширяется в адиабатном процессе 3-4.
В процессе 4-1 продукты сгорания
выбрасываются в окр. среду и давление
понижается до атмосферного. 4-1:
.
В результате возросшего давления
поршень перемешается в право, раб. Тело
расширяется в адиабатном процессе 3-4.
В процессе 4-1 продукты сгорания
выбрасываются в окр. среду и давление
понижается до атмосферного. 4-1:
 ,
,
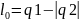 .
т1:
условно
известна.
т2:
1-2 S=const,
.
т1:
условно
известна.
т2:
1-2 S=const,
 .
т3:
2-3 V=const,
.
т3:
2-3 V=const,
 .
т4:
3-4 S=const,
.
т4:
3-4 S=const,
 .
.
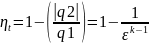 .
Термический
КПД можно увеличить если увеличить
степень сжатия. Чтобы не завесить от
температуры самовоспламенения было
преддложено подовать и сжимать чистый
воздух. Общий недостаток всех циклов
ДВС заключается в том, что продукты
сгорания расширяются до атмосферного
давления за приделами установки – это
приводит к потери работы работы кот.
можно было бы получить осушествив
расширение в самом двигателе.
.
Термический
КПД можно увеличить если увеличить
степень сжатия. Чтобы не завесить от
температуры самовоспламенения было
преддложено подовать и сжимать чистый
воздух. Общий недостаток всех циклов
ДВС заключается в том, что продукты
сгорания расширяются до атмосферного
давления за приделами установки – это
приводит к потери работы работы кот.
можно было бы получить осушествив
расширение в самом двигателе.
17. ТДА цикла д.в.с. с подводом теплоты при P=const. Цикл дизеля.
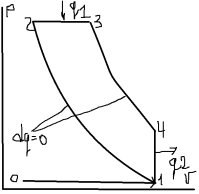
Чтобы
не завесить от температуры самовоспламенения
было преддложено подовать и сжимать
чистый воздух. 0-1,1-2: подача и сжатие
чистого воздуха.
 .
Темп. в т2 выше темп. самовоспламенения
смеси на 200-250 градусов. 2-3: Процесс
изобарного (P)
сжигания топлива.
.
Темп. в т2 выше темп. самовоспламенения
смеси на 200-250 градусов. 2-3: Процесс
изобарного (P)
сжигания топлива.
 ,
,
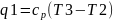 .
.
5.
Исследование изохорного процесса
идеальных газов.
V=const,
P/T=const. В
изохорных процессах давление газа
пропорционально абсолютной температуре.
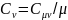 теплоемкость Дж/кг*к.
теплоемкость Дж/кг*к.
Изменение
энтропии
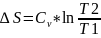 .
.
![]()
Поскольку
в изохорном процессе dv=0,
то работа тоже l=0
и вся подведенная теплота идет на
изминение внутренней энергии
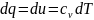 ,
,
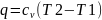 .
.
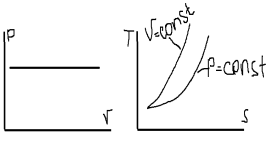
6. Исследование изобарного процесса идеальных газов. P=const; V/T= const.
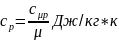 – Теплоёмкость.
– Теплоёмкость.
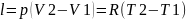 ,
,
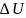 – изменение внутренней энергии
– изменение внутренней энергии
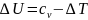 .
Количество теплоты
.
Количество теплоты
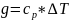 .
Изменение энтропии
.
Изменение энтропии
 .
Теплота в изобарном процессе идет на
изменение энтальпии
.
Теплота в изобарном процессе идет на
изменение энтальпии
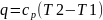 .
.
7. Исследование изотермического процесса идеальных газов. T=const, PV= const. При изотермическом расширении давление газа падает.
![]()
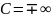 -
теплоемкость.
-
теплоемкость.
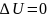 ;
;
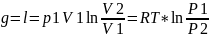 ,
Изменение энтропии
,
Изменение энтропии
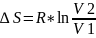 .
∞Изотермический процесс является для
идеальных газов одновременно процессом
при постоянной внутренней энергии и
энтальпии. Вся поглощаемая газом теплота
в изотермическом процессе превращается
в работу расширения.
.
∞Изотермический процесс является для
идеальных газов одновременно процессом
при постоянной внутренней энергии и
энтальпии. Вся поглощаемая газом теплота
в изотермическом процессе превращается
в работу расширения.
8.
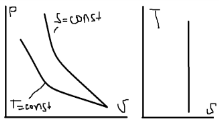
Исследование адиабатного процесса
идеальных газов.
Адиабатный наз. Процесс проходящий без
теплообмена с окружающей средой. dg=0.
 ,
S=const.
,
S=const.
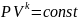 ,
,
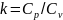 – показатель адиабаты. Поскольку
– показатель адиабаты. Поскольку
 ,
то показатель адиабаты
,
то показатель адиабаты
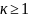 и он практически не зависит от температуры,
а его значение определяется лишь
атомарностью газа. В идеальном газе
нет сил внутреннего трения поэтому
адиабатный процесс рассматривается
как изоэнтропийный. S=const.
и он практически не зависит от температуры,
а его значение определяется лишь
атомарностью газа. В идеальном газе
нет сил внутреннего трения поэтому
адиабатный процесс рассматривается
как изоэнтропийный. S=const.
С=0,
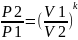 ,
,
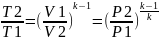 .
Работа в адиабатном процессе осуществляется
за счет изменения внутренней энергии.
.
Работа в адиабатном процессе осуществляется
за счет изменения внутренней энергии.
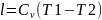 .
.
19. Цикл ГТУ с изобарным подводом теплоты. (Р).


В
компрессор поступает воздух из окр.
среды и адиабатно (S=const)
сжимается в процессе 1-2, т2: Ɛ=V1/V2.
Сжатый воздух поступает в камеру
сгорания куда из топливного бака
непрерывно подается жидкое топливо.
Топливо сгорает в процессе 2-3 и если не
учитывать сопротивление то продукты
сгорания имеют такое же давление, что
и сжатый воздух. 2-3: Изобарный P=const,
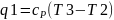 ,
.
Продукты сгорания поступают в газовую
турбину и адиабатно расширяясь совершают
работу на лопатках турбины, процесс
3-4. Отработавшие продукты сгорания
отводятся в окружающую среду. Процесс
4-1 условный процесс отвода теплоты в
окружающую среду,
,
.
Продукты сгорания поступают в газовую
турбину и адиабатно расширяясь совершают
работу на лопатках турбины, процесс
3-4. Отработавшие продукты сгорания
отводятся в окружающую среду. Процесс
4-1 условный процесс отвода теплоты в
окружающую среду,
 .
Весь перепад давления (Р2-Р1) используется
для получения технической работы в
турбине. Часть этой работы расходуется
на привод компрессора, а разность этих
работ превращается в электроэнергию
или затрачивается на другие цели. Это
разность состовляет полезную работу
цикла (lТ-lk).
.
Весь перепад давления (Р2-Р1) используется
для получения технической работы в
турбине. Часть этой работы расходуется
на привод компрессора, а разность этих
работ превращается в электроэнергию
или затрачивается на другие цели. Это
разность состовляет полезную работу
цикла (lТ-lk).
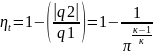 .
π=Р2/Р1 – Степень повышения давления.
Для адиабатного процесса π=Ɛк-1.
КПД газотурбинной установки можно
повысить увеличивая степень давления.
В ГТУ в т4 температура достаточно высокая
поэтому отработавшие продукты сгорания
можно использовать для подогрева
воздуха поступающего в камеру сгорания.
.
π=Р2/Р1 – Степень повышения давления.
Для адиабатного процесса π=Ɛк-1.
КПД газотурбинной установки можно
повысить увеличивая степень давления.
В ГТУ в т4 температура достаточно высокая
поэтому отработавшие продукты сгорания
можно использовать для подогрева
воздуха поступающего в камеру сгорания.
20. Цикл гту с регенерацией теплоты.
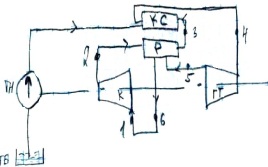
11.
Второй закон термодинамики, его сущность
и определения.
Определяет направление процесса и
максимальную работу которая может быть
совершена тепловыми двигателями.
 ,
dS-Элементарное
преращение энтропии системы. q-теплота
участвующая в процессе и подводимая
от источника к системе, Т-абсолютная
температура источника теплоты. Знак
равенства в уравнении соответствует
обратимым процессам, а знак неравенства
к необратимым.
,
dS-Элементарное
преращение энтропии системы. q-теплота
участвующая в процессе и подводимая
от источника к системе, Т-абсолютная
температура источника теплоты. Знак
равенства в уравнении соответствует
обратимым процессам, а знак неравенства
к необратимым.
Формулировки закона: 1) Вся теплота теплота переданная источником не может перейти в работу т.к. часть теплоты должна быть отдана холодильнику. 2) теплота не может переходить от менее нагретого тела к более нагретому без совершения работы. 3) Осуществление вечного двигателя 2го рода невозможно.
В
природе все процессы являются
необратимыми, а наиболее близко к
обратимому процесс конденсации
парообразования.
 – для обратимого процесса.
– для обратимого процесса.
 .
Колличество
теплоты определяется по площади под
кривой процесса изобарного в TS
координатах, при этом если энтропия
увеличиться S2>S1,
то теплота подводиться, а если энтропия
уменьшается S2<S1,
то теплота отводиться.
.
Колличество
теплоты определяется по площади под
кривой процесса изобарного в TS
координатах, при этом если энтропия
увеличиться S2>S1,
то теплота подводиться, а если энтропия
уменьшается S2<S1,
то теплота отводиться.
12. Физическая сущностью энтропии. Особенности Т-S диаграммы. Изображение термодинамических процессов в T-S координатах. Энтропия – величина рост которой в необратимых процессах показывает ту часть энергии которая не может быть превращена в работу, а рассеивается в виде теплоты. Все реальные процессы из-за трения теплообмена и конечности времени их протекание является необратимыми. Поэтому их 2Зак. Термодинамики следует что энтропия системы должна расти, но 2зак. Термодинамики справедлив для систем состоящих из большого числа хаотически движущихся частиц. Для таких систем подходят и законы теории вероятности поэтому повышение энтропии будет только наиболее вероятным, но будут существовать и маловероятные события или флуктуации. Система находиться в устойчивом состоянии если она стремиться к максимальной энтропии. Флуктуация-равновесное состояние при мин. Значении энтропии. 2Зак. Термодинамики не является абсолютным законом природы и его действие может нарушаться на отдельных участках системы в малые периоды времени. Энтропия-мера ценности тепла, его работоспособности и технологической эффективности; мера потери работы из-зи необратимости реальных процессов; мера беспорядка. На основании 2Зак. Термодинамики замкнутый цикл можно осуществить только при наличии горячих и холодных источников теплоты, их кол. может быть уменьшено на отдельных участках цикла, теплоту подводить и отводить изотермически. Придельным будет случай когда все теплота подводиться и отводиться только по изотермам, в этом случае потребуется 1 нагреватель и 1 холодильник.
22. Таблицы и диаграммы водяного пара. 1) PV – процесс превращения воды в перегретый пар в изобарном процессе.
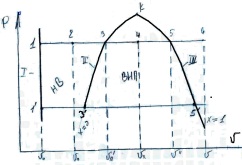
т1-нормальная вода, t=0гр. т2-НВ, t>0град. т3 КВ. т4 внп. т5снп. т6 пп. Повторим этот же процесс при более низком давлении. т1 – не изменит положения относительно оси давлений т.к. вода при t=0гр. это тающий лед, а он не сжимается. т3-смещается в лево т.к. при пониженных давлениях вода закипает при более низкой температуре и не успевает расшириться до первоначального состояния. т5-смещается в право т.к. СНП близок по состоянию к идеальному газу, чем ниже давление тем больше объем газа. Основные линии и области диаграммы. I-линия тающего льда, II-нижняя пограничная кривая или линия кипящей воды, III-верхняя пограничная кривая или линия СНП. Между линиями I и II образовалось область НВ. К-критическая точка её параметры зависят от рода вещества, например для воды Pk=22,1мПа; Тк=647К; В этой точке исчезают различия между всеми состояниями воды и пара. 2)TS – используется если необходимо определить кол. теплоты участвующей в процессе.
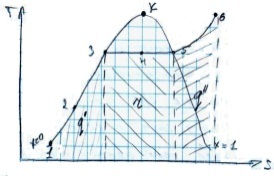
Особенности
TS
диаграммы: 1-Энтропия воды изменяется
незначительно поэтому точки 1-3 почти
совпадают с пограничной кривой. 2-В
области влажного пара изобара и изотерма
совпадают. Процесс 3-5. q'-теплота
кипения; r-скрытая
теплота парообразования; q”-теплота
перегрева.
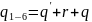 .
.
3) hS – диаграмма. h-энтальпия или теплосодержание. h=ср*t
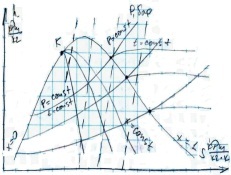
- - - Линия постоянного объема.
Таблицы
воды и пара: 1) КВ, х=0, Известно Р или t
находим h’,S’,V’.
2) СНП, х=1, Р или Т находим h’,S’,V’.
3) ВНП (Р,х) или (t,х)
находим
 ;
;
 ;
;
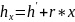 .
(Р,у) или (t,у),
у-степень влажности пара.
.
(Р,у) или (t,у),
у-степень влажности пара.
14. Цикл одноступенчатого компрессора. Компрессор – машина предназначенная для сжатия газов. Подразделяются на одно и много ступенчатые, поршневые и центробежные, но термодинамика процессов сжатия в них одинакова.
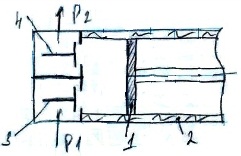
Работа
затрачиваемая на привод компрессора,
преобразуется в потенциальную энергию
сжатого газа и в теплоту. Открывается
клапан (3) и в рабочий объем компрессора
с водоохл. Стенками (2) поступает газ с
начальным давлением Р1 (0-1). 0-1 не является
изотермическим процессом т.к. параметры
рабочего тела не изменяются. Поршень
(1) движется в лево и рабочий цилиндр
сжимается до необходимого давления Р2
(1-2). Открывается клапан (4) и сжатый газ
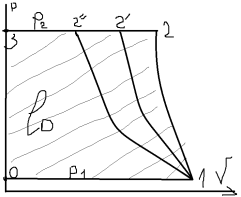
подается потребителю (2-3). 1-2”
– изотермический процесс при Т=const.
 .
1-2 – адиабатный процесс S=const.
.
1-2 – адиабатный процесс S=const.
 .
1-2’ – политропный процесс c=const.
.
1-2’ – политропный процесс c=const.
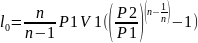 ,
1<n<k.
Теоретическая мощность для привода
двигателя компрессора
,
1<n<k.
Теоретическая мощность для привода
двигателя компрессора
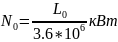 .
L0=l0*m
Дж. m-масса
или расход вещества. На практике исп.
Процесс близкий к политропному приэтом
показатель политропы стараются
приблизить к 1. В реальных компрессорах
присутствует вредное пространство
потери давления во впускном и
нагнетательном клапоне, а также
теплообмен между газом и стенками
цилиндра.
.
L0=l0*m
Дж. m-масса
или расход вещества. На практике исп.
Процесс близкий к политропному приэтом
показатель политропы стараются
приблизить к 1. В реальных компрессорах
присутствует вредное пространство
потери давления во впускном и
нагнетательном клапоне, а также
теплообмен между газом и стенками
цилиндра.
 .
VМ-мертвый
объём.
.
VМ-мертвый
объём.
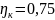 -эффективный
КПД копрессора кот. учитывает мертвый
объем, трение, теплообмен.
-эффективный
КПД копрессора кот. учитывает мертвый
объем, трение, теплообмен.
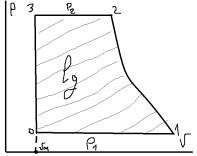
24. Паросиловые установки, принцип действия, область применения. Теоретический цикл Ренкина. Паросиловая установка предназначена для выработки пара и получения электрической энергии.
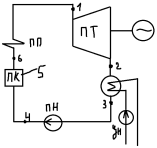
За основной цикл принят теор. цикл Ренкина. В паровом котле (ПК) находиться КВ в (5) которая в изобарном процессе превращается в СНП (т6). В пароперегревателе (ПП) при P=const, повышается температура пара и на выходе образуется перегретый пар. Пар требуемыми параметрами (т1) совершает работу на лопатках турбины в адиабатном (S) процессе (1-2) и на выходе образуется ВНП (т2). Конденсатор (К) циркуляционным насосом (ЦН) подается охлаждающая вода. Пар конденсируется изобарно-изотермически P=const, T=const (2-3) без переохлаждения (т3). КП вода охлаждается и ПН подается в котёл, при этом давление увеличено до первоначального.
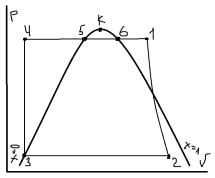
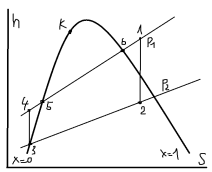

1-2: адиабатное (S) расширение пара. 2-3: изобарно-изотермическая, P=const, T=const, конденсация пара. 3-4: Изохорное (V) повышение давления. 4-5: изобарный (Р) нагрев воды до t кипения. 5-6: изобарно-изотермическое (P, Т) кипение воды. 6-1: изобарный (Р) перегрев пара.
15. Цикл многоступенчатого компрессора. Используется для сжатия газа до большого давления. Сжатие газа осуществляется в нескольких последовательно соединённых цилиндрах с промежуточным охлаждением после каждого цилиндра при этом понижается отношение давлений в цилиндре и повышается КПД компрессора и понижается расход энергии на привод двигателя.
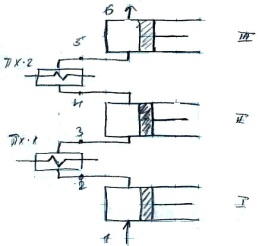

0-1
заполнение рабочего объема газом при
давл. Р1; 1-2,3-4,5-6 последовательное сжатие
в 3х цилиндрах; 2-3, 4-5 изобарное охлаждение
в промежуточном охладителе; 6-7 нагнетание
сжатого газа потребителю. Наиболее
эффективным является многоступенчатое
сжатие при условии, что отношение
давлений в каждой ступени одинаково.
Р2/Р1=Р4/Р2=Р6/Р4=х – степень сжатия.
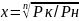 .
Обычно стремятся к тому, что бы температура
на выходе из холодильника была такой
же как температура газа на входе в
предыдущую ступень, тогда t1=t3=t5.
Температура газа на выходе из всех
цилиндров одинаковы.t2=t4=t6.
Отсюда следует что работа на каждой
ступени равны.
.
Обычно стремятся к тому, что бы температура
на выходе из холодильника была такой
же как температура газа на входе в
предыдущую ступень, тогда t1=t3=t5.
Температура газа на выходе из всех
цилиндров одинаковы.t2=t4=t6.
Отсюда следует что работа на каждой
ступени равны.
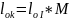 .
С=const
(n=1,
1,4),
.
С=const
(n=1,
1,4),
 .
.
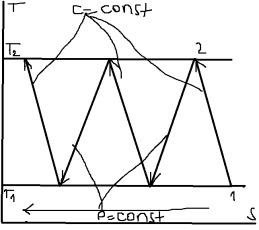
25.
Методы повышения термодинамической
эффективности циклов ПТУ.
 .
Теоретически повысить КПД можно если
повысить давление перегретого пара
или понизить давление отработавшего.
.
Теоретически повысить КПД можно если
повысить давление перегретого пара
или понизить давление отработавшего.
1) Повышаем термический КПД: повышаем давление.
Сухость влажного пара на выходе из последней ступени турбины недолжна быть меньше 86% т.к. снижение степени сухости ведет к образованию конденсата и коррозионному разрушению лопаток турбины. Повышение кпд, повышение давления и температуры t. Современные турбины работают при критических темпер. Пара t1=550-6000С. Дальнейшее повышение t1 невозможно из-за нарушения условий термической прочности деталей турбины. 2)повышение КПД, понижение давления Р2.турбины работают в условиях частичного вакуума Р2=0,04-0,06 бар дальнейшее понижение Р2 невозможно.
При использовании вторичного перегревателя КПД цикла ПТУ увеличивается на 3-4%, а если исп. еще один ПП то КПД увеличиться еще на 1,5%. После охлаждения вода в котел подается при низкой температуре, если ее подавать подогретой то КПД увеличиться на 7-12%.
26.
Теплофикационные циклы паросиловых
установок.
Противодавление – повышение давления
пара на выходе из последней турбины
ступени.
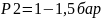 ,
,
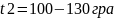 ,
,
 .
Охлаждающую воду с повышенной температурой
используют в технологических процессах,
процесс сушки или пропарки или в системах
отопления. Таким образом происходит
выработка как электрической так и
тепловой энергии. Установки раб. по
такому принципу наз. теплоэлектроцентральные.
.
Охлаждающую воду с повышенной температурой
используют в технологических процессах,
процесс сушки или пропарки или в системах
отопления. Таким образом происходит
выработка как электрической так и
тепловой энергии. Установки раб. по
такому принципу наз. теплоэлектроцентральные.
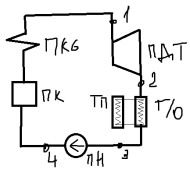

ПДТ
– противодавленческая труба; т/о –
теплообменник; т/п – тепловой потребитель;
В цикле с противодавленческой трубой
теплота q2
это не безполезно затрачиваемая теплота,
а теплота паредоваемая потребителю.
Эффективность раб. такой установки
оценивается не термическим КПД, а коэф.
использования теплоты
 ,
l-раб.
затрачиваемая на выработку электрической
энерги; q2
– тепловая энергия переданная
потребителю; q1
– подведенная теплота.
,
l-раб.
затрачиваемая на выработку электрической
энерги; q2
– тепловая энергия переданная
потребителю; q1
– подведенная теплота.
 .
.
