
- •10.1 Назначение и типы компрессоров
- •10.2 Термодинамический анализ работы компрессора
- •10.3 Многоступенчатое сжатие
- •10.4 Расход мощности на привод компрессора
- •10.5 Индикаторная диаграмма поршневого компрессора
- •10.6 Изотермический и адиабатный к.П.Д. Компрессора
- •11.1 Циклы поршневых двигателей внутреннего сгорания
- •11.2 Циклы газотурбинных установок
- •11.5 Сравнение циклов гту
- •11.6 Методы повышения к.П.Д. Гту
- •12.1 Цикл Карно для водяного пара и его недостатки
- •12.2 Цикл Ренкина
- •12.3 Влияние параметров пара на термический к.П.Д. Цикла Ренкина
- •12.4 Регенеративный цикл для водяного пара
- •12.5 Теплофикационные циклы
- •12.6 Циклы бинарных парогазовых установок
- •12.7 Методы прямого преобразования энергии
- •13.1 Общие характеристики холодильного цикла
- •13.2 Цикл воздушной холодильной установки
- •13.3 Цикл парокомпрессионной холодильной установки
- •13.4 Цикл пароэжекторной холодильной установки
- •13.5 Абсорбционные холодильные установки
- •13.6 Цикл теплового насоса
- •14.1 Основные понятия термодинамики химических реакций
- •14.2 Тепловой эффект химических реакций
- •14.3 Закон Гесса и его следствия
- •14.4 Закон Кирхгофа
- •14.5 Скорость химической реакции и закон действующих масс
- •14.6 Обратимость реакций и химическое равновесие
- •14.7 Степень диссоциации и ее связь с константой равновесия
- •14.8 Термодинамические условия равновесия химических реакций
- •14.9 Свободная энергия и изобарный потенциал как характеристические функции
- •14.10 Максимальная работа химических реакций
- •14.11 Уравнение Гиббса –Гельмгольца
- •14.12 Максимальная работа как мера химического сродства
- •14.13 Уравнение изотермы химической реакции
- •14.14 Закон Вант – Гоффа
- •14.15 Зависимость скорости реакции от температуры
- •14.16 Тепловой закон Нернста
14.7 Степень диссоциации и ее связь с константой равновесия
Диссоциацией называется реакция разложения химически сложного вещества на более простые, которая может возникнуть, если изменятся условия, в которых находится исходное вещество (т. е. его давление или температура). Начавшись, диссоциация продолжается до тех пор, пока между исходным веществом и ее продуктами не установится химическое равновесие, соответствующее новым условиям. После этого видимое течение реакции прекращается.
Глубина реакции может быть различной в зависимости от давления и температуры равновесной смеси исходного вещества с продуктами диссоциации. Ее принято характеризовать степенью диссоциации, обозначаемой буквой α, которая представляет собой ту долю исходного вещества, которая разложилась к моменту достижения равновесия.
Очевидно, что для процесса диссоциации, характеризуемого уравнением
аА ↔ bB + cC +… ,
константа
равновесия
![]() и
степень диссоциации α связаны между
собой зависимостью КР
= f (α), причем эта зависимость обратна
в том смысле, что с увеличением степени
диссоциации константа равновесия
уменьшается, и наоборот.
и
степень диссоциации α связаны между
собой зависимостью КР
= f (α), причем эта зависимость обратна
в том смысле, что с увеличением степени
диссоциации константа равновесия
уменьшается, и наоборот.
Величина константы равновесия всякой реакции зависит от давления (а также и от температуры, но эта последняя зависимость рассматривается не здесь, а в § 14.14). При этом связь между константой равновесия и давлением выражается простой формулой
![]() ,
(14.17)
,
(14.17)
где Δn – изменение числа киломолей в ходе реакции.
Применяя эту формулу к реакциям диссоциации, можно видеть, что в зависимости от изменения числа киломолей последние делятся на три группы: реакции, идущие с увеличением числа киломолей (Δn >0), у которых с ростом давления константа равновесия увеличивается, следовательно, степень диссоциации уменьшается; реакции, идущие с уменьшением числа киломолей (Δn < 0), у которых с ростом давления константа равновесия уменьшается, следовательно, степень диссоциации увеличивается, наконец, реакции, идущие без изменения числа киломолей, у которых ни константа равновесия, ни степень диссоциации от давления не зависят.
Зависимость KР = f(α) для каждой конкретной реакции имеет свою форму, вытекающую непосредственно из уравнения реакции. В качестве примера рассмотрим диссоциацию двуокиси углерода по уравнению
2СО2 ↔ 2СО+О2,
относящуюся к реакциям первой группы (Δn >0).
Обозначая степень диссоциации СО2 через α, получаем, что к моменту равновесия из двух киломолей СО2 останется 2(1– α) киломолей, причем образуется 2 α киломолей СО и α киломолей О2. Таким образом, при равновесии смесь будет содержать nсм =2(1 – α)+2 α + α =2+ α киломолей вместо двух киломолей в начале реакции.
Соответственно парциальные давления компонентов смеси сос-ставят при общем давлении смеси рсм.
![]() .
.
Тогда выражение для КР принимает вид
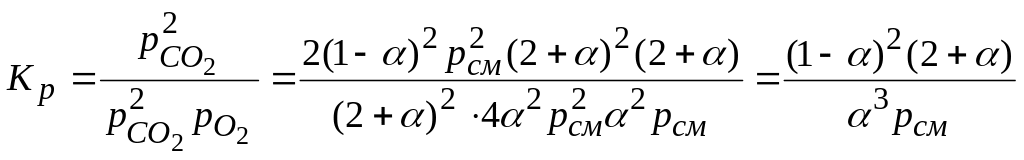 .
.
Полученное выражение и является искомой зависимостью KР = f(α). Аналогичным методом можно составить уравнение связи между константой равновесия и степенью диссоциации для реакций второй или третьей группы.
Иногда в уравнении диссоциации исходное вещество помещается не слева, а справа, т. е. диссоциация выражается уравнением bB + +cC+…↔aA. В таких случаях константа равновесия выражается обратной формулой
![]() ,
,
а поэтому зависимость между ней и степенью диссоциации становится прямой в том смысле, что с увеличением степени диссоциации константа равновесия также увеличивается.
