
- •Глава 10. Геотехнические исследования (к. Страхан, р. Дорей)
- •Глава 11. Конструирование основания для кучного выщелачивания (Клинт Страчан, Дирк Ван Зил)
- •Глава 12. Контроль поверхностных вод – водный баланс
- •Глава 13. Геохимия цианидов и методы обезвреживания авторы:(а.Смит, д.Струсакер)
- •Глава 14. Обезвреживание и разложение цианидов при кучном выщелачивании (Адриан Смит)
- •Глава 15. Обзор техники оценки капитальных и эксплуатационных затрат проекта kb (Вильям е. Кобб)
Глава 13. Геохимия цианидов и методы обезвреживания авторы:(а.Смит, д.Струсакер)
13.1. ВВЕДЕНИЕ
Цианид— это обобщенный термин, указывающий на присутствие цианид-иона (CN) Цианид часто встречающееся соединение, образующееся во многих биохимических реакциях. Многие виды растений синтезируют органические соединения, содержащие цианид в форме цианогенных гликозидов (Кnowles, I973). Например, следовые семейства роз (Кingsbury, 1964).
Многие продукты, такие как маис, сладкий картофель, бобы, миндаль и сигаретный дым содержат цианиды. Например, по данным химических анализов содержание цианидов в миндале составляет около 0,2% (Steffen Robertson and Kirsten, 1987); в сигаретном дыме 0,16 % (US. Departmen of Health, 1964).
Химия растворов цианидов является сложной из-за того, что цианид-ионы образуют соединения и комплексы со многими элементами. Некоторые соединения цианидов являются высокотоксичными, а другие – относительно инертные и безвредные. Молекулярный циано-водород (НСN) является наиболее токсичным соединением цианидов. В обычных условиях НСN - газ, который легко реагирует с окружающей средой с образованием токсичных или нетоксичных соединений цианидов. Таким образом НCN является разлагающимся ядом, и многие природные геохимические процессы снижают концентрации НСN в системах кучного выщелачивания с течением времени.
Как было отмечено выше, свободный цианид существует в двух видах - ионах цианида (CN-) и молекулярном циановодороде. Свободный цианид, является ядом для человека, млекопитающих и водной фауны (Doudoroft 1978;Ecoloqical Anolysts, 1979). Летальные дозы для человека зависят от формы контакта: 1 - Змг/кг веса при попадании внутрь; 10 – З0 мг/л при ингаляции; 100 мг/кг веса при абсорбции.
Предельно допустимая концентрация свободных цианидов в воде изменяется от 0,028 до 2,295мг/л в зависимости от видов живых организмов и условий. Принято считать, что концентрация цианида более 0,1мг/л убивает живые организмы в пресной и морской воде. Концентрация синильной кислоты HCN- 0,05 мг/л может быть смертельной для рыбы. На степень токсичности свободного цианида влияют такие факторы как рН, температура, содержание кислорода в воде, ионная сила, особенности и размера организмов.
13.2. КЛАССИФИКАЦИЯ ЦИАНИДОВ И АНАЛИТИЧЕСКИЕ МЕТОДЫ
Трудность, возникающая при обсуждении воздействия цианидов на окружающую среду и установлении стандартов управления, заключается в том, что терминология, используемая при описании цианидов носит запутанный характер. Вдобавок существует множество аналитических методов для различных соединений цианидов и отдельные из этих методов порождают дополнительные проблемы. Так аналитические данные разных лабораторий могут противоречить друг другу (Coпп, I98I). Последующее обсуждение посвящено прояснения цианидной терминологии и обзору наиболее общих аналитических методов.
13.2.I. Свободный цианид
Термин свободный цианид означает два соединения, цианид-ион (CN-) и молекулярный циановодород или синильную кислоту (НCN). В кислых и слабощелочных растворах в основном присутствует молекулярный циановодород.
Большинство аналитических методов определения свободного цианида включает экстракцию или выделение HCN из раствора и его последующее определение (Conn, 198I). Свободный цианид может быть также определен с помощью ионоселективного электрода по измерению потенциала с последующей оценкой концентрации HCN по калибровочной кривой. Последний метод является наиболее простым и экономичным и применяется в полевых условиях.
Существует, однако, значительный массив данных, которые указывают на трудности аналитического определения свободного цианида. Во многих случаях уровень содержания свободного цианида доказывается выше общей концентраций цианидов для одной и той же гробы благодаря наличию ионов тиоцианатов (роданида)(СNS) или других ионов, мешающих определению. Так, метод с ионоселективным электродом особенно чувствителен к присутствию в растворе S2-, Cl- и Hg-. Таким образом, методы аналитического определения свободного цианида зависят от химического состава анализируемых растворов.
Несмотря на то, что основным соединением, которое определятся и присутствует в растворе, является НСN, под термином «свободный цианид» в литературе обычно понимается «CN-». Вдобавок свободный цианид, иногда записывается как «CN» (US Ennviromentol, Protection Agency,1980).
13.2.2. Общий (суммарный) цианид
Общий цианид - это сумма цианид-ионов различных соединений, включая комплексы металлов. Основным методом разложения при определении общего содержания цианидов является метод кислотной перегонки с катализатором. Этот метод не позволяет полностью оценить содержание цианидов золота, кобальта, платину соединений железа. На точность и воспроизводимость метода влияет содержание тицианатов. Проблема влияния тиоцианатов приводит к большим трудностям при сравнении данных по общему содержанию цианидов в горной промышленности (Сопп,1981).
Так как содержание общего цианида обозначается термином (CN -), то трудно отличить данные по общему цианиду от свободного цианида. Использование слов «свободный» и «общий» предотвращает путаницу.
13.2.3. Другие методы определение цианида
Существуют различные методы определения свободного цианида совместно с цианидом, входящим в комплексы с определенными металлами при известных условиях. Некоторые методы контроля цианида основаны на этих определениях, в которых измеряется не общий цианид, а только его часть. Метод определения цианида, основанный на хлорировании, заключится в разнице между определениями общего цианида до щелочного хлорирования пробы и после. В процессе щелочного хлорирования окисляются все цианиды за исключением комплексов железа и тиоцианатов. Разница между двумя значениями "общего" цианида означает количество цианида, окисляемое в процессе хлорирования. Этот метод связан с теми же ошибками и проблемами учета тиоцианата, что и метод определения общего цианида (Gаnnоn , 1981).
Метод слабокислотной диссоциации (WAD), известный как метод "С" (AS ТМ), включает процедуры определения, подобные методу определения общего цианида, но использует другие реагенты. Этот метод извлекает весь цианид из комплексов Zn и Ni, но позволяет извлечь лишь около 70% из медных и 30% из кадмиевых комплексов. Этим методом нельзя выделить цианид из комплексов Со и Fe (+2,+3). В этом методе нет проблем с влиянием тиоцианатов (Gаnnоn, 1981).
Этот метод предпочитают инженеры и геохимики из-за того, что он позволяет избежать проблем, связанных с определением свободного цианида и не зависит от подержания тиоцианатов.
ГЕ0ХИМИЯ ЦИАНИДА В ОТРАБОТАННОМ ШТАБЕЛЕ КВ.
Для того, чтобы уяснить поведение цианидов в штабеле КВ необходимо определить протекающие реакции и соединения цианида, существующие в различных геохимических условиях внутри штабеля, в основании, а также в подстилающих осадочных породах и горных породах. На рис. 13.1. представлена схематическая диаграмма, показывающая большинство компонентов системы кучного выщелачивания и основные геохимические условия внутри горнорудной массы. Эти условия отличаются в различных частях системы. Верхние части системы КВ, включая штабель, подстилающий слой и верхние слои породы, окислены и относительно обезвожены. Нижние слои пород находятся в восстановительной обстановке и обводнены. Геохимические условия внутри системы кучного выщелачивания должны сильно зависеть от таких факторов как уровень грунтовых вод, количество осадков, выпадающих на штабель, минералогическая характеристика руды и породы, объемная плотность и проницаемость пород.
Для целей обсуждения будем считать, что геохимические условия, показанные на рис.13.1, являются наиболее общими.
Следующее обсуждение касается поведения соединений цианида, проявляющееся в их относительной токсичности и возможном воздействии на окружающую среду.
13.3.1. Гидролиз и улетучивание
В результате гидролиза цианид-иона образуется молекулярный циановодород (HCN) как показано в уравнении (1) и на рис. 13.2.
CN- + Н20— HCN + ОН- (1)
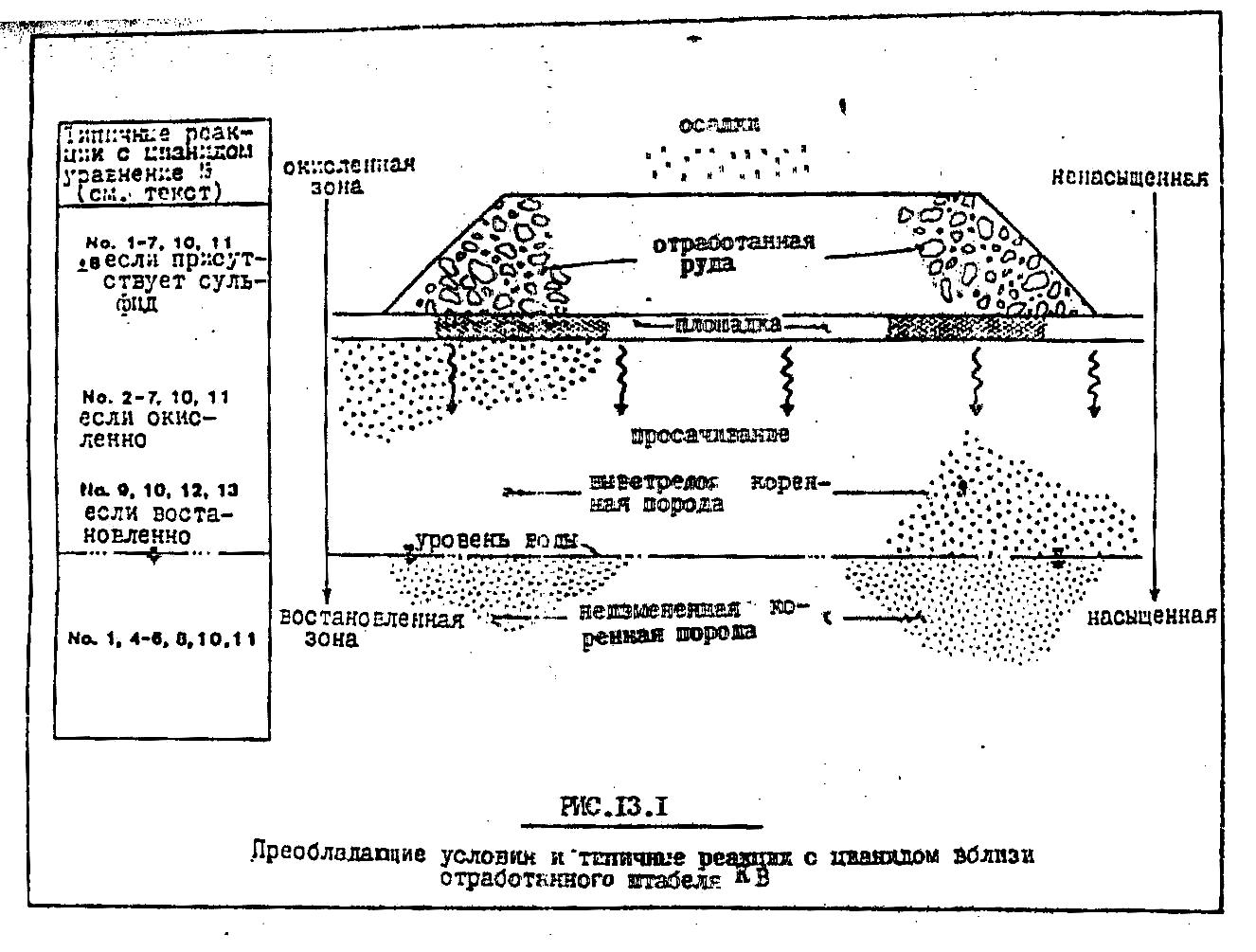
Рис. 13.1.
Преобладающие условия и типичные реакции с цианидом
вблизи отработанного штабеля КВ
Эта реакция сильно зависит от рН. При рН = 9.36 (рКа реакции гидролиза) концентрации цианид-иона и HCN равны (рис.13.2). При всех значениях рН <9.36 циановодород является основным соединением в этой системе. Например, при рН = 7.99 цианид существует в форме HCN ( Нuiatt et ol,1982). Большинство штабелей имеют рабочий рН около 10.5. После прекращения работ на штабеле происходит постепенное снижение рН из-за нейтрализации щелочности среды в процессе отмывки, орошения дождевой водой и действия атмосферного углекислого газа. Таким образом, НСN должен образовываться во всех, только что оставленных штабелях КВ. Молекулярный циановодород имеет высокое значение упругости пара и легко улетучивается в виде газа. Процесс улетучивания сильно зависит от температуры. В последующем происходит окисление или разложение HCN . Конечным результатом этого процесса является потеря цианида в системе КВ.
Как показано на рис.13.1., гидролиз иона СN- наиболее вероятен в верхних слоях системы КВ. Однако эта реакция не зависит от уровня рН и может также протекать и в восстановительной обстановке нижних слоев штабеля КВ.
Следует отметить, что если штабель сложен из агломерированной руды, известь, применяемая в процессе агломерации, может играть роль буфера в системе. Предотвращая гидролиз циан-иона, благодаря поддержанию рН выше 9.36. Со временем, однако, попадание воды и углекислого газа в штабель может произвести к нейтрализации извести. В этом случае гидролиз также произойдет.
13.3.2. Окисление HCN и СN-
Окисление как HCN так и СN- в основном происходит в верхних слоях системы КВ, как показано на рис.13.1. В результате окисления HCN образуется цианатоводород HCNO по уравнению (2) (Оwenbock, 1978):
2HCN + O2 → 2 HCNO (2)Прямое окисление CN- требует наличия минералогических, бактериологических или фотохимических (солнечный свет) катализаторов и приводит к образованию цианат-иона:
2CN- + O2 + катализатор → 2 CNO- (3)
Цинат-ион и цианатводород значительно менее токсичны, чем НСN. Внутри системы KB НСNO и CNO- легко гидролизуются с образованием аммиака и диоксида углерода, которые удаляются из системы в виде газов по уравнению (4):
HCNO + НO2 → NН3 + СО2 (4)
Образующийся аммиак может давать соединение аммония или окисляться с образованием нитратов в зависимости от рН (Hendricksa and Daignoult,1973). Поэтому окисление НCN и CN- понижает общее содержание цианида в системе.
13.3.3. Гидролиз/ (омыление) HCN
С падением рН в системе, HCN может гидролизоваться с образованием как формиата, так и муравьиной кислоты или формиата аммония:
НСN + 2Н2O → NH4 COOH (формиат аммония) (5)
или
НСN + 2Н2O → NH3 + НCOOH (муравьиная кислота) (6)
Эти процессы зависят от рН. При более низких значениях рН образуется предпочтительно муравьиная кислота. Некоторые исследователи называют этот процесс омылением, хотя этот термин относится обычно к стеаратам и т.п. соединениям.
13.3.4. Биологическое разложение НСN в аэробных условиях
Биологические процессы приводят к разложению НСN в окисленной части пород системы KB с образованием цианатоводорода по уравнению (7) и последующим гидролизом до аммиака и углекислого газа (4):
2HCN + О2 + enzyme → HCNО (7)
HCNО + НО2 → NH3 + CО2 (4)
13.3.5. Образование тиоцианатов
Тиоцианат-ионы (СNS-) могут образовываться по реакции между цианидом и соединениями серы (сульфидами, сероводородом или тиосульфатами). Тиоцианаты должны образовываться в штабелях КВ, содержащих сульфидные руды или в штабелях сооружаемых на сульфидсодержащих породах.
Образование тиоцианатов более зависит от минералогических условий, чем от рН и Eh и происходит в тех областях системы КВ, где имеются соединения серы:
Sx +S2-+CN-→Sx-1 +CNS- (8)
S2О3 + CN-→ SO3 + CNS- (9)
В зонах окисления образующиеся ионы реагируют с кислородом с переходом в сульфат-ионы (S04 ).
Тиоцианаты относительно стабильны и менее токсичны, поэтому образование тиоцианатов - это эффективный путь удаления цианида из системы КВ. Однако в результате повышения содержания сульфидов создаются условия снижения рН. Как было описано выше снижение рН приводит к гидролизу CN- НСN. Повышение кислотности может также привести к диссоциации цианидных комплексов тяжелых металлов, что приводит к увеличению подвижности некоторых тяжелых металлов и создает опасность загрязнения окружающей среды.
Простые соединения цианидов
Цианиды образуют простые соединения с одним ионом, например:
NаCN→ Nа+ +CN- (10)
Некоторые соединения металлов с цианидом, обычно образующиеся в процессе KB перечислены в таблице 13.1. Образование этих соединений зависит от состава и минералогии руд и пород системы КВ. Как поклеено в таблице 13.1. растворимость простых соединений цианида изменяется от легко растворимых до практически нерастворимых. Можно сказать, что вce простые соединения относительно нетоксичны, и образование этих соединений еще один естественный геохимический процесс, который приводит к удалению токсичных соединений цианида из системы КВ. Однако растворимые простые соединения цианида, такие как NaCN, KCN, Cа(CN 2) и Нg(СN)2 легко диссоциируют в растворе с образованием цианид-ионов (10). Гидролиз при рН< 9.36 приводит к образованию ядовитого циановорода (1).
13.3.7. Комплексные металлоцианидые ионы
Цианид также реагирует с металлами и образованием комплексов. Металлоцианидные комплексы образуются в результате взаимодействия нерастворимых соединений цианидов и избытка цианид-ионов. Примером может служить уравнение II:
Zn(CH)2 + 2 СN-→ Zn(CN)![]() (11)
(11)
Таблица 13.1.
Относительная стабильность цианидных соединений с металлами
и комплексов в воде (в порядке возрастания стабильности).
(по материалам Huiattetal., 1982; и Brickell, 1981).
Соединения цианида |
Примеры соединений в практике КВ |
1. Свободный цианид |
СN- , НСN |
2. Простые соединения: а) относительно растворимые. б) относительно нерастворимые |
NaCN, KCN, Cа(CN 2) и Нg(СN)2 Zn(CN)2, СuCN, Ni(CN)2, AgCN |
3. Слабые металлоцианидные комплексы |
Zn(CN)
, Сd(CN) |
4. Относительно прочные металлоцианидные комплексы |
Сu(CN) |
5. Прочные металлоцианидные комплексы |
Fe(CN) |
Как показано в таблице 13.1., некоторые их этих металлоцианидных комплексов являются относительно стабильными (нерастворимыми), в то время как другие диссоциируют с получением CN-, который гидролизуется с образованием НСN (Ур.1).
Простые соединения цианидов токсичны благодаря образованию НСN путем диссоциации и гидролиза. Однако комплексы меди и серебра, относительно прочные, являются токсичными для рыбы (Gannon, 1981). Хотя цианидные комплексы железа нерастворимы, они могут разлагаться при фотолизе (под действием ультрафиолета) с образованием (CN-). Скорость фотолиза зависит от условий. Фотолиз может прекращаться внутри штабеля КВ. Последние данные однако указывают, что традиционное разделение на слабые и прочные комплексы, теоретически корректное, может быть не применимо на практике. Работа компании Ridgewau Mining Company указывает, что стабильность цианидов меди и кобальта зависит от концентрации цианида в растворе, что подтверждается опытными данными компании. Исходный щелочной раствор с высоким значением рН содержит цианидные комплексы CN и Со, причем оба иона нерастворимы в таких условиях. При снижении содержания цианидов в результате разложения, количество CN и Со резко падает, причем это изменение не может быть объяснено разбавлением. Комплексы CN в Со оказываются нестабильными в этих условиях.
13.3.8. Биологическое разложение в анаэробных условиях
Анаэробные условия создаются в сильно восстановительной обстановке и разложение может протекать только в присутствии НS- или H2S (водн.) в зависимости от значения рН. При рН > 7 основным соединением является HS-, при низких значениях рН – H2S (водн). Уравнения 12 и 13 соответствуют этому процессу:
CN- + Н2S(водн)→HCNS + Н+ (12)
HCN + НS- →HCNS + Н* (13)
Затем происходит гидролиз НСNS с образованием NН3, H2S и СO2 (Schmidtetal, I981).
13.3.9. Образование полимеров HCN
Существует большое количество данных, указывающих, что в природных условиях HCN образует полимеры. Известно, что жидкая HCN в присутствии следовых количеств аммиака может образовывать аденин (C5H5N5), важное в биохимии соединение, которое присутствует и молекулах ДНК и РНК. Возможно образование нерастворимых полимеров.
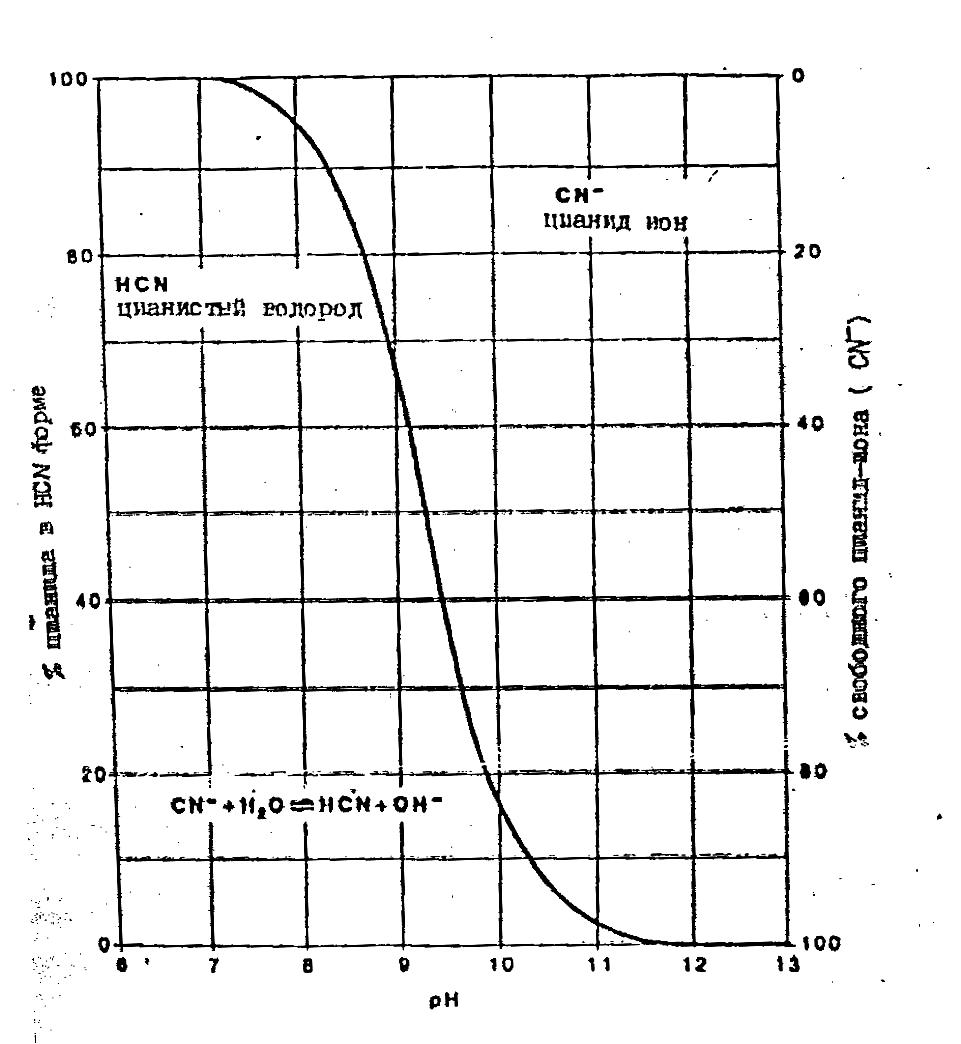
Рис. 13.2.
Взаимосвязь содержания НСN и СN со значением рН
13.4. ИТОГИ ОБСУЖДЕНИЯ РЕЗУЛЬТАТОВ ВЗАИМОДЕЙСТВИЯ ЦИАНИДА В ОТРАБОТАННОМ ШТАБЕЛЕ.
Множество соединений цианидов не являются сильно ядовитыми и относительно стабильны в обычных условиях. Однако ряд соединений реагируют с образованием НСN ядовитой формы цианида.
Как описано выше, существует ряд геохимических реакций протекающих в системе КВ, которые переводят HCN в менее ядовитые или неядовитые соединениям. Так, в течение определенного времени происходит самоочищение кучи и концентрация НСN понижается.
Engelhardt (1985) показал, что в активной куче содержащей хвосты свинцово-серебряных руд, содержание циановодорода падает резко, благодаря естественному разложению. За 18 месяцев по данным, полученным в результате регулярных наблюдений, почти 85 % исходного содержания цианидов разложилось, благодаря естественным процессам. Разложение цианида происходит по реакции первого порядка пропорционально остаточной концентрации цианида в куче. Экстраполяция показывает, что полное разложение цанидов произойдет менее, чем за 4 года после закрытия кучи. В отчете Chatwin et ol. (1987) основной механизм разложения связывается с улетучиванием, химическим взаимодействием с породами и биоразложением. Анализы проводились на стадии отмывки до 10 Ж/Т.
13.4.1. Требования к нейтрализации цианидов в отработанных кучах
В результате анализа, проведенного по 14 штатам, занимающимся вопросами КВ, получены следующие данные. Нет двух штатов, имеющих одинаковые требования по охране окружающей среды. Однако могут быть выделены следующие общие условия:
- установление ПДК по цианидам (0,2мг/л по общему цианиду);
-установление требований проведения необходимых операций в зависимости от условия осуществления процесса КВ.
В большинстве штатов установлены требования к чистой воде по нейтрализации в ней цианидов до "нулевого уровня". В дополнение приводятся условия и требования к технологии, контролю и т.д.
Большинство штатов требующих очистки до уровня питьевой воды не имеют больших забот, но кучному выщелачиванию. Напротив, в штатах, которые проводят значительные работы в этой области, установлены более приемлемые критерии. Во многих случаях нет необходимости и практически невозможно обеспечить очистку воды до уровня питьевой.
Наиболее занятые этими работами штаты вводят специальное требования по отмывке куч, аналитическому контролю и т.д.
Понимание геохимии цианида - это необходимость при установлении реальных стандартов нейтрализации цианида в процессе КВ. Требования к охране окружающей среды должны базироваться на уровне возможной самоочистки отработанной кучи, легкости разложения НСN и воздействия данного процеccа на окружающую среду. Более строгие требования должны предъявляться к проектам, предполагающим проведение работ около водоемов с рыбой, рядом с водозабором и т.д.
Требования доведения промывных вод нейтрализованной кучи до уровня питьевой воды (ПДК по CN-) реально недостижима и не являются необходимыми для предохранения поверхностных и подземных вод практически во всех рассмотренных случаях. Можно сделать заключение о том, что по мере миграции из кучи уровень ПДК будет достигаться благодаря емкостным свойствам вмещающих пород и расстоянию, которое проходят загрязненные воды.
С повышением активности работ в области KB многие штаты могут успешно использовать последовательное изложение этих вопросов для установления необходимых требований к нейтрализации цианидов.
