
Билет 14
Защитные цинковые покрытия
Цинковое покрытие часто применяют для защиты от коррозии водопроводных труб и запасных емкостей. В мягкой воде цинковое покрытие защищает сталь хуже, чем в жесткой. В горячей непрочной воде (свыше 70 С) цинковое покрытие не обеспечивает надежной защиты стали от коррозии, т.к. в этих условиях цинк защищает сталь лишь механически.
Цинковые покрытия хорошо защищает стальные изделия от коррозионного воздействия бензина и снросодержащих жидкостей. При этом цинковое покрытие эффективнее, чем кадмиевое или свинцовое.
Из простых кислых электролитов наибольшее распространение получили сернокислые и меньшее борфтористоводородные. Для этих электролитов характерна низкая рассеивающая способность, поэтому ониприменяются главным образом для цинкования изделий простой формы. Допустимые Втк металла в кислых электролитах выше, чем в комплексных, следовательно и скорость процесса более высокая. Простые кислые электролиты чеще используют с добавками орг веществ, повышающих катодную поляризацию и улучшающих структуру осадков. Кроме того, часто к сернокислым электролитам добавляют блескообразующие ве-ва.
Кислотные электролиты. Из кислых электролитов наибольшее распространение получили сернокислые, т.к. в хлористых растворах цинковые аноды сильно разрушаются, а борфтористоводородные растворы сложны в приготовление, более дороги и токсичны.
Значения рН в кислых растворах поддерживают в интервале 3.5-4.5. Для этой цели к электролиту добавляют 20-30г/л сульфата алюминия или 30 г/л алюмокалиевых квасцов. В присутствии солей алюминия повышается также катодная поляризация и осадки цинка получается полублестящими с мелкозирнистой структурой . Буферные свойства сульфата алюминия основаны на том, что при рН=4- 4.5 он гидролизуется с образованием H2SO4:
Al2(SO4)3+ 6H2O=Al(OH)3+ 3H2SO4
Аноды для цинкования в кислых электролитах изготовляют как правило, из чистого электролитического цинка (99,85-99.99%) во всех кислых электролитах аноды растворяются с высоким Вт, который при повышенной кислотности привышеет 100% в следствии коррозии.
Щелочные цианистые электролиты основными компонентами таких электролитов является комплексный цианид цинка, цинкат калия или натрия, щелоч NaOH, KOH.
Общая концентрация цинка в электролитах может изменяться в широких пределах от 3-35г/л в пересчете на металл.
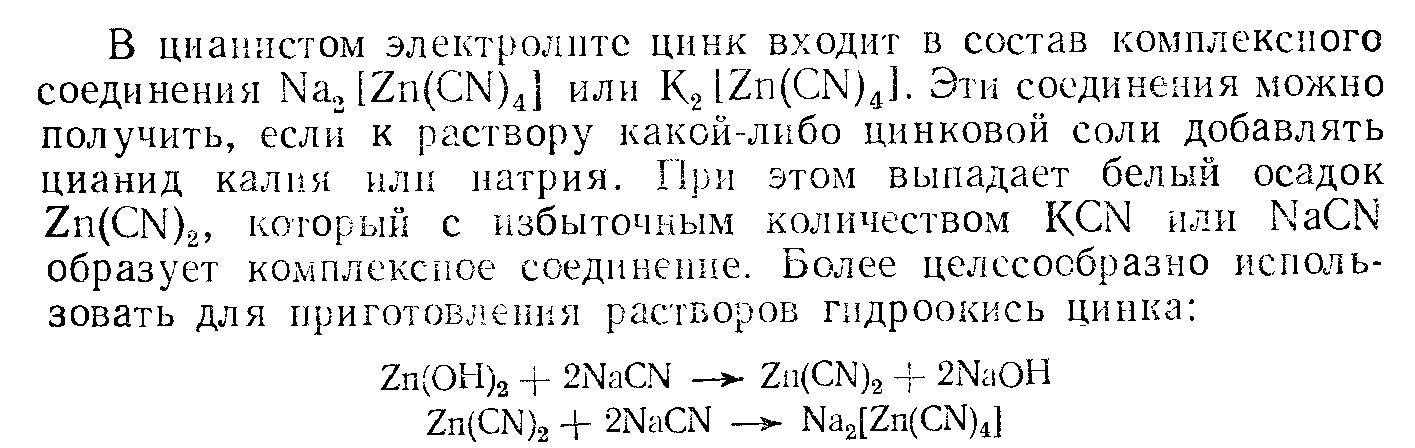

![]()
![]()
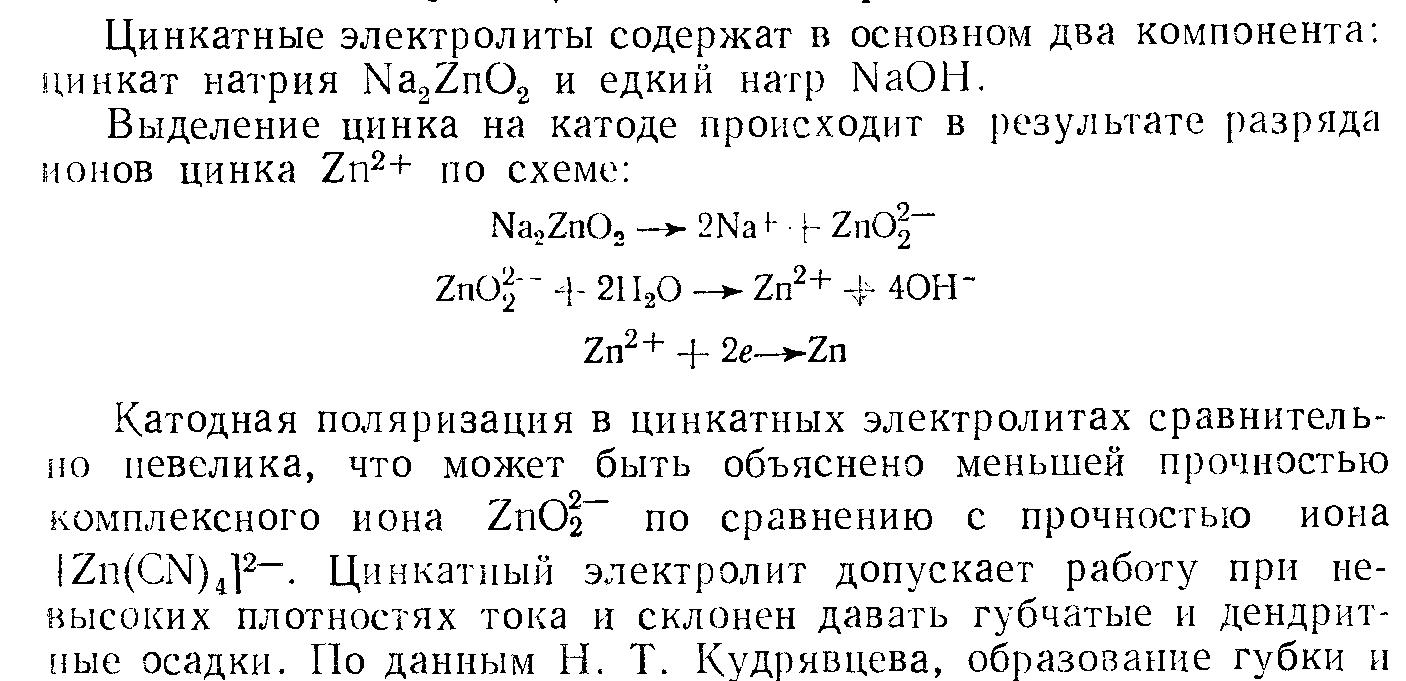
При приготовлении цинкатных электролитов следует пользоваться
свободными от железа реактивами,а также избегать незащещенной
железной аппаратуры . Наличие ионов железа в растворе
способствует образованию губчатых осадков.

2. Атмосферна корозія.Залежність зовнішнього середовища.Методи боротьби.
Корро́зия (— это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 6Н2О + ЗО2 = 4Fe(OH)3. Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной.
Процесс разрушения металлов под воздействием окружающей среды принято называть атмосферной коррозией. Атмосферная коррозия является наиболее распространенным видом коррозии, ее проявления настолько многочисленны и разнообразны, что совершенствование методов борьбы с ней не утрачивают своей актуальности.
Атмосферной коррозии подвержены все металлоконстукции, эксплуатируемые на открытом воздухе: трубопроводы и емкостное оборудование, металлические части строений, опор, мостов, транспортные средства и т.д.
Существуют различные способы борьбы с коррозией. Самыми популярными являются методы ограничения взаимодействия металла с коррозийной средой на границе поверхности.
Для длительного хранения металлоизделий применяют ингибиторы органического типа. В настоящее время разработано много ингибиторов и их применение быстро расширяется. Их используют при химической обработке металлов и при консервации для хранения на длительные сроки (смазки содержащие ингибиторы).
Для защиты металлоконструкций и оборудования в процессе их эксплуатации из применяемых на практике методов защиты от атмосферной коррозии наиболее распространенным и достаточно эффективным является метод нанесения защитных лакокрасочных покрытий.
В структуре мировых затрат на противокоррозионную защиту на лакокрасочные покрытия приходится около 39% средств, что в 2 раза превышает затраты на разработку и производство коррозионностойких материалов.
Основными достоинствами лакокрасочных покрытий являются:
- возможность применения для защиты любых конструкций непосредственно на строительных и монтажных площадках;
- простота и возможность механизации технологического процесса нанесения покрытий;
- покрытия на большинстве металлоконструкций могут ремонтироваться и восстанавливаться непосредственно в процессе эксплуатации;
- малый расход материала на единицу площади и низкая стоимость по сравнению с другими видами защитных покрытий.
Одним из основных показателей, определяющим эффективность покрытия, является его долговечность, т.е. способность сохранять защитные свойства до предельного состояния при установленной системе технологического обслуживания и ремонта.
Несмотря на достигнутый прогресс в области применения лакокрасочных покрытий, случаи их выхода из строя при непродолжительной эксплуатации встречаются довольно часто. Основными причинами чего являются:
1. Выбор защитного покрытия осуществляется без учета воздействия климатических факторов.
2. При выборе покрытия предпочтение отдается наиболее дешевым (морально устаревшим) лакокрасочным покрытиям с изначально заложенными непродолжительными сроками службы.
3. Нарушение технологии нанесения защитных покрытий.
3. Термодинамика электрохимических систем. Розрахунки ЕДС гальванічного елемента (напруги розкладу електролізу).
Электродвижущая сила гальванического элемента слагается из алгебраической суммы скачков потенциала на границах всех разнородных фаз системы.
На границе металл I – электролит I, электролит I – электролит II; электролит II – металл II и скачка потенциала на границе металл I – металл II. (контактная разность потенциалов).
Если два металла замкнуты с помощью проводника (М III) то сумма скачков потенциала (МI -MIII) + (MШ – МII) равна скачку потенциала (МI -MII). Скачок потенциала на границе металл-раствор электролита является результатом перехода заряженных частиц через поверхность раздела фаз. При таком переходе, помимо химической работы, совершается работа электрическая. Соответственно состояние заряженной фазы в расчете на 1 моль компонента J характеризуется так называемым электрохимическим потенциалом I:
I = I + FI
где I – химический потенциал I-го компонента данной фазы, FI – электрическая энергия 1 моль заряженных частиц этого компонента в данной фазе, F – число Фарадея, т.е. суммарный заряд одного эквивалента ионов, несущих заряд Z, I – разность электрических потенциалов между точкой внутри фазы и бесконечно удаленной точкой в вакууме, потенциал которой считается равным нулю.
Равновесие между заряженными частицами I- го компонента в двух фазах А и В наступает при равенстве их электрохимических потенциалов
IА = IВ Отсюда: для равновесия:
IА = IВ = ZF = ZF
где - разность потенциалов между точками внутри фаз А и В; называется гальвани-потенциалом. Скачок потенциала на границе металл-металл (межфазный гальвани-потенциал) возникает вследствие преимущественного перехода электронов из одной металлической фазы в другую. Его приравнивают к контактной разнице потенциалов. Скачок потенциала между двумя контактирующими жидкостями называется фазовым жидкостным потенциалом, если растворителем являются две несмешивающиеся жидкости. Если растворы различаются только природой или концентрацией электролита, то возникающая разность потенциалов называется диффузионным потенциалом.
Разность внутренних потенциалов между металлом и раствором называется нернстовским потенциалом. В общем случае ЭС состоит из скачков потенциала между двумя металлами, двух нернстовских потенциалов (на границе металл-раствор) и гальвани потенциала (раствор-раствор). Отметим, что контактная разность потенциалов не всегда входит составной частью в ЭДС. Так, если оба металлических электрода одинаковы, а оба электролита различны, то контактная разность потенциалов равна нулю. Нулю равен диффузионный потенциал в системах, в которых два металлических электрода находятся в контакте только с одним раствором электролита.
В соответствии с первым началом термодинамики взаимопревращения химической и электрической энергии строго эквивалентных количествах происходит. Но если пропускать электрический ток через электролит, то не вся электрическая энергия превратится в химическую; часть ее превратится в теплоту в форме джоулева теплаq, которое равно:
Q = I2R
Где q – количество теплоты, R – электрическое сопротивление электролита; I – величина тока, - время.
Если электрические процессы протекают термодинамически обратимо при силе тока I, равной нулю, то джоулево тепло не выделяется.
В этом случае гальванический элемент выполняет максимальную работу, которая равна изменению энергии Гиббса, взятому со знаком “минус”.
Wmax = - G = RT(lnK - ln aIVi)
где К – константа равновесия реакции, aI – активность I-го участника реакции.
Электрическая работа равна работе химической реакции:
Wmax = - G = ZFE
где Е – ЭДС гальванического элемента.
RT
E = (ln K -ln aIVi)
ZF
Для идеальных (разбавленных) растворов
RT
E = (ln K -ln СIVi)
ZF
Уравнения позволяют вычислить ЭДС гальванического элемента по данным о константе равновесия и концентрации всех участников реакции. Или зная ЭДС, можно вычислить константу равновесия. Величину Е выражают в вольтах.
уравнение Гиббса-Гельмгольца и получим:
G
Wmax = - G = - Н – Т( ) Р (12.8)
Продифференцировав 12.5 по Т, получим
G dE
( ) Р = - ZF
Т dT
Z и F – const по температуре
Тогда Wmax = ZFE =
- Н
+ ZFT
Н
Е = - + Т
ZF
Уравнение позволяют легко и достаточно точно определять величину теплового эффекта (Н) химической реакции, протекающей в гальваническом элементе по величине ЭДС и производной dE/dT. Последнюю находят путем измерения Е при разных температурах. dE\dT (температурный коэффициент ЭДС) может быть положительным или отрицательным. В первом случае (dE/dT 0) максимальная работа электрического тока превышает убыль энтальпии (-Н) и поэтому при работе гальванического элемента его температура будет понижаться. Во втором случае (dE/dT 0), наоборот, температура электрохимической системы будет повышаться.
Билет 20
