
- •Раздел 1
- •Занятие 1
- •Цель занятия
- •Карбонаты щелочных металлов
- •Отделение ионов аммония
- •Действие щелочей и аммиака
- •Оксалат аммония
- •Родизонат натрия (или калия)
- •Занятие 2
- •Цель занятия
- •1. На чем основано разделение катионов согласно кислотно-основной классификации?
- •2. В какой строке перечислены все групповые реагенты, используемые в кислотно-основной схеме анализа?
- •Цель занятия
- •Цель занятия
- •Салициловая кислота (сульфосалициловая кислота)
- •Цель занятия
- •1. В растворе присутствуют hCl (0,1 моль/л) и h3bo3 (0,01 моль/л). Что можно сказать о рН данного раствора?
- •Действие щелочей
- •Действие щелочей
- •Действие щелочей
- •Гексацианоферрат (II) калия
- •Цель занятия
- •1. Что из перечисленного ниже верно? Гидроксиды алюминия, цинка, хрома (III) растворимы в:
- •5. Найдите ряд, в котором содержится больше всего катионов, выпадающих в осадок в виде гидроксидов и оксосолей при обработке анализируемого раствора избытком 6 м NaOh и 6 м nh3.
- •Цель занятия
- •5. Обнаружение анионов scn- и I-
- •Цель занятия
- •Занятие 9
- •Цель занятия
- •1. В насыщенном водном растворе какого из перечисленных ниже веществ равновесная концентрация ионов металла будет наименьшей (в скобках приведены значения ks)?
- •Занятие 10
- •Цель занятия
- •1. Какие из перечисленных ниже процессов невозможны (дайте ответ, не проводя расчётов)?
- •2. Какая из частиц, выделенных полужирным шрифтом, является самым сильным окислителем?
- •3. Какая из частиц, выделенных полужирным шрифтом, является самым сильным восстановителем?
- •7. Какой из малорастворимых электролитов, формулы которых приведены ниже, обладает самым малым произведением растворимости?
- •9. Вывод об отсутствии какого ряда анионов можно сделать, если известно, что при добавлении к анализируемому раствору разбавленного раствора сильной кислоты не происходит выделения пузырьков газа?
- •10. При добавлении к анализируемому раствору ki в кислой среде не происходит появления бурой окраски вследствие выделения иода. Все анионы какого ряда можно не искать при дальнейшем анализе?
- •Занятие 11
- •Цель занятия
- •Предварительные испытания
- •Занятие 12
- •Цель занятия
- •4. Какой из приведенных ниже графиков отражает зависимость константы распределения предельных монокарбоновых кислот между хлороформом и водой в зависимости от числа атомов углерода в молекуле кислоты?
- •2. Экстракция диметилглиоксиматов никеля и кобальта
- •3. Экстракция соединения комплексного аниона [SbCl6]- с малахитовым зеленым
- •4. Экстракционное разделение I- и Br-
- •5. Экстракция ионного ассоциата берберина с трихлорацетат-анионом
- •6. Экстракция ионного ассоциата димедрола с метиловым оранжевым
- •Раздел 2
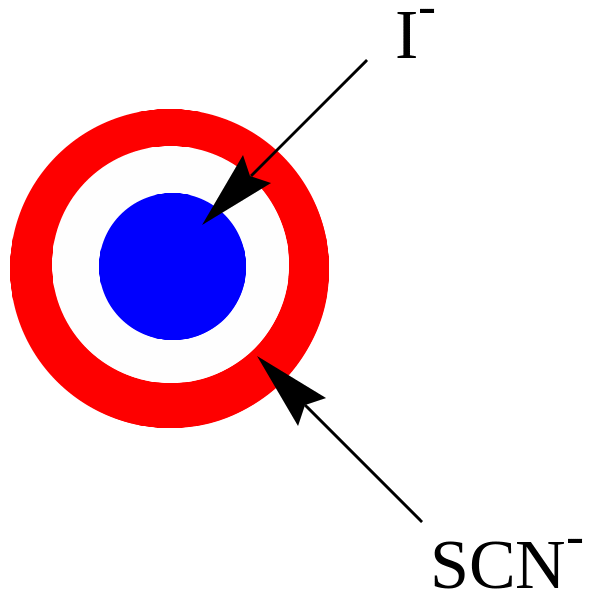
5. Обнаружение анионов scn- и I-
В пробирку вносят 2-3 капли раствора KSCN и 2-3 капли раствора KI. На бумагу, пропитанную 5% раствором FeCl3, помещают 1 каплю приготовленной смеси растворов солей, смачивают 1-2 каплями воды, в качестве проявителя хроматограммы используют 0,5% раствор крахмала. В центре образуется синее пятно, соответствующее иодид-ионам:
2Fe3+ + 2I- 2Fe2+ + I2
I2 + крахмал синее окрашивание
Тиоцианат-ионы образуют красную зону на периферии.
Fe3+ + 3SCN- Fe(SCN)3
ЗАНЯТИЕ 8

Цель занятия
Знать:
общую характеристику и классификацию комплексных соединений;
константы, характеризующие равновесия комплексообразования;
основные факторы, влияющие на процессы комплексообразования в растворах;
общую характеристику и классификацию органических реагентов, а также возможные пути их использования в химическом анализе.
Уметь:
проводить расчёты, связанные с равновесиями комплексообразования;
выполнять реакции обнаружения анионов I аналитической группы.
Основные понятия, связанные с комплексными соединениями: комплексная частица, комплексообразователь, лиганд, координационное число, дентатность лиганда.
Классификация комплексных соединений. Внешнесферные комплексы. Хелаты. Внутрикомплексные соединения.
Виды констант равновесия, используемые для характеристики термодинамической устойчивости комплексов. Кинетическая устойчивость комплексных соединений.
Влияние различных факторов (природа комплексообразователя и лигандов, температура, ионная сила, побочные реакции) на процесс комплексообразования и устойчивость комплексных соединений.
Влияние концентрации реагирующих веществ на комплексообразование. Расчёт молярных долей свободных ионов металла и комплексов в равновесной смеси. Функция закомплексованности. Среднее лигандное число.
Понятие об органических реагентах. Органические реагенты как хелатообразующие лиганды. Функционально-аналитическая группировка.
Классификация органических реагентов, участвующих в процессах комплексообразования, в зависимости от типа донорных атомов.
Применение комплексообразующих органических реагентов в аналитической химии. Органические реагенты, принимающие участие в процессах, не связанных с комплексообразованием.
Объясните, почему существуют комплексные ионы [Cu(NH3)4]2+ и [Cu(H2O)4]2+, но не существует ионов [Cu(NH4)4]6+ и [Cu(H3O)4]6+.
Вспомните из курса общей химии основные правила номенклатуры комплексных соединений. Назовите следующие комплексные соединения: NH4[Cr(SCN)4(NH3)2], Na2[Fe(CN)5NO], Na3[Sb(OH)6], K2[HgI4], K2Pb[Cu(NO2)6], [Co(NH3)3(NO3)3], K3[Fe(C2O4)3].
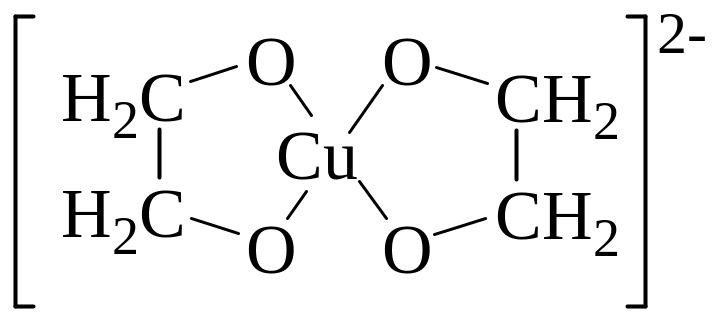
Что такое координационное число? Определите координационное число и степень окисления меди в следующем комплексе
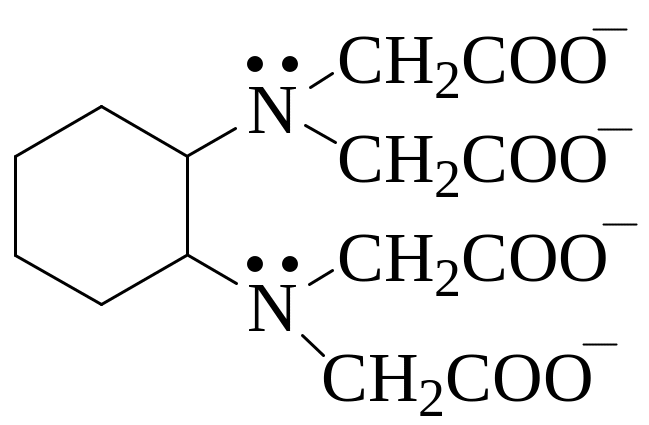
Что такое дентатность лиганда? Определите дентатность следующего лиганда
Какое из понятий, хелаты или внутрикомплексные соединения, является более общим? Приведите примеры хелатов, не являющихся внутрикомплексными соединениями.
Почему в состав хелатов входят преимущественно пяти- и шестичленные циклы? Что такое «хелатный эффект»?
Комплексный ион [Cu(NH3)4]2+ можно легко получить при взаимодействии Cu2+ с NH3. Однако в кислой среде этот комплексный ион легко разрушается. Ион [Cr(NH3)6]3+ получить трудно, но в отличие от катиона тетраамминмеди он устойчив даже при кипячении в концентрированной серной кислоте. Объясните данные факты.
Что такое условная константа образования комплекса и как она связана с соответствующей реальной константой? Объясните характер влияния рН на величину условной константы образования комплекса кальция с ЭДТА.
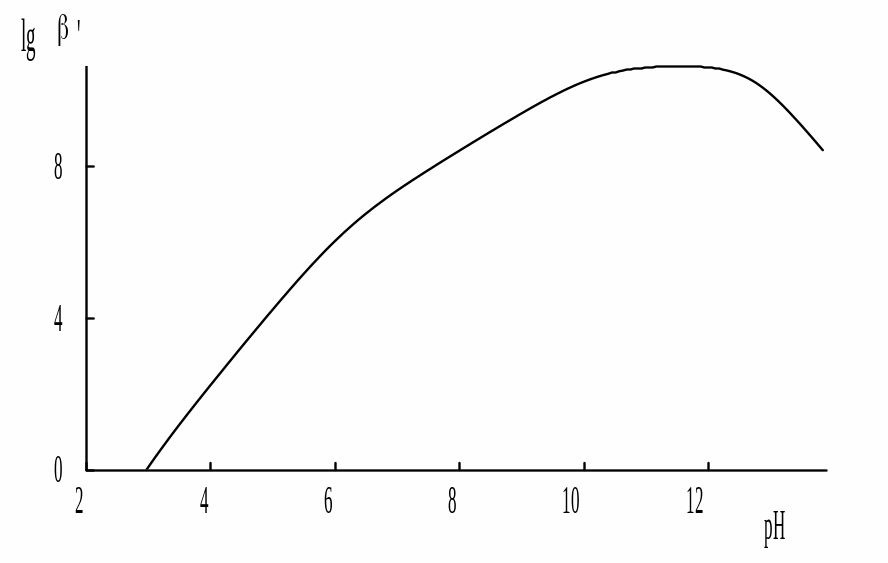
На графике, приведенном ниже, показана зависимость устойчивости галогенидных комплексов железа (III) от природы галогенид-иона (бромид, хлорид, фторид). Используя теорию жёстких и мягких кислот и оснований, определите каким галогенам соответствуют точки А, B и C. Как будет выглядеть аналогичная зависимость для галогенидных комплексов серебра?

Отметьте в приведенной ниже формуле органического соединения функциональные группы, участвующие в хелатообразовании. Напишите структуру хелатного цикла. К какой группе хелатообразующих реагентов относится данное вещество?
1. Координационное число и степень окисления центрального иона в комплексном соединении NH4[Cr(SCN)4(NH3)2] соответственно равны:
1) 4 и +2; 2) 6 и +2; 3) 4 и +3; 4) 6 и +3; 5) 6 и +6.
2. Десятичный логарифм константы образования некоторого комплексного соединения равен 5. Чему равна константа нестойкости этого комплекса?
1) 110-5; 2) 1105; 3) 5; 4) –5; 5) 110-9.
3. Какой из перечисленных ниже комплексных ионов является самым неустойчивым (в скобках приведены значения lg4)?
1) [Cd(NH3)4]2+ (6,56); 2) [Co(NH3)4]2+ (5,07);
3) [Cu(NH3)4]2+ (12,03); 4) [Ni(NH3)4]2+ (7,47);
5) [Zn(NH3)4]2+ (9,46).
4. Какие из перечисленных ниже частиц относятся по Пирсону к жёстким кислотам
1) Hg2+; 2) Li+; 3) Cu+; 4) Cs+; 5) Fe3+.
5. Концентрационная общая константа образования какого комплексного соединения при ионной силе 0,2 будет сильнее всего отличаться от соответствующей термодинамической константы?
1) [Fe(SCN)]2+; 2) [Fe(SCN)2]+; 3) [Fe(SCN)3]; 4) [Fe(SCN)5]2-.
5) [Fe(SCN)6]3-.
6. Для каких из перечисленных ниже комплексных частиц понижение рН приводит к заметному уменьшению условной константы устойчивости?
1) [Ag(NH3)2]+; 2) [AgBr2]-; 3) [Ag(CN)2]-; 4) [Ag(SCN)2]-;
5) [Ag(NH2OH)2]+.
7. Какие из перечисленных органических реагентов являются O,N-хелатообразующими лигандами?
1) ализарин; 2) дитизон; 3) 8-гидроксихинолин;
4) 1,10-фенантролин; 5) ЭДТА.
8. Какие из веществ, формулы которых приведены ниже, могут взаимодействовать с катионами металлов, образуя хелаты?
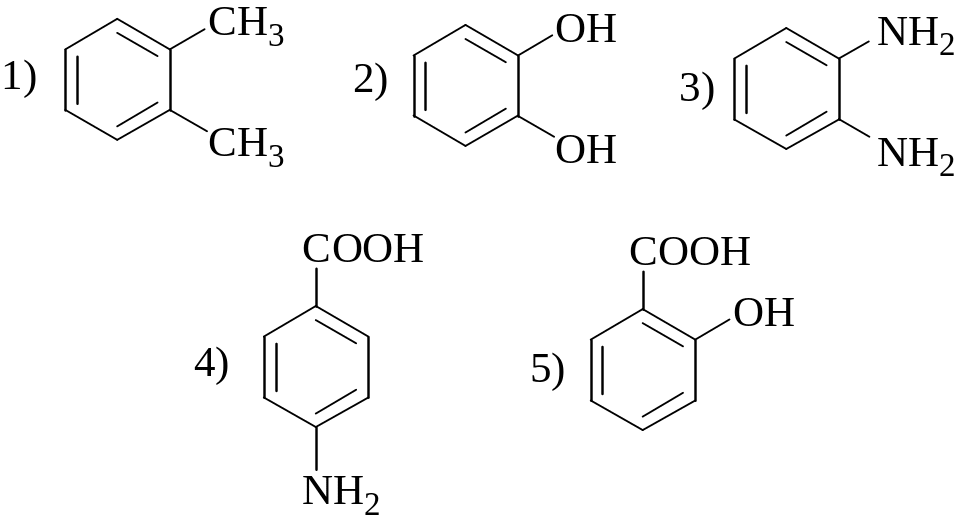
9. Найдите ряд, все представители которого могут обесцвечивать водный раствор I2
1) AsO33-, BO2-, CO32-;
2) S2O32-, PO43-, SO32-
3) SO32-, S2O32-, AsO43-;
4) SO42-, SO32-, F-;
5) SO32-, S2O32-, AsO33-.
10. Аналитическим эффектом реакции иона SO32- с фуксином является:
1) выпадение белого осадка;
2) выделение бесцветного и не имеющего запаха газа;
3) исчезновение окраски реагента;
4) появление зелёной окраски;
5) появление кристаллов характерной формы.
Смешали по 50,0 мл 3,010-2 М CaCl2 и 5,010-2 М ЭДТА. Рассчитайте равновесную концентрацию ионов Ca2+ в растворе, если рН раствора равен 10,00. Величина pKa частицы HY3- этилендиаминтетрауксусной кислоты составляет 10,26.
Константа образования комплекса иона кальция с ЭДТА описывается выражением
![]()
Равновесная концентрация Ca2+ не равна равновесной концентрации Y4-, так как в растворе протекают следующие процессы:
Y4- + H3O+ HY3- + H2O
HY3- + H3O+ H2Y2- + H2O и т.д.
Практически при рН 10,0 концентрация частиц H2Y2- и частиц, образующихся при дальнейшем протонировании, настолько мала, что её можно не учитывать.
[Ca2+] = CЭДТА [Y4-] + [HY3-]
Рассчитаем молярную долю аниона Y4- среди всех форм существования ЭДТА в растворе
![]()
Рассчитаем значение условной константы образования комплекса при рН 10,00.
![]()
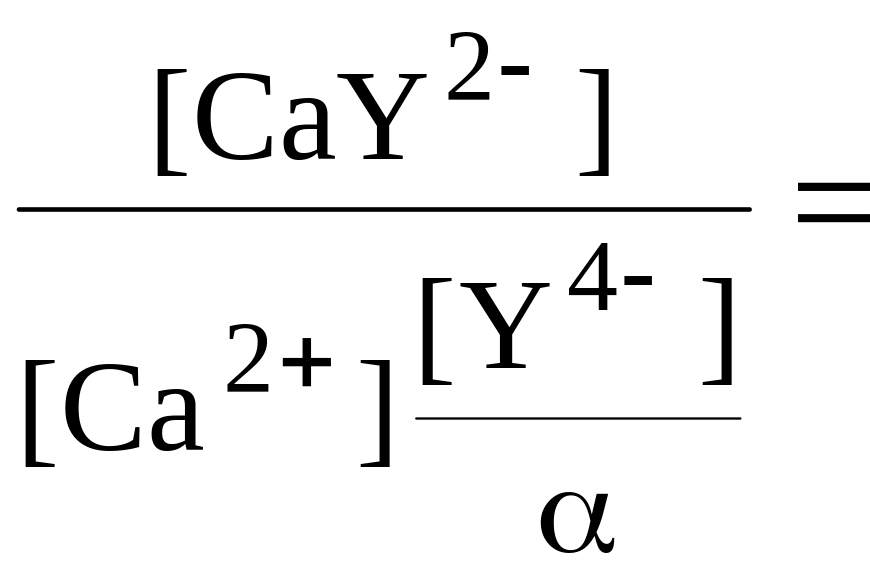
![]() 1,81010
1,81010
![]()
При смешивании 50,0 мл 3,010-2 М CaCl2 и 50,0 мл 5,010-2 М ЭДТА последнее вещество будет оставаться в избытке. Так как степень диссоциации комплекса достаточно мала, то можно считать, что
![]() моль/л
моль/л
![]() моль/л
моль/л
![]() моль/л
моль/л
Константа образования комплекса [Zn(NH3)]2+ из Zn2+ и NH3 равна 151, а константа образования комплекса [Zn(NH3)2]2+ из [Zn(NH3)]2+ и NH3 - 178. Чему равна общая константа нестойкости [Zn(NH3)2]2+? Ответ: 3,7210-5.
Рассчитайте величину общей концентрационной константы образования [Fe(SCN)3] при ионной силе 2,010-1. Ответ: 9,6102.
Рассчитайте равновесную концентрацию ионов Ag+ в растворе с общей концентрацией Ag+ 1,010-2 моль/л и равновесной концентрацией NH3 1,010-3 моль/л. Рассчитайте значение среднего лигандного числа и сделайте вывод о том, какой аммиачный комплекс серебра будет преимущественно находиться в таком растворе. Константы образования аммиачных комплексов серебра равны: 1 = 2,1103, 2 = 1,7107. Ответ: 5,010-4 моль/л; 1,8; [Ag(NH3)2]+.
Рассчитайте условную общую константу образования комплекса [AlF6]3- при рН 1,0. Ответ: 2,4107.
Рассчитайте равновесную концентрацию иона Ca2+ в 5,010-3 М Ca(NO3)2 при рН 13,0. Значения констант образования гидроксидных комплексов кальция равны: 1 = 14, 2 = 350. Ответ: 8,510-4 моль/л.
Рассчитайте величину концентрационной константы образования комплексного соединения HgCl2 при ионной силе 5,010-2, если величина термодинамической общей константы образования данного комплекса составляет 1,71013.
Какой должна быть равновесная концентрация ионов S2O32-, чтобы молярная доля [Ag(S2O3)]- (lg1 = 8,82) в растворе была в 5 раз больше молярной доли [Ag(S2O3)2]3- (lg2 = 13,46)?
Рассчитайте равновесную концентрацию [Fe(SCN)]2+ при [SCN-] = 1,010-2 моль/л и общей концентрации Fe(III) 1,010-1 моль/л с учётом того, что в растворе присутствуют частицы Fe3+, [Fe(SCN)]2+ (lg1 = 3,03) и [Fe(SCN)2]+ (lg2 = 4,33).
Рассчитайте равновесную концентрацию частиц HgCl2, а также величину среднего лигандного числа для раствора с общей концентрацией Hg(II) 1,010-1 моль/л и равновесной концентрацией Cl- 1,010-1 моль/л. Величины констант образования хлоридных комплексов ртути (II) равны: 1 = 5,5106, 2 = 1,71013, 3 = 1,51014, 4 = 1,71015.
К 100 мл раствора с массовой долей AgNO3 1,010-1 % прибавили 100 мл раствора с массовой концентрацией NH3 10,0 г/л. Рассчитайте равновесную концентрацию ионов Ag+ в полученном растворе.
Рассчитайте равновесную концентрацию Zn2+ в аммиачном буферном растворе при равновесной концентрации NH3 1,010-2 моль/л и общей концентрации цинка 1,010-1 моль/л. Константы образования аммиачных комплексов цинка равны 1 = 1,5102, 2 = 2,7104, 3 = 8,5106, 4 = 1,2109, 5 = 2,9109, 6 = 5,61012.
Рассчитайте условную общую константу образования [Ag(NH3)2]+ при рН 8,0.
Рассчитайте условную константу образования комплекса цинка с ЭДТА при рН 10,0 и в присутствии аммиачного буферного раствора, если равновесная концентрация NH3 равна 0,50 моль/л. Считать, что в данных условиях в растворе присутствует только комплексный ион [Zn(NH3)6]2+ (6 = 5,61012).
Смешали по 25,0 мл 1,010-2 М BaCl2 и 1,010-2 М ЭДТА. Рассчитайте равновесную концентрацию ионов Ba2+ в растворе, если рН раствора равен 10,20.
К раствору с концентрацией [Fe(SCN)]2+ 1,010-4 моль/л прибавляют фторид натрия, при этом образуются бесцветные фторидные комплексы Fe(III) и окраска раствора исчезает. Рассчитайте, при какой общей концентрации фторид-иона в растворе окраска перестанет быть заметной (концентрация тиоцианатного комплекса железа станет меньше 610-6 моль/л). При расчётах примите, что в растворе имеется следующее равновесие:
[Fe(SCN)]2+ + F- [FeF]2+ + SCN-
Константы образования [Fe(SCN)]2+ и [FeF]2+ равны, соответственно, 1,1103 и 1,1106.
РЕАКЦИИ ОБНАРУЖЕНИЯ АНИОНОВ I АНАЛИТИЧЕСКОЙ ГРУППЫ
Реакции ионов SO32-
1. Растворимые соли Ba2+
Ba2+ + SO32- BaSO3
белый
Осадок растворим в минеральных кислотах.
2. Нитрат серебра
2Ag+ + SO32- Ag2SO3
белый
Осадок растворяется в HNO3 и при добавлении избытка SO32-. При нагревании осадок чернеет.
Ag2SO3 + 2HNO3 2AgNO3 + SO2 + H2O
Ag2SO3 + SO32- 2[Ag(SO3)]-
Ag2SO3 + H2O 2Ag + 2H+ + SO42-
3. Разбавленные кислоты (HCl, H2SO4)
SO32- + 2H+ SO2 + H2O
запах горящей серы
4. Перманганат калия в кислой среде
5SO32- + 2MnO4- + 6H+ 5SO42- + 2Mn2+ + 3H2O
обесцвечивание раствора
5. Раствор иода
SO32- + I2 + H2O SO42- + 2I- +2H+
исчезновение бурой окраски
6. Фуксин
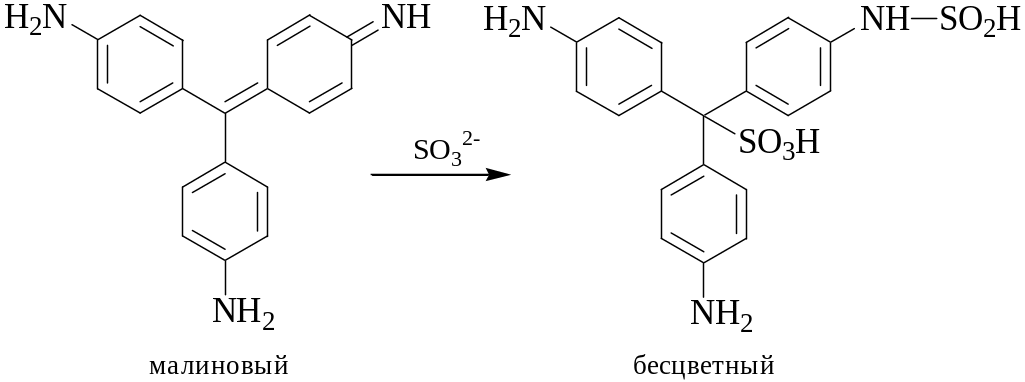
Исходный раствор фуксина окрашен в малиновый цвет при рН 3-12. Оптимальное значение рН для обнаружения SO32- составляет 3-6. Обесцвечивание раствора фуксина должно происходить мгновенно. Проведению реакции мешает ион S2-.
На фильтровальную бумажку наносят 1 каплю раствора фуксина и 1 каплю раствора соли SO32-.
7. Нитропруссид натрия Na2[Fe(CN)5NO]
При взаимодействии SO32- с Na2[Fe(CN)5NO] в нейтральной среде появляется красное окрашивание (продукт реакции неизвестен). Соли Zn2+ усиливают окраску.
Реакции ионов S2O32-
1. Растворимые соли Ba2+
Ba2+ + S2O32- BaS2O3
белый
Тиосульфат бария склонен к образованию пересыщенных растворов. Для ускорения образования осадка внутренние стенки пробирки можно потереть стеклянной палочкой.
2. Нитрат серебра
2Ag+ + S2O32- Ag2S2O3
белый
Осадок растворяется при добавлении избытка Na2S2O3
Ag2S2O3 + 3S2O32- 2[Ag(S2O3)2]3-
Цвет осадка постепенно изменяется от жёлтого до чёрного.
Ag2S2O3 + H2O Ag2S + 2H+ + SO42-
В 1-ю пробирку вносят 3-4 капли раствора AgNO3 и 2-3 капли раствора Na2S2O3. Наблюдают выпадение осадка и изменение его цвета при стоянии. Во 2-ю пробирку вносят 1-2 капли раствора AgNO3 и добавляют по каплям раствора Na2S2O3 до растворения образовавшегося осадка.
3. Разбавленные кислоты
S2O32- + 2H+ SO2 + S + H2O
запах горящей серы муть
4. Перманганат калия в кислой среде
2MnO4- + 3S2O32- + 6H+ 2Mn2+ + S4O62- + 2SO42- + 3H2O
обесцвечивание раствора
5. Раствор иода
2S2O32- + I2 S4O62- + 2I-
обесцвечивание раствора
Реакцию проводят в нейтральной среде.
Реакции ионов SO42-
1. Растворимые соли Ba2+
Ba2+ + SO42- BaSO4
белый
2. Растворимые соли Pb2+
Pb2+ + SO42- PbSO4
белый
Осадок растворим в щелочах и при нагревании в концентрированном растворе CH3COONH4.
3. Родизонат бария
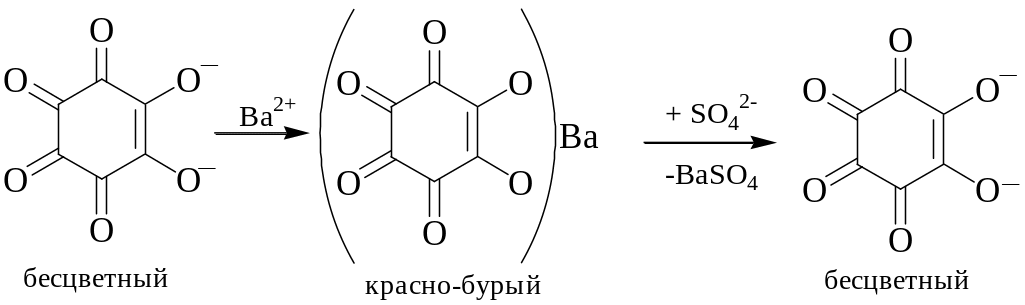
На фильтровальную бумажку наносят по 1 капле растворов родизоната натрия (калия) и соли Ba2+. Появляется красно-бурое окрашивание. На окрашенное пятно наносят 1 каплю раствора, содержащего SO42-. Окраска исчезает.
Реакции ионов СO32-
1. Растворимые соли Ba2+
Ba2+ + СО32- BaСО3
белый
Осадок растворяется в кислотах.
2. Разбавленные кислоты
CO32- + 2H+ CO2 + H2O
газ без цвета и запаха
3. Растворимые соли Mg2+
2Mg2+ + 2CO32- + H2O (MgOH)2CO3 + CO2
белый аморфный
Осадок растворяется в кислотах.
Реакции ионов C2O42-
1. Растворимые соли Ba2+
Ba2+ + С2О42- BaС2О4
белый
Осадок растворяется в минеральных кислотах и при кипячении в уксусной кислоте.
2. Растворимые соли Са2+
Са2+ + С2О42- СаС2О4
белый
Осадок растворяется в минеральных кислотах.
3. Перманганат калия в кислой среде
2MnO4- + 5C2O42- + 16H+ 2Mn2+ + 10CO2 + 8H2O
обесцвечивание раствора
Реакция при комнатной температуре протекает медленно, поэтому проводить её следует при нагревании. Катализатором являются ионы Mn2+.
К нескольким каплям раствора, содержащего C2O42-, прибавляют несколько капель раствора H2SO4, нагревают до 70-80С и затем по каплям добавляют раствор KMnO4.
Реакции ионов BO2-, B4O72-
1. Растворимые соли Ba2+
Ba2+ + B4O72- + 3H2O Ba(BO2)2 + 2H3BO3
белый
Осадок растворяется в кислотах.
2. Куркумин

В пробирке смешивают 3-5 капель раствора Na2B4O7 и 1-2 капли раствора HCl. В полученную смесь опускают полоску куркумовой (куркуминовой) бумаги (фильтровальной бумажки, смоченной раствором куркумина и высушенной). Бумажка окрашивается в красно-бурый цвет. Затем бумажку подсушивают и наносят на неё 1 каплю раствора NH3. Наблюдают изменение окраски.
3. Реакция образования этилового эфира борной кислоты
B4O72- + 2H+ + 5H2O 4H3BO3
H3BO3 + 3C2H5OH B(C2H5O)3 + 3H2O
окрашивание пламени в зелёный цвет
В выпарительную чашку помещают 5 капель раствора Na2B4O7, выпаривают досуха и охлаждают. К сухому остатку добавляют при перемешивании стеклянной палочкой 3 капли концентрированной H2SO4, а затем 5 капель C2H5OH. Смесь перемешивают и поджигают.
Реакции ионов F-
1. Растворимые соли Ba2+
Ba2+ +2F- BaF2
белый
Осадок растворяется в кислотах
2. Роданид железа
Fe(SCN)3 + 6F- [FeF6]3- + 3SCN-
красный обесцвечивание раствора
В пробирку вносят по несколько капель растворов солей Fe3+ и SCN-. Затем добавляют твёрдый NaF до исчезновения окраски.
3. Цирконализариновый комплекс
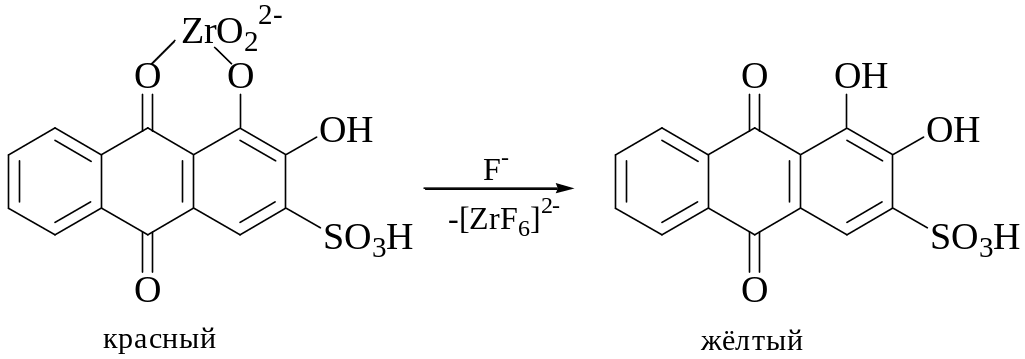
На фильтровальную бумагу, пропитанную раствором ализаринсульфоната натрия, помещают 1 каплю раствора соли циркония - появляется красная окраска. Затем на окрашенное пятно помещают 1 каплю раствора соли F-.
Реакции ионов PO43-
1. Растворимые соли Ba2+
в нейтральной среде: Ba2+ + HPO42- BaHPO4
белый
в щелочной среде: 3Ba2+ + 2PO43- Ba3(PO4)2
белый
Осадки растворяются в кислотах.
2. Нитрат серебра
3Ag+ + PO43- Ag3PO4
жёлтый
Осадок растворяется в растворах HNO3 и NH3.
3. Магнезиальная смесь (Mg2+ и аммиачный буферный раствор)
Mg2+ + HPO42- + NH3 MgNH4PO4
белый кристаллический
Свойства осадка и условия проведения реакции см. с. 40 - 41.
4. Молибдат аммония (NH4)2MoO4 в присутствии HNO3
PO43- + 3NH4+ + 12MoO42- + 24H+ (NH4)3[PMo12O40] + 12H2O
жёлтый кристаллический
Осадок растворяется в растворе аммиака и щелочах. При проведении реакции реагент добавляют в большом избытке.
В пробирку вносят 4 капли раствора (NH4)2MoO4, 5 капель раствора HNO3, 2-3 капли раствора NH4Cl и 1 каплю раствора Na2HPO4. Раствор слегка подогревают и, если необходимо, выдерживают некоторое время.
Молибден в (NH4)3[PMo12O40] обладает более сильными окислительными свойствами, чем в MoO42-. Продукты его восстановления имеют синюю окраску и называются молибденовой синью.
На фильтровальную бумагу помещают 1 каплю исследуемого раствора, содержащего PO43-, прибавляют 1 каплю раствора (NH4)2MoO4, 1 каплю раствора HNO3 и раствор бензидина. Появляется синяя окраска. Бензидин окисляется фосфорномолибденовой кислотой до бензидиновой сини. Одновременно образуется продукт восстановления фосфорномолибденовой кислоты - молибденовая синь.
Реакции ионов AsO33- (AsO2-) и AsO43-
1. Нитрат серебра
3Ag+ + AsO33- Ag3AsO3 3Ag+ + AsO43- Ag3AsO4
жёлтый коричнево-бурый
Осадки растворяются в растворах HNO3 и NH3.
2. Сероводород
2AsO2- + 2H+ + 3H2S As2S3 + 4H2O
жёлтый
Реакцию проводят в сильнокислой среде. При взаимодействии AsO43- c H2S образуются As2S5, As2S3 и S. Осадки As2S5 и As2S3 растворяются в растворах щелочей, NH3, карбонатов, сульфидов и полисульфидов щелочных металлов и аммония, концентрированной HNO3 и не растворяются в концентрированной HCl.
3. Молибдат аммония (NH4)2MoO4 в присутствии HNO3
AsO43- + 3NH4+ + 12MoO42- + 24H+ (NH4)3[AsMo12O40] + 12H2O
жёлтый
Реакция похожа на реакцию PO43- c этим же реагентом, отличается тем, что проходит при нагревании (почти до кипения). Осадок растворяется в щелочах, растворе NH3. Ионы AsO33- в данную реакцию не вступают.
В пробирку вносят 2-3 капли раствора соли AsO43- прибавляют 10-15 капель раствора (NH4)2MoO4 в HNO3, немного твёрдого NH4NO3 и нагревают содержимое пробирки на водяной бане в течение нескольких минут.
4. Иод/иодид калия
Ионы AsO33- по отношению к сопряжённой окислительно-восстановительной паре I2/2I- ведут себя как восстановители, а ионы AsO43- - как окислители:
I2 + AsO33- + H2O AsO43- + 2I- + 2H+
исчезновение бурой окраски
AsO43- + 2I- + 2H+ AsO33- + I2 + H2O
появление бурой окраски
Первая реакция протекает в нейтральной или слабощелочной среде (к нескольким каплям исследуемого раствора прибавляют немного твёрдого NaHCO3 и после растворения 1 каплю раствора I2), а вторая - в кислой.
