
- •Класифікація розчинників
- •Константи сполучених кислот і основ
- •Відповідно для основ маємо
- •Автопротоліз амфіпротонних розчинників
- •Кислоти і основи в розчинах-амфолітах. Сильні і слабкі протоліти
- •Значення і для деяких протолітичних пар у водних розчинах
- •РН розчинів сильних протолітів
- •Значення функції кислотності Гаммета для системи при температурі 25° с
- •РН розчинів слабких кислот
- •Розрахунок рН розчинів слабких основ
- •Розрахунок рН розчинів амфолітів
- •Розрахунок рН буферних розчинів
- •Розведення буферного розчину
- •Розрахунок буферної ємності
Розрахунок рН розчинів слабких основ
Для обчислення рН слабких основ виводимо рівняння аналогічно розчинам слабких кислот, використовуючи константу основності.
![]() (1.78)
(1.78)
![]() (1.79)
(1.79)
![]() (1.80)
(1.80)
![]() (1.81)
(1.81)
![]() (1.82)
(1.82)
![]() (1.83)
(1.83)
І на підставі йонного добутку води:
![]() (1.84)
(1.84)
Якщо
ступінь дисоціації основи менше 5 % чи
![]() ,
то користуємося спрощеними рівняннями:
,
то користуємося спрощеними рівняннями:
![]() (1.85)
(1.85)
![]() (1.86)
(1.86)
![]() (1.87)
(1.87)
Приклад
6.
Обчислити pН 0,10 М розчину оцтовокислого
натрію
![]()
Знаходимо рН за формулою (1.87):
![]()
Розрахунок рН розчинів амфолітів
Речовини, здатні і віддавати, і приєднувати протони, називаються амфотерними.
Амфоліти
можуть бути і зарядженими
![]() і нейтральними
і нейтральними
![]() .
Розчин амфоліту можна розглядати як
наполовину відтитровану двоосновну
кислоту
.
Розчин амфоліту можна розглядати як
наполовину відтитровану двоосновну
кислоту
![]() .
.
Рівняння матеріального балансу для такої системи виглядає так:
![]() .
(1.88)
.
(1.88)
Оскільки число відданих протонів дорівнює числу приєднаних протонів, те
![]() .
(1.89)
.
(1.89)
Якщо
![]() і
і
![]() виразити з
виразити з
![]() і
і
![]() , то одержимо:
, то одержимо:
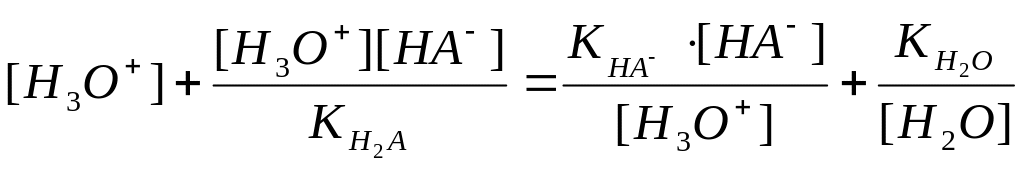
![]()
Звідси:
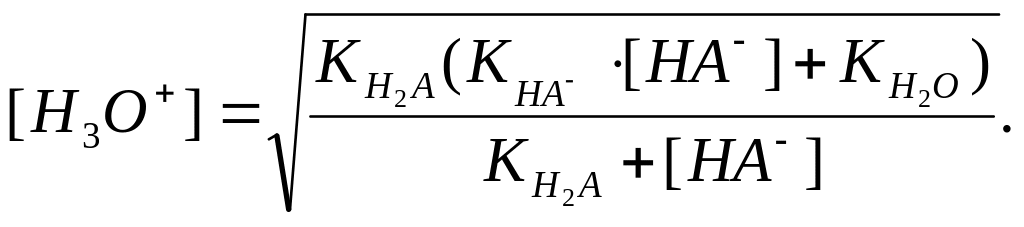
Для застосування робиться ряд спрощень:
якщо
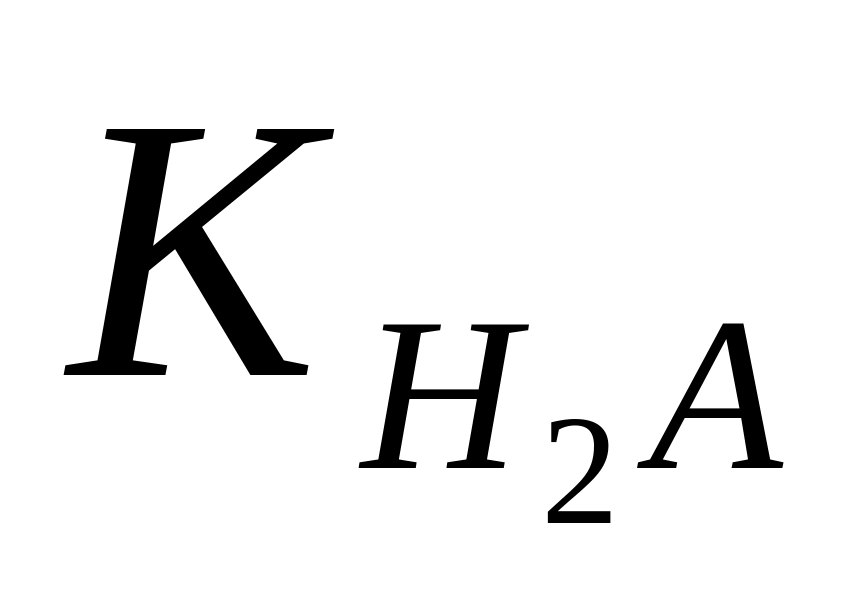 і
і
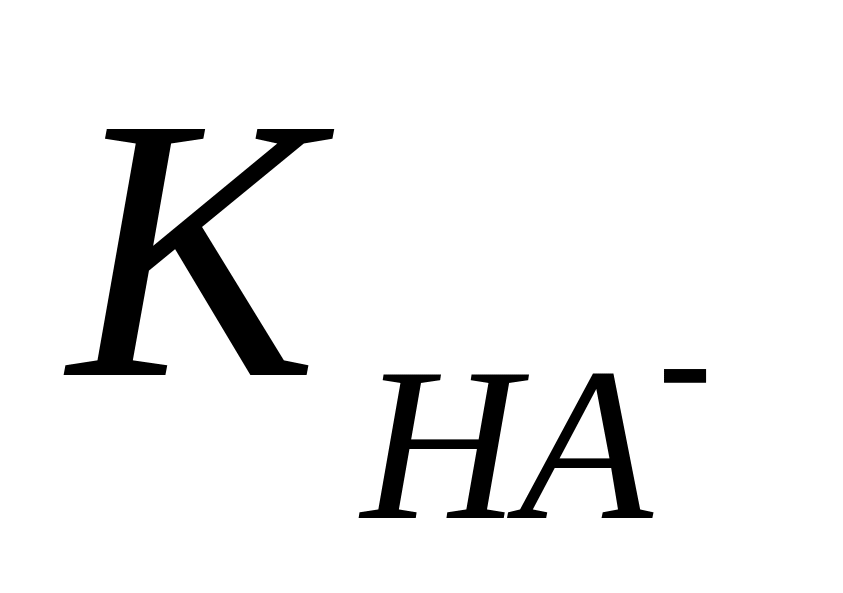 не занадто близькі, то можна прийняти,
що
не занадто близькі, то можна прийняти,
що
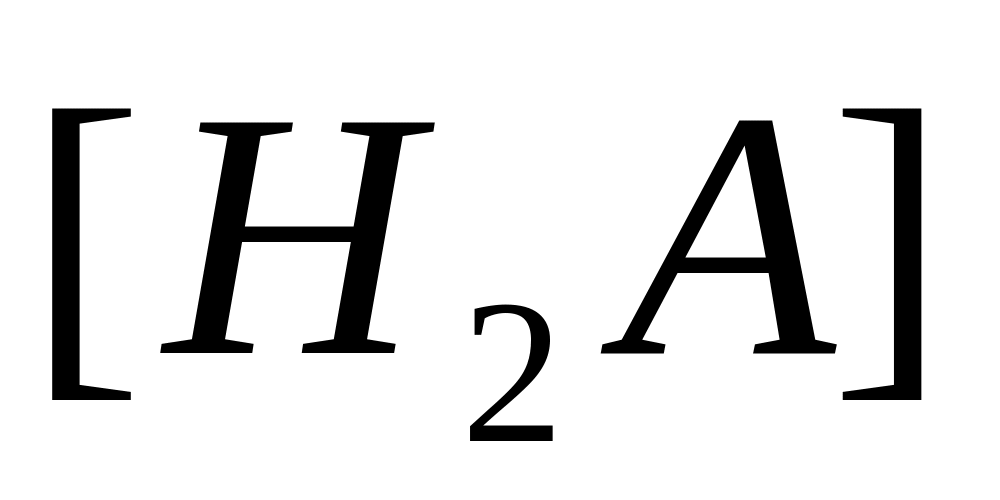 і
і
![]() . Тоді
ми можемо підставити
. Тоді
ми можемо підставити
![]() :
:
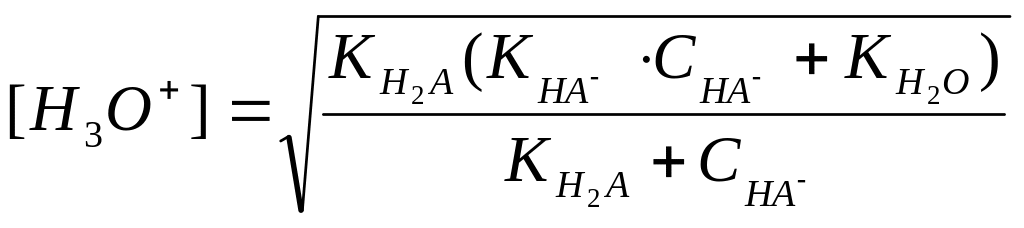 ;
;
якщо
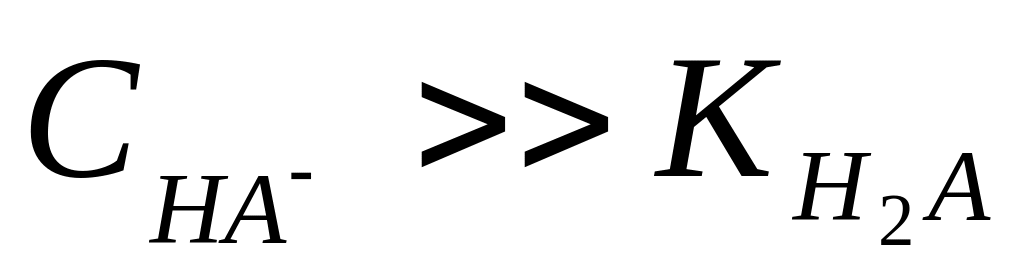 ,
то
,
то
 ;
;
якщо
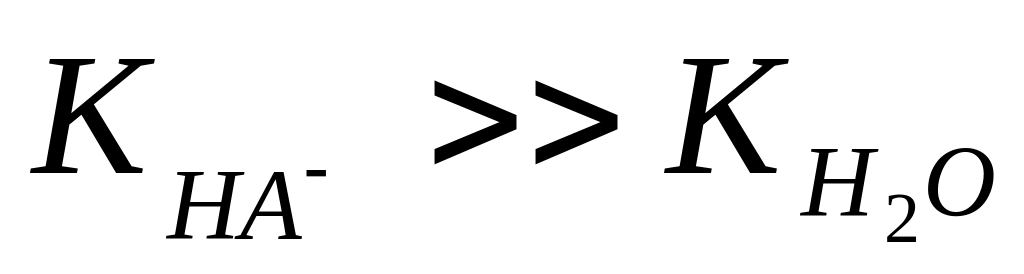 ,
тобто можна зневажити
,
то
,
тобто можна зневажити
,
то
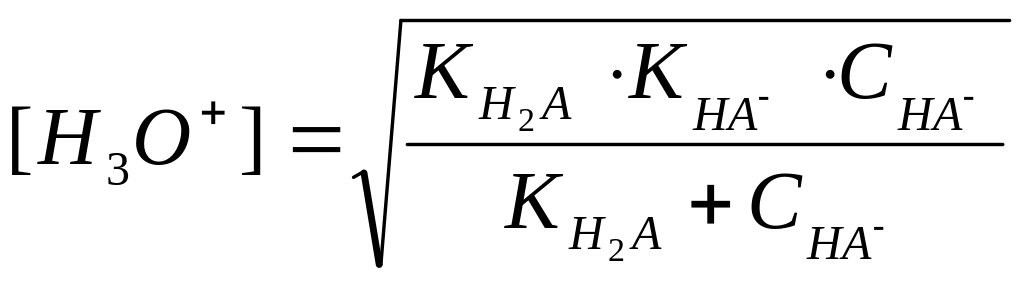 ;
;
якщо і
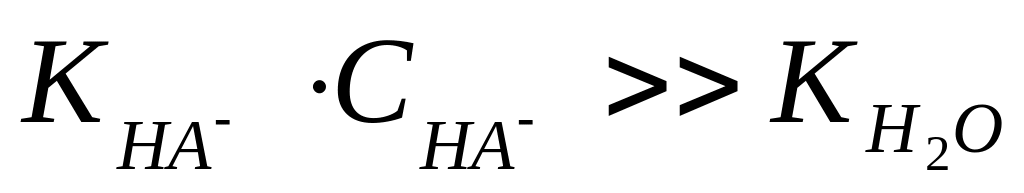 ,
то
,
то
![]() .
.
Приклад 1. Розрахувати 0,01 М розчину гідросульфату натрію.
![]() ;
;
![]()
Тому
що
![]() і
і
![]() ,
те
,
те
![]()
![]()
Приклад 2. Розрахувати рН 0,01 М розчину гідросульфіду натрію.
![]() ;
;
![]() .
.
Тому
що
![]() ,
але
,
але
![]() ,
те
,
те
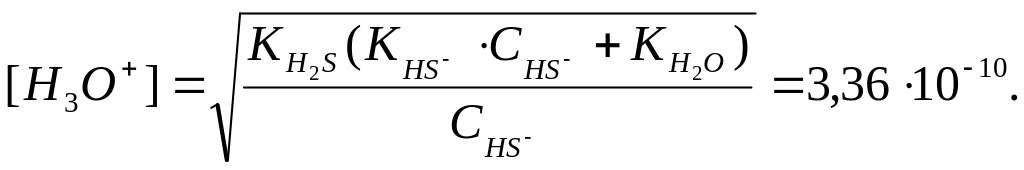
![]() .
.
Приклад 3. Розрахувати рН 0,01 М розчину ціаніду амонію.
![]()
![]()
![]()
За умовою електронейтральності
![]() .
.
Але
тому що
![]() і
і
![]() близькі,
близькі,
![]() ,
то
,
то
![]() .
.
З
огляду на те, що
![]() ,
одержуємо
,
одержуємо
=
Тобто розчин ціаніду амонію можна розглядати як наполовину нейтралізовану суміш двох кислот.
![]() .
.
Розрахунок рН буферних розчинів
Розчини, що зберігають сталість рН при додаванні невеликих кількостей сильних кислот або основ і при розведенні, називаються буферними. Вони складаються із суміші кислоти і сполученої основи.
Для опису кожного буферного розчину важливі наступні характеристики:
рівень рН, на якому підтримується сталість цієї величини;
область буферування, тобто межі рН, у яких може підтримувати сталість рН дана буферна система;
ємність буферного розчину, тобто кількість М–еквівалентів сильної кислоти (основи), яких необхідно додати до 1 л буферного розчину, щоб рН його змінився на 1.
Для
рівноваги в буферній системі
![]() напишемо рівняння електронейтральності:
напишемо рівняння електронейтральності:
![]() (1.90)
(1.90)
і рівняння матеріального балансу:
![]() .
(1.91)
.
(1.91)
Після їхнього підсумовування:
![]() .
(1.92)
.
(1.92)
Але
тому що
![]() ,
те
,
те
![]() .
(1.93)
.
(1.93)
На
практиці звичайно застосовують буферні
розчини, у яких
і
малі в порівнянні з
і
![]() .
Тоді
.
Тоді
![]() і
і
![]() .
.
Підставляючи
знайдені значення у вираз для
![]() ,
одержуємо:
,
одержуємо:
![]() чи
(1.94)
чи
(1.94)
![]() (1.95)
(1.95)
Це
рівняння не виконується для кислот чи
основ з константами дисоціації вище
![]() у випадку, якщо загальна концентрація
кислот чи сполученої основи (чи обох
компонентів кислотно-сполученої пари)
дуже мала.
у випадку, якщо загальна концентрація
кислот чи сполученої основи (чи обох
компонентів кислотно-сполученої пари)
дуже мала.
Для буферних розчинів із рН 7 розрахунок простіше проводити, використовуючи константу дисоціації основи:
![]() (1.96)
(1.96)
Приклад 1. Розрахувати рН буферного розчину, що складається з 0,4000М мурашиної кислоти і 1,0000 М форміату натрію.
![]() ,
,
![]()
Приклад
2.
Розрахувати рН буферного розчину, що
містить 0,2800 М
![]() і 0,0700 М
і 0,0700 М
![]()
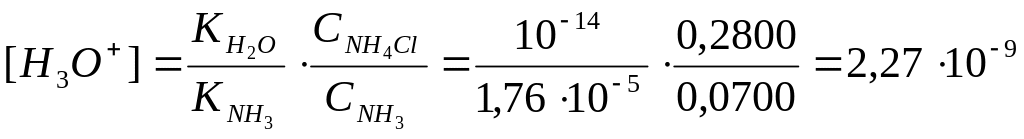 ,
,
![]() .
.
