
- •Лабораторная работа 1 определение энтальпии реакции нейтрализации
- •5. Расчёт молярной энтальпии нейтрализации:
- •Лабораторная работа 2 скорость химической реакции, химическое равновесие
- •Лабораторная работа 3 приготовление растворов
- •Лабораторная работа 4 электролитическая диссоциация, произведение растворимости
- •Лабораторная работа 5 водородный показатель, гидролиз солей
- •Лабораторная работа 6 основы электрохимии
- •Приложения
- •З. Растворимость солей, кислот и оснований в воде
- •Литература для самоподготовки
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
"РОСТОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ"
Шукаев И.Л.
ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
Пособие для студентов 1 курса
геологических специальностей
Ростов-на-Дону
2006
Шукаев Игорь Леонидович
ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ
Пособие для студентов 1 курса геологических специальностей
Печатается по решению кафедры общей и неорганической химии Ростовского государственного университета.
Протокол N 8 от " 30" июня 2006 г.
Рецензент – к.т.н., ст.преп. Рыбальченко И.В.
Ответственный редактор – д.х.н., профессор Т.Г.Лупейко.
ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ 3
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ, ХИМИЧЕСКОЕ РАВНОВЕСИЕ 6
ПРИГОТОВЛЕНИЕ РАСТВОРОВ 12
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ 16
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ, ГИДРОЛИЗ СОЛЕЙ 19
ОСНОВЫ ЭЛЕКТРОХИМИИ 22
ПРИЛОЖЕНИЯ 27
ЛИТЕРАТУРА ДЛЯ САМОПОДГОТОВКИ 27
Лабораторная работа 1 определение энтальпии реакции нейтрализации
Реакцией нейтрализации называют взаимодействие кислоты и основания с образованием соли и воды.
Запишите молекулярные уравнения реакций:
а) соляной кислоты с гидроксидом натрия; б) соляной кислоты с гидроксидом алюминия; в) азотной кислоты с гидроксидом калия; г) уксусной кислоты с гидроксидом натрия.
Те же уравнения представьте в ионном виде. Слабые электролиты (уксусная кислота, гидроксид алюминия) разлагать на ионы не нужно.
Реакция нейтрализации идёт с выделением тепла (экзотермический процесс).
Как связаны изменения энтальпии, внутренней энергии и тепловой эффект реакции?
Что называют стандартной энтальпией образования вещества? Сформулируйте закон Гесса и следствия из него.
Стандартное значение энтальпии нейтрализации можно рассчитать из стандартных энтальпий образования, пользуясь следствием из закона Гесса.
Пользуясь энтальпиями образования ионов в водных растворах (при концентрации 1 моль/л), а также твёрдого гидроксида алюминия (эти данные – в Приложении А), определите стандартную энтальпию нейтрализации (на 1 моль получающейся воды) для процессов а) – в), объясните различие.
Для работы потребуются: калориметр; стеклянный стакан ёмкостью 100 мл, раствор кислоты (рекомендуется: соляной, азотной, уксусной – 1 моль/л, серной – 0,5 моль/л, так как она диссоциирует с выделением двух ионов H+); раствор щёлочи (рекомендуются гидроксиды натрия или калия: 1 моль/л); термометр на интервал 20–30 °C с точностью до 0,1 °C; мерные цилиндры на 20–30 мл с делением 1 мл.
Измерение теплового эффекта проводят в калориметрах (латинское слово calor – тепло). Простейший калориметр состоит из двух алюминиевых стаканов, разделённых пластиковым теплоизолятором. Его назначение – снижать рассеивание тепла.
О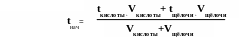 тмерьте
заданное количество кислоты (например,
25 мл), вылейте
в стеклянный стакан, измерьте её
температуру tкислоты.
Установите стеклянный стакан внутрь
калориметра. Отмерьте также заданное
количество щёлочи (например,
20 мл). Вымыв
термометр после кислоты, измерьте
температуру щёлочи tщёлочи
(прямо в
мерном цилиндре). Средняя начальная
температура растворов:
тмерьте
заданное количество кислоты (например,
25 мл), вылейте
в стеклянный стакан, измерьте её
температуру tкислоты.
Установите стеклянный стакан внутрь
калориметра. Отмерьте также заданное
количество щёлочи (например,
20 мл). Вымыв
термометр после кислоты, измерьте
температуру щёлочи tщёлочи
(прямо в
мерном цилиндре). Средняя начальная
температура растворов:
Быстро вылейте щёлочь в кислоту. Помешивая раствор термометром, следите за температурой. Отметьте её наибольшее значение tмакс. Все замеры температуры делайте с точностью не менее 0,1 °C. Пытайтесь оценить и сотые доли градуса.
Изменение температуры в процессе: t1= tмакс – tнач.
Повторите эксперимент, найдите t2 и среднее изменение температуры:
tсреднее=(t1 + t2)/2 .
ПРИМЕР. Начальные температуры кислоты и щёлочи были равны 20,2 °C (совпадали). После сливания растворов достигнута максимальная температура 25,7 °C в первом опыте и 25,9 °C во втором опыте. Тогда:
t1= 25,7 °C–20,2 °C = 5,5 °C, t2= 25,9 °C–20,2 °C = 5,7 °C,
tсреднее= (5,5 °C+5,7 °C)/2 = 5,6 °C =5,6 K (изменение температуры в Кельвинах и градусах Цельсия одинаково).
Выделившееся в результате реакции тепло (Qреакции) идёт на нагревание раствора (Qраствора), стакана (Qстакана) и термометра (Qтермометра).
Количество тепла находят по изменению температуры:
Q = m·C·tсреднее;
где m – масса вещества (стекла или раствора) в граммах, C – удельная теплоёмкость (количество теплоты, необходимое для нагревания 1 грамма вещества на 1 градус).
1. Расчёт Qраствора. Сраствора СH2O = 4,18 Дж/(г·К), раствора 1г/мл (как у воды, так как растворы разбавленные), mраствора = раствора·(Vкислоты+Vщёлочи).
ПРИМЕР. Qраствора= (1 г/мл·45 мл)·4,18 Дж/(г·К)·5,6 К 1053 Дж.
2. Расчёт Qстакана. Сстекла = 0,59 Дж/(г·К). Необходимо взвесить стакан (mстакана). Однако из-за низкой теплопроводности нагревается не весь стакан, а только та его часть, которая находится в контакте с раствором. Qстакана невелика в сравнении с Qраствора. Для простоты можно считать, что нагревается половина массы стакана.
Для более точного расчета понадобятся диаметр стакана D, высота стакана H и высота столба жидкости h. На развертке стакана (смотрите рисунок) нагреваемая площадь (Sконтакта) заштрихована. Нагреваемая масса стакана:
mнагр = Sконтакта/Sобщая·mстакана,
Sконтакта= ·D2/4 + ·D·h, Sобщая= ·D2/4 + ·D·H.
П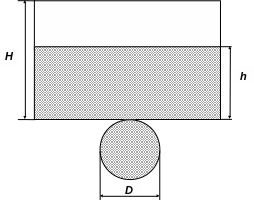 РИМЕР.
Стакан весит 50 г, имеет диаметр 4,5 см,
высоту 9,2 см и столб жидкости 5,0 см.
РИМЕР.
Стакан весит 50 г, имеет диаметр 4,5 см,
высоту 9,2 см и столб жидкости 5,0 см.
Sконтакта= 3,14·(4,5 см) 2/4 + 3,14·4,5 см·5,0 см = 86,5 см2,
Sобщая= 3,14·4,52/4 + 3,14·4,5·9,0 = 143,1 см2,
mнагр= 86,5 см2 / 143,1 см2·50 г = 30,2 г.
Qстакана= 30,2 г·0,59 Дж/(г·К)·5,6 К 100 Дж.
3. Расчёт Qтермометра. Это малая величина. Положим Cтермометра = Cстекла; поскольку нагревается только часть термометра, условно будем считать: mтермометра = 5 г.
ПРИМЕР. Qстакана = 5 г·0,59 Дж/(г·К)·5,6 К 17 Дж.
4. Расчет общей выделившейся теплоты:
Qреакции = Qраствора + Qстакана + Qтермометра.
ПРИМЕР. Qреакции = 1053 Дж + 100 Дж + 17,5 Дж = 1170 Дж.
