
- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
1.1.3. Буферные растворы
Состав, механизм действия. Постоянство концентрации ионов водорода, являющейся одной из важнейших констант организма, поддерживается так называемыми буферными системами, или растворами.
Буферными системами (буферами) называют растворы, обладающие свойством поддерживать (в определенных пределах) постоянное значение рН как при добавлении к ним кислот или оснований, так и при разбавлении их водой.
По своему составу буферные растворы бывают двух типов: кислые (состоят из слабой кислоты и ее соли, полученной при взаимодействии с сильным основанием) и основные (состоят из слабого основания и его соли, образованной с сильной кислотой).
Примером кислой буферной системы служит ацетатный буфер СН3СООН + CH3COONa, основного буферного раствора — аммиачный буфер NH4OH + NH4CI.
Механизм действия буферных растворов можно рассмотреть на примере ацетатного буфера. В этом растворе происходят следующие реакции электролитической диссоциации:

Так как степень диссоциации слабой уксусной кислоты очень мала, практически ее можно считать недиссоциированной. Следовательно, кислотность буферной смеси мала. Натриевая соль уксусной кислоты, являясь сильным электролитом, диссоциирует практически полностью на ионы СН3СОО~ и Na+. Следовательно, концентрация ионов СН3СОО~ практически равна концентрации раствора соли (CH3COONa), а концентрация недиссоциированной кислоты (СН3СООН) равна концентрации всей кислоты в растворе.
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система стремится сохранить при добавлении к ней кислоты или основания. Рассмотрим это на примере ацетатного буфера.
В соответствии с законом действующих масс константа диссоциации уксусной кислоты определяется по формуле:
![]()
Так как концентрация недиссоциированной кислоты ([СН3СООН]) практически равна концентрации всей кислоты в растворе, а концентрация ионов СН3СОО~ равна концентрации соли (CH3COONa ), получим:
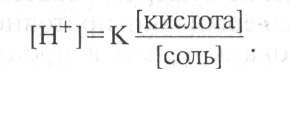
Если растворы кислоты и соли приготовлены в равных концентрациях, то

т. е. концентрация ионов водорода в буфере зависит от соотношения объемов кислоты и соли, взятых для его приготовления.
Из уравнения видно, что при разбавлении буферных растворов водой соотношение концентраций кислоты и соли не изменится, как и значения соответственно [Н+] и рН.
При добавлении в буферный раствор сильной кислоты ионы Н+, образованные при ее диссоциации, будут нейтрализованы (связаны) ионами СН3СОО~ с образованием слабодиссоциирую- щей уксусной кислоты (СН3СООН).
При добавлении в буфер щелочи ее ионы ОН" будут связаны ионами Н+ с образованием Н20, также слабодиссоциирующих молекул. И хотя ионов Н+ образуется при диссоциации кислоты мало, выведение их из реакции смещает равновесие диссоциации кислоты в сторону образования ионов Н+ (принцип Ле- Шателье).
Таким образом, добавление кислоты или щелочи незначительно изменит концентрацию ионор водорода в буферной системе — в этом и заключается механизм функционирования буферных систем.
![]()
где В — буферная емкость; С — количество грамм-эквивалентов сильной кислоты или основания; рН0 — водородный показатель до добавления сильной кислоты или основания; рН[ — водородный показатель после добавления (рН[ — рН2 = 1).
Наибольшей буферной емкостью обладают концентрированные буферные растворы. Из буферных растворов с равной концентрацией наибольшей емкостью будут обладать те, которые составлены из равного количества компонентов.
Биологическое значение буферных систем. Буферные системы в живых организмах поддерживают постоянство рН в крови и тканях. Исследования показали, что в процессе обмена веществ в организме образуется большое количество кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20...30 л 1 н. сильной кислоты. Сохранение постоянства рН среды в организме обеспечивается наличием в нем мощных буферных систем.
Большую роль при этом играют белковый, бикарбонатный и фосфатный буферы. Буферной системой крови служат бикарбонатный и фосфатный буферы: Н2С03 + NaHC03, NaH2P04 + Na2HP04 соответственно.
Однако наиболее мощная буферная система крови — гемоглобиновый буфер (75 % всей буферной емкости крови), который удаляет из организма большое количество диоксида углерода.
Большое значение в поддержании постоянного рН в клетках тканей имеет белковый буфер. Он состоит из протеина (белка) — Pt и его соли. Компоненты этого буфера можно представить так:
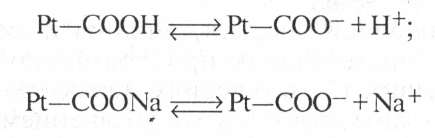
Буферные растворы широко применяют при гистохимических, биохимических исследованиях, а также в бактериологии, вирусологии и биотехнологии (для получения белков, аминокислот, антибиотиков, витаминов, ферментов).
