
- •2. Спектроскопические и другие оптические методы анализа
- •2.1. Основные характеристики электромагнитного излучения
- •2.2. Принципы аналитической оптической спектроскопии
- •2.3. Параметры спектральной полосы и использование спектров для химического анализа
- •2.4. Приборы для оптического спектрального анализа
- •2.4.1.Спектральные приборы и их основные характеристики
- •2.4.2. Приемники излучения
- •2.5. Атомно-эмиссионная спектроскопия
- •Виды атомизаторов
- •2.6. Атомно-адсорбционный спектральный анализ
- •2.7. Фотометрия растворов
- •Основные методы определения концентрации
- •Растворы сравнения (нулевые)
- •Отклонения от основного закона светопоглощения
- •Фотоколориметрическое титрование
- •2.8. Метод инфракрасной спектроскопии
- •2.9. Люминесцентный анализ
- •2.10. Рефрактометрический анализ
- •2.11. Поляриметрический метод анализа
- •2.12. Нефелометрия и турбидиметрия
Основные методы определения концентрации
При определении концентрации растворов используют метод сравнения, метод калибровочного графика и метод добавок.
Метод сравнения заключается в измерении оптической плотности раствора известной концентрации (Аст) и неизвестной (Ах) в одинаковых условиях
Аст=ε∙Сст∙lст Ах= ε∙Сх∙lх, при lст = lх
Ах/Аст = Сх/Сст и Сх= Сст ∙ Ах/Аст
Метод удобен для разовых определений. Для серийных определений лучше использовать метод калибровочного графика.
2. Метод калибровочного графика заключается в приготовлении 5-6 стандартных растворов определяемого вещества различной концентрации и построении графика зависимости от концентрации (рис.2.5). Измерив оптическую плотность раствора неизвестной концентрации, находим последнюю по графику.
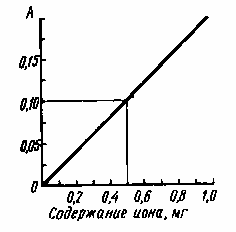
Рис. 2.5. Определение концентрации методом калибровочного графика
3. Метод добавок целесообразно применять для определения малых количеств анализируемых веществ в присутствии больших количеств посторонних веществ. Определение основано на сравнение оптической плотности исследуемого раствора Ах и того же раствора с добавкой известного количества (Са) определяемого вещества:
Ах= ε∙Сх∙lх и Ах+а= ε∙l(Сх+Са)
Ах/Ах+а
= Сх/Сх+а
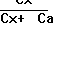 отсюда Сх
= Са
∙
Ах/Ах
+а
– Ах
отсюда Сх
= Са
∙
Ах/Ах
+а
– Ах
Растворы сравнения (нулевые)
Измерение оптической плотности исследуемого и стандартного окрашенных растворов всегда проводят по отношению к раствору сравнения (нулевому). Если исследуемый раствор и добавляемые реактивы бесцветны и, следовательно, не поглощают лучей в видимой области спектра, то в качестве раствора сравнения можно использовать дистиллированную воду. Если же реактив сам имеет окраску, то раствор сравнения включает все компоненты, кроме определяемого иона.
Отклонения от основного закона светопоглощения
Прямо пропорциональная зависимость оптической плотности от концентрации справедлива для очень разбавленных растворов, в которых отсутствуют взаимодействия между поглощающими частицами (молекулами или ионами). При увеличении концентрации закон будет соблюдаться лишь в том случае, когда между частицами не возникает такого взаимодействия, которое могло бы изменить количественно или качественно их способность поглощать световую энергию. Такие процессы как диссоциация, ассоциация, гидролиз, комплексообразование, сольватация, таутомерные превращения, образование коллоидов изменяют характер поглощения света окрашенными растворами и вызывают отклонения от закона (рис.2.6).
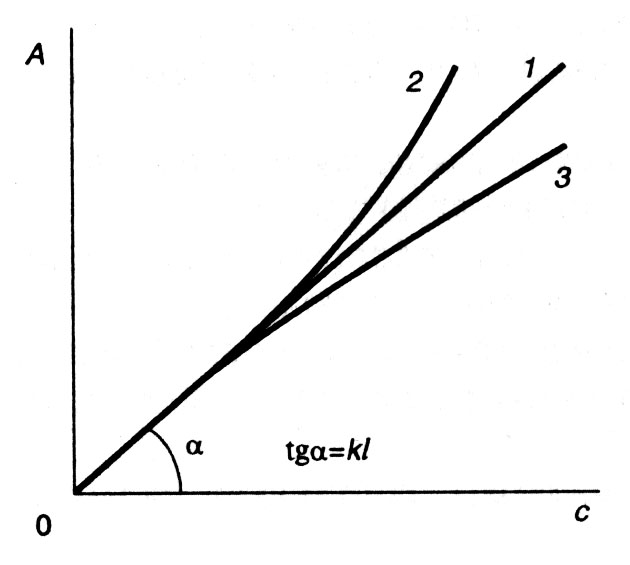
Рис. 2.6. Зависимость А от С при l = const в случае соблюдения основного закона светопоглощения (1), положительных (2) и отрицательных (3) отклонений от него
Изменения температуры, рН, порядка сливания растворов также могут влиять на точность фотоколориметрического анализа.
Фотоколориметрическое титрование
Фотоколориметрическое титрование применяется для определения концентрации раствора в присутствии посторонних веществ, способных поглощать свет. Точку эквивалентности определяют по изменению оптической плотности в процессе титрования (рис. 2.7). Точность титрования соответствует точности фотоколориметрических измерений. Для того чтобы титрант как можно меньше разбавлял раствор, концентрация его должна быть в 20 раз больше концентрации определяемого раствора. На рис. 2.7. изображен случай, когда определяемое вещество поглощает свет, а титрант и продукт – нет.
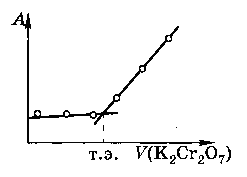
Рис. 2.7. Зависимость оптической плотности от объема раствора
