
- •Раздел 2
- •Глава 11
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
- •Расчёты, связанные с титрованием
- •Глава 13
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •Метиловый красный
- •Тимолфталеин (бесцветный синий)
- •Феноловый красный
- •13.3. Кривые титрования
- •0,10 М раствором NaOh
- •Расчёты для построения кривой титрования
- •Расчёты для построения кривой титрования
- •0,10 М Na2co3 0,10 м раствором hCl
- •13.4. Факторы, влияющие на величину скачка титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.2. Критерии выбора растворителя для кислотно-основного титрования
- •14.3. Применение в фармацевтическом анализе Титрование в кислотных растворителях
- •Глава 15
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •Глава 16
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •Расчёты для построения кривой титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •Метод Мора
- •Метод Фольгарда
- •Особенность определения хлоридов
- •Особенность определения иодидов
- •Метод Фаянса
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •Титранты и стандартные вещества
- •Обнаружение конечной точки титрования
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
Расчёты, связанные с титрованием
В основе всех количественных расчётов в титриметрических методах анализа лежит закономерность: количество эквивалента определяемого вещества равно количеству эквивалента титранта
![]()
Все остальные расчётные формулы получают в зависимости от того, что хотят рассчитать - массу или массовую долю; каким методом проводят титрование - методом отдельных навесок или методом пипетирования и, наконец, как характеризуется количественный состав стандартного раствора титранта - с помощью молярной концентрации вещества, титра раствора, титра соответствия и т.д.
Согласно ИЮПАК эквивалентом называется реальная или условная частица, которая в конкретной кислотно-основной реакции эквивалентна тем или иным образом одному протону или в конкретной окислительно-восстановительной реакции одному электрону.
Т аким
образом, эквивалент - это не масса и не
количество вещества.
аким
образом, эквивалент - это не масса и не
количество вещества.
Понятие «эквивалент» можно применять только к конкретной реакции. Нельзя говорить об эквиваленте вещества вообще.
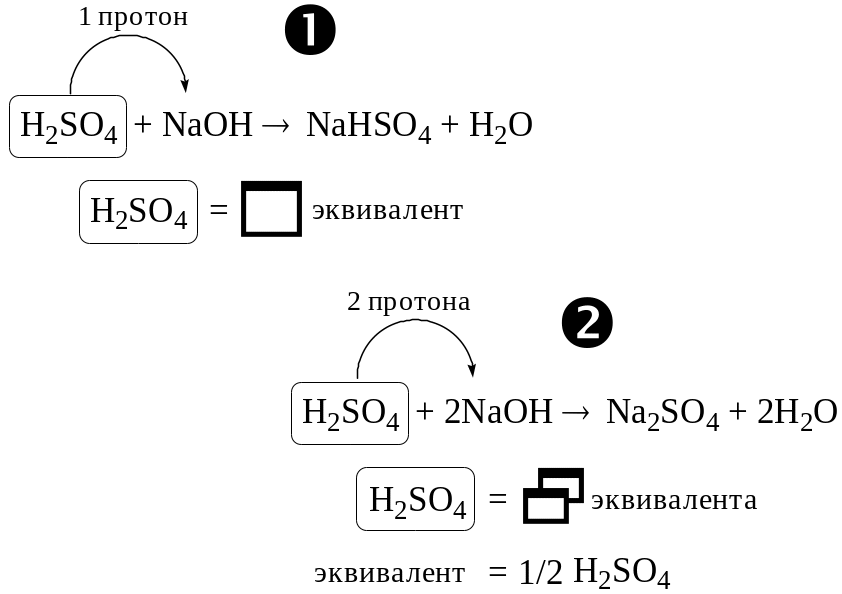
Коэффициент, показывающий какая часть участвующей в реакции частицы эквивалентна одному протону или одному электрону, называется фактором эквивалентности (fэкв). Величина обратная фактору эквивалентности называется эквивалентным числом (z). Для реакции fэкв = z = 1, для реакции fэкв = ½, а z = 2.
Аналогично понятиям «количество вещества» и «молярная масса» существуют понятия «количество эквивалента вещества» и «молярная масса эквивалента вещества». Например, в реакции 1 моль молекул серной кислоты соответствует 2 моль «половинок молекул» серной кислоты, а M(1/2 H2SO4) = 49 г/моль.
Понятие «эквивалент» отнюдь не является «священной коровой» в химии, а используется всего лишь для облегчения расчётов, так как позволяет проводить их без использования стехиометрических коэффициентов в уравнении соответствующей реакции. Для веществ, у которых формульная единица и эквивалент равны между собой (например, HCl или NaOH при кислотно-основном взаимодействии), лучше вообще не пользоваться понятием эквивалента.
Пусть
нам необходимо найти массовую долю
вещества (В),%
имеющего молярную массу M(В),
г/моль, в некотором анализируемом
объекте, имеющем массу g,
г. Для титрования используют раствор с
молярной концентрацией эквивалента
титранта
![]() .
Для титрования израсходовано
.
Для титрования израсходовано
![]() ,
мл этого раствора.
,
мл этого раствора.
![]()
![]()
![]()
![]()
С
помощью полученной формулы можно
рассчитать массовую долю вещества в
анализируемом объекте в случае
использования прямого титрования (либо
титрования заместителя или косвенного)
по методу отдельных навесок. Если
используют метод обратного титрования,
то вместо
![]() берут разность таких произведений для
двух титрантов
берут разность таких произведений для
двух титрантов
![]() .
При проведении анализа методом
пипетирования в расчётную формулу
вводят множитель, называемый фактором
разбавления (
.
При проведении анализа методом
пипетирования в расчётную формулу
вводят множитель, называемый фактором
разбавления (![]() ).
Он показывает, какая часть раствора,
приготовленного из навески, используется
для титрования (т.е. составляет аликвоту).
Если заранее рассчитана величина титра
соответствия, представляющая собой
произведение
).
Он показывает, какая часть раствора,
приготовленного из навески, используется
для титрования (т.е. составляет аликвоту).
Если заранее рассчитана величина титра
соответствия, представляющая собой
произведение
![]() то расчётная формула будет иметь
следующий вид:
то расчётная формула будет иметь
следующий вид:
![]()
Пример 12.2. Навеску массой 1,9500 г образца глазной мази, содержащей HgO, поместили в делительную воронку и растворили мазевую основу в 10 мл диэтилового эфира. К образовавшейся смеси прибавили раствор KI, а затем 10,00 мл 0,1045 М HCl. Для титрования избытка кислоты потребовалось 7,00 мл 0,0998 М NaOH. Рассчитайте массовую долю HgO в анализируемом образце.
Методика определения HgO в глазной мази сочетает в себе титрование заместителя и обратное титрование. При взаимодействии HgO и KI выделяются OH- ионы, которые затем определяют обратным титрованием. Реакция между HgO и KI протекает следующим образом:
HgO + 4KI + H2O K2[HgI4] + 2KOH
![]()
