
- •1 Билет.
- •4 Билет
- •Магнитное поле в веществе
- •5 Билет
- •Вывод основного уравнения мкт
- •Закон Био́—Савара—Лапла́са Для тока текущего по контуру (тонкому проводнику)
- •Для распределенных токов
- •Следствия
- •6 Билет Распределение по вектору скорости
- •Распределение по проекции скорости
- •Распределение по модулю скоростей
- •[Править]в магнитостатике
- •[Править]в общем случае
- •Формула момента рычага
- •[Править]Сила под углом
- •[Править]Статическое равновесие
- •[Править]Момент силы как функция от времени
- •Движение заряженных частиц в магнитном поле
- •Законы — начала термодинамики
5 Билет
![]() ,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (
,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (![]() в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Вывод основного уравнения мкт
Пусть
имеется кубический сосуд с ребром
длиной ![]() и
одна частица массой
и
одна частица массой ![]() в
нём.
в
нём.
Обозначим
скорость движения ![]() ,
тогда перед столкновением со стенкой
сосуда импульс частицы
равен
,
тогда перед столкновением со стенкой
сосуда импульс частицы
равен ![]() ,
а после —
,
а после — ![]() ,
поэтому стенке передается импульс
,
поэтому стенке передается импульс ![]() .
Время, через которое частица сталкивается
с одной и той же стенкой, равно
.
Время, через которое частица сталкивается
с одной и той же стенкой, равно ![]() .
.
Отсюда следует:
![]()
Так
как давление ![]() ,
следовательно сила
,
следовательно сила ![]()
Подставив,
получим: ![]()
Преобразовав: ![]()
Так
как рассматривается кубический сосуд,
то ![]()
Отсюда:
![]() .
.
Соответственно, ![]() и
и ![]() .
.
Таким
образом, для большого числа частиц верно
следующее: ![]() ,
аналогично для осей y и z.
,
аналогично для осей y и z.
Поскольку ![]() ,
то
,
то ![]() .
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
.
Это следует из того, что все направления
движения молекул в
хаотичной среде равновероятны.
Отсюда ![]()
или ![]() .
.
Пусть ![]() —
среднее значение кинетической энергии
всех молекул, тогда:
—
среднее значение кинетической энергии
всех молекул, тогда:
![]() ,
откуда, используя то, что
,
откуда, используя то, что ![]() ,
а
,
а ![]() ,
имеем
,
имеем ![]() .
.
Закон Бойля-Мариотта
Изотермический
процесс (T = const, m = const):
![]() где
где
p1, p2 и p3– давления газа в состоянии 1, 2 и 3 (Па); V1, V2 и V3– объемы газа в состоянии 1, 2 и 3 (м3).
При увеличении объема газа его давление во столько же раз уменьшается и наоборот. Этим можно воспользоваться для проверки результата.
Закон Шарля Изобарический закон в российских учебниках называется законом Гей-Люссака. Процессы можно считать изобарными, если они проходят: в цилиндре с незакрепленным поршнем (без учета трения); в воздушных шариках при небольших растяжениях или сжатиях. Изобарный процесс (p = const; m = const):
P/Т=const
где V1 и V2 – объемы газа в состоянии 1 и 2 (м3 ); T1 и T2 – температуры газа в состоянии 1 и 2 (К). В уравнении задана абсолютная термодинамическая температура (по шкале Кельвина), причем T = (t + 273) К. Нет обязательного условия, чтобы начальный параметр был задан при 0 ºС. При увеличении объема газа его абсолютная температура во столько же раз увеличивается и наоборот. Этим можно воспользоваться для проверки результата.
Закон Гей-Люссака
газовый закон: для данной массы данного газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная
![]() ,где
=1/273К -1
- температурный коэффициент объемного
расширения.
,где
=1/273К -1
- температурный коэффициент объемного
расширения.
Закон Дальтона
один из основных газовых законов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
Закон Паскаля
основной закон гидростатики: давление, производимое внешними силами на поверхность жидкости или газа, передается одинаково по всем направлениям.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
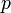 — давление,
— давление,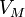 — молярный
объём,
— молярный
объём,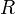 — универсальная
газовая постоянная
— универсальная
газовая постоянная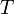 — абсолютная
температура,К.
— абсолютная
температура,К.
