
- •241000 - «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии» и 240100 «Химическая технология»
- •Задание
- •Часть I
- •Часть II
- •Обоснование работы.
- •Курсовая работа
- •Часть I Пример
- •Расчёт изменения энергии гиббса по методу
- •Расчёт химического равновесия для реакций, протекающих в неидеальных условиях. Основные понятия и определения
- •Расчёт критических параметров
- •Расчёт коэффициентов активности
- •Расчёт коэффициентов для изогексилена
- •Расчёт константы Кγ
- •Расчёт константы равновесия Кр
- •Приложение 2. Расчет энтальпий образования соединений по методу введения поправок
Расчёт химического равновесия для реакций, протекающих в неидеальных условиях. Основные понятия и определения
В реальных системах – газовых или жидких растворах – частицы (молекулы, атомы, ионы) взаимодействуют друг с другом, определяя положительные или отрицательные отклонения от идеальных свойств. Эти взаимодействия могут быть связаны с силами ван дер Ваальса, электростатическими силами, образованием водородных связей или комплексов с переносом заряда.
Эти силы, отражают отклонения в свойствах реальных систем от идеальных свойств газов, описываемых уравнениями Шарля – Гей-Люссака, Бойля – Мариотта, Менделеева – Клапейрона, Вант-Гоффа, Рауля и др.
Для расчета термодинамических параметров реальных систем (газообразных или жидких) развиваются два направления: теоретическое, основанное на создании уравнений состояния вещества и эмпирическое.
В качестве уравнений состояния вещества используют уравнения ван дер Ваальса, Дитеричи, Каммерлинг – Оннеса и др. Однако применение этих уравнений к термодинамическим расчётам усложняет термодинамические функции, а точность расчетов зависит от точности уравнения состояния вещества.
Второе направление расчета было развито в 1901 г. Г.Н.Льюисом, который предложил проводить расчеты термодинамических функций для газов и жидкостей, смесей газов и растворов с помощью эмпирических уравнений, которые были получены для описания свойств газов и жидкостей, находящихся в идеальном состоянии.
Вместо давлений
и концентраций им предложено применять
в расчетах термодинамических функций
реальных газов и жидкостей фиктивные
величины: фугитивность (летучесть)
![]() вместо давления и активность а
– вместо концентрации.
вместо давления и активность а
– вместо концентрации.
Эти параметры определяют по выражениям:
![]() , (71)
, (71)
а = γ с, (72)
где
![]() коэффициент фугитивности (летучести)
или активности реального вещества.
коэффициент фугитивности (летучести)
или активности реального вещества.
За нормировку летучести и активности принимают условия, когда давление газа в системе стремится к нулю (Р 0), а раствор является предельно разбавленным, т.е. с 0. При такой нормировке коэффициент = 1 и из выражений (71) и (72) следует равенство летучести давлению:
![]() , (73)
, (73)
а активность равна концентрации:
а = с. (74)
Если составы смесей
выражены через мольную долю
![]() ,
концентрации
,
концентрации
![]() и моляльность
и моляльность
![]() ,
то активности записывают в такой форме:
,
то активности записывают в такой форме:
![]() ;
;
ас = γс·с;
![]() ,
,
где
![]() ,
,
![]() и
и
![]() – рациональный, мольный или моляльный
коэффициенты активности. В разбавленных
растворах эти коэффициенты равны друг
другу. Ниже приведены методы расчета
летучестей.
– рациональный, мольный или моляльный
коэффициенты активности. В разбавленных
растворах эти коэффициенты равны друг
другу. Ниже приведены методы расчета
летучестей.
Вначале определяется исходное уравнение для разработки методов расчета летучести.
Зависимость летучести от давления
Методы расчета
летучести основываются на зависимости
её от давления в явном виде. Такое
выражение можно получить, используя
вначале зависимость энергии Гиббса от
давления в форме производной
![]() .
.
В этой производной
для газа в идеальном состоянии заменяем
объем V
по формуле Менделеева – Клапейрона
![]() и получаем уравнение
и получаем уравнение
![]() или
или
![]() , (75)
, (75)
Для реального газа заменяем давление на летучесть:
![]() . (76)
. (76)
Продифференцируем это выражение по давлению:
![]() . (77)
. (77)
Заменим правую часть выражения через объем и получим исходную формулу для разработки методов расчета летучести:
![]() . (78)
. (78)
Разделяя переменные в этом уравнении, получаем
RT dlnf = V dP. (79)
Интегрирование этого уравнения в общем виде невозможно, так как в правой части содержатся две независимые переменные, которые необходимо связывать между собою с помощью уравнения состояния вещества. Общее уравнение состояния вещества пока не получено, а частные уравнения будут использованы ниже.
На основе уравнения (79) было разработано пять методов расчета летучести f и коэффициентов γ летучести или активности для газов, проявляющих неидеальные свойства*.
Равновесие для химической реакции наиболее удобно изучать используя для расчёта коэффициентов активности γ приведенные параметры и коэффициент сжимаемости.
Закон действующих масс для неидеальных газовых систем определеяется как отношение произведения летучестей продуктов реакции, возведенные в стехиометрические коэффициенты к произведению летучестей продуктов реакции, возведенные в стехиометрические коэффициенты и это отношение есть величина постоянная и равна константе равновесия Кf. Аналитически з.д.м. представится в таком виде:
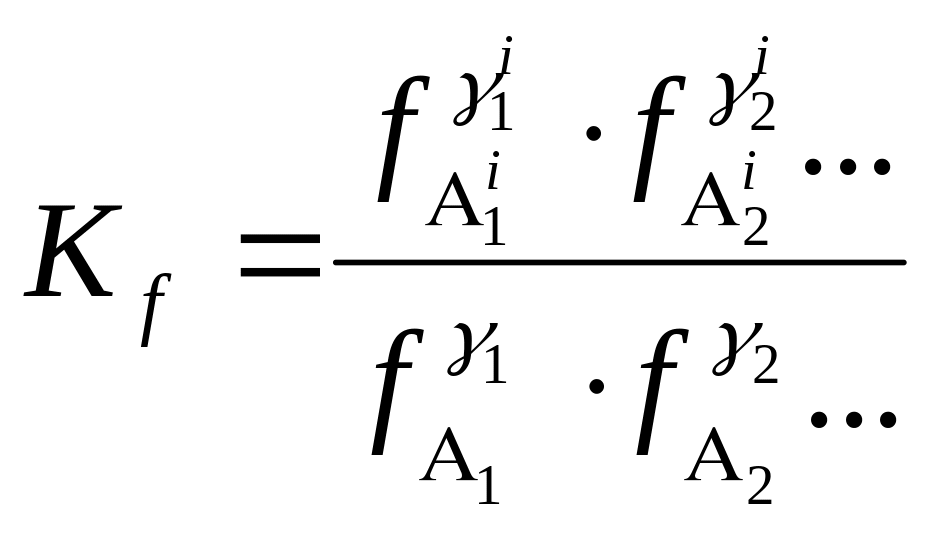 . (80)
. (80)
Летучести в этом уравнении можно определить по выражению:
f =
![]() P . (81)
P . (81)
Подставив (81) в (80), получим выражение для з.д.м., включающего коэффициенты активности каждого соединения и их парциальные давления:
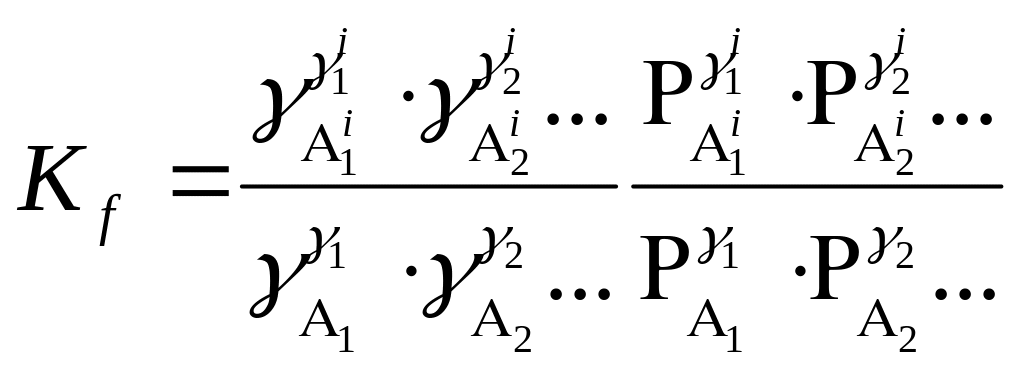 . (82)
. (82)
В это уравнение з.д.м. вводится две константы Кр и Кγ:
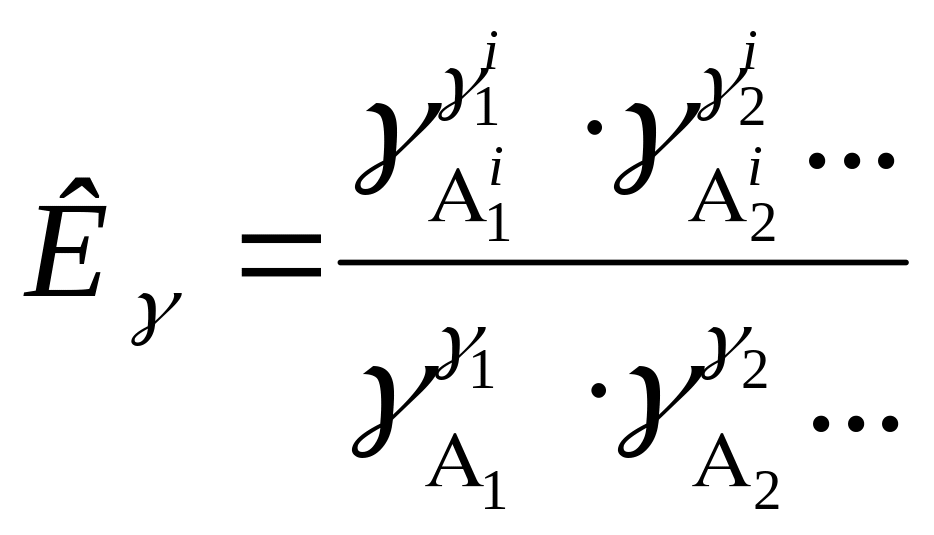 , (83)
, (83)
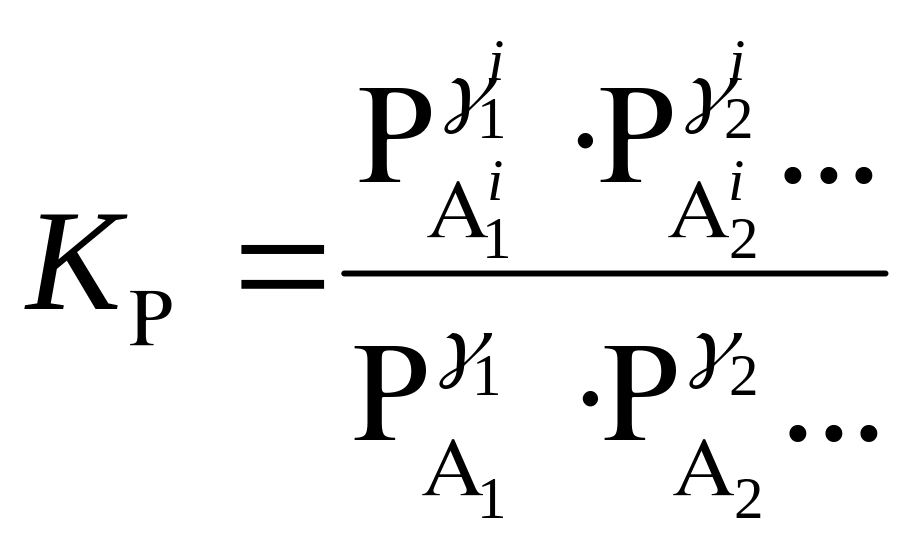 . (84)
. (84)
Подставляем (83) и (84) в (82) и получаем исправленную величину константы равновесия Кp:
Кp
=
![]() . (85)
. (85)
В этом уравнение представлено исправленное значение константы равновесия Кр, учитывающей отклонение свойств реальной реакционной смеси от идеальных свойств этой смеси. Расчет исправленной константы равновесия осуществляется в такой последовательности.
Вначале рассчитывают численное значение константы равновесия Кf по стандартной изотерме химической реакции:
∆rGT0 = −RT lnKf . (86)
Численное значение этой константы не зависит от давления и представлены уже ранее в таблице 8.
Следующей стадией рассчитывают численные величины коэффициентов активности. Наиболее удобным для такого расчёта является метод приведенных параметров. В качестве приведенных параметров используют приведенное давление π и приведенную температуру τ.
Приведенное давление определяется по отношению данного давления Р в системе к критическому давлению Pкр: π = Р/Ркр.
Приведенная температура определяется по отношению данной температуры Т к критической температуре Ткр : τ= Т/Ткр.. Водород, Не и неон по своим свойствам показывают систематические отклонения от свойств газов в идеальном состоянии и при расчётах для них приведенные параметры используют в таком виде:
π = Т/Ткр+8. и π Р/Ркр +8 . (87)
Численное значение критических параметров выбирают из Приложния 1 или рассчитывают по эмпирическим формулам Лидерсена.
При отсутствии опытных данных для критических параметров веществ используется полуэмпирический метод их расчета, предложенный Лидерсеном. Были получены следующие приближенные выражения:
Тнтк/Ткр = 0,567 + SDТ - (SDТ)2 , (88)
Ркр = М/(SDР + 0,34)2 , (89)
Vкр = 40 + SDV , (90)
где Тнтк- температура кипения при нормальных условиях и может быть рассчитана по формуле Воинова, SDТ, SDР и SDV - поправки, вычисляемые по данным, приведенным в таблице 12.
Таблица 12 - Составляющие DТ, DР и DV для расчета критических параметров по уравнениям (88), (89) и (90)
Атомы, группы, связи |
DТ |
DР, атм |
DV, см3×моль-1 |
|
B |
(0,03) |
|
|
|
Br |
0.010 |
(0,50) |
(70) |
|
|
|
0,00 |
0,210 |
41 |
|
в кольце |
(-0,007) |
(0,154) |
(31) |
|
0,0 |
0,198 |
36 |
|
в кольце |
0,011 |
0,154 |
36 |
|
|
0,0 |
0,198 |
36 |
|
в кольце |
0,011 |
0,154 |
36 |
|
|
0,005 |
0,153 |
(38) |
|
|
0,020 |
0,227 |
55 |
|
в кольце |
0,013 |
0,184 |
44,5 |
|
|
0,018 |
0,198 |
45 |
|
|
0,020 |
0,227 |
55 |
|
|
(0,060) |
(0,36) |
(80) |
|
|
0,040 |
0,29 |
60 |
|
в кольце |
(0,033) |
(0,2) |
(50) |
|
|
0,048 |
(0,33) |
73 |
|
|
0,085 |
(0,4) |
80 |
|
|
0,047 |
0,47 |
80 |
|
Cl |
0,017 |
0,320 |
49 |
|
F |
0,018 |
0,224 |
18 |
|
I |
0,012 |
(0,83) |
(95) |
|
|
0,014 |
0,17 |
(42) |
|
в кольце |
(0,007) |
(0,13) |
(32) |
|
|
0,031 |
0,135 |
(37) |
|
в кольце |
(0,024) |
(0,09) |
(27) |
|
|
0,031 |
0,095 |
28 |
|
NO2 |
(0,055) |
(0,42) |
(78) |
|
|
0,021 |
0,16 |
20 |
|
в кольце |
(0,014) |
(0,12) |
(8) |
|
|
0,082 |
0,06 |
(18) |
|
фенолы |
0,031 |
(-0,02) |
(3) |
|
|
(0,02) |
(0,21) |
(11) |
|
|
0,015 |
0,27 |
55 |
|
в кольце |
(0,008) |
(0,24) |
(47) |
|
|
(0,003) |
(0,24) |
(47) |
|
|
0,015 |
0,27 |
55 |
|
|
0,03 |
0,54 |
|
|
* Атомы и группы соединены указанными связями с неоднородными связями. Значения, заключенные в скобки, найдены по ограниченному числу опытных данных. Циклическая составляющая, общая для двух насыщенных колец, имеет значение DТ = 0,064.
