
- •Федеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения
- •Федеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения
- •Приготовление растворов кислот заданной концентрации и определение концентрации полученных растворов методом титрования
- •Скорость химической реакции и химическое равновесие
- •1. Глинка н.Л. Общая химия. - м.: Интеграл-Пресс, 2003. – с.663-668. 2. Ахметов н.С. Общая и неорганическая химия. – м.: Высшая школа,
- •Окислительно-восстановительные свойства азотной (hno3) и азотистой (hno2) кислот, их солей
- •Определение химических характеристик кислотных и щелочных аккумуляторов
- •Тепловые эффекты реакции гидратации вяжущих веществ
Федеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения
Кафедра Технологии конструкционных материалов и химии
А.Г. Мохов
Химия
Федеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения
Кафедра Технологии конструкционных материалов и химии
А.Г. Мохов
Химия
С Б О Р Н И К
лабораторных работ с методическими указаниями
для студентов дневной и заочной форм обучения всех специальностей
Издание второе, дополненное и исправленное
Екатеринбург 2006
УДК 54:371.388 М 80
Сборник лабораторных работ с методическими указаниями по курсу «Хи-мия» составлен в соответствии с учебными, календарными планами занятий для студентов дневной и заочной форм обучения всех специальностей.
В сборнике рассмотрена теория химических процессов, приведен порядок выполнения лабораторных работ, даны описание лабораторных установок и схе-ма составления отчета. Сборник существенно переработан и дополнен. Понятия, определения приведены в соответствии с последними изданиями базовых учеб-ников.
Сборник разработан коллективом преподавателей под редакцией доц. А.Г. Мохова.
Авторы: А.Г. Мохов, доцент кафедры «ТКМ и химия»
Е.В. Михалева, ст. преподаватель кафедры «ТКМ и химия» (работы 6а, 6б),
А.В. Саблина, ассистент кафедры «ТКМ и химия» (работы 7, 7а).
Рецензент: В. Н. Соколов, доцент кафедры «ТКМ и химия»
А.В. Саблина, ассистент: компьютерный набор.
Ó
Уральский
государственный
университет
путей
сообщения
(УрГУПС),
2006
ОГЛАВЛЕНИЕ
1. ЛАБОРАТОРНАЯ РАБОТА № 1 «Классы химических соединений». 4 2. ЛАБОРАТОРНАЯ РАБОТА № 2 «Определение эквивалента металла
по водороду» …………………………………..………………………… 12 3. ЛАБОРАТОРНАЯ РАБОТА № 3 «Приготовление растворов кислот
заданной концентрации и определение концентрации полученных растворов методом титрования» ……………………………………….. 18
4. ЛАБОРАТОРНАЯ РАБОТА № 4 «Скорость химических реакций и химическое равновесие» …. .………………… ……………………… 24
5. ЛАБОРАТОРНАЯ РАБОТА №5 «Электролиты»……...……………… 33 6. ЛАБОРАТОРНАЯ РАБОТА № 6 «Определение рН. Гидролиз со-
лей»…………………………………………………………………….. 37 7. ЛАБОРАТОРНАЯ РАБОТА № 6а «Буферные растворы»……………. 43 8. ЛАБОРАТОРНАЯ РАБОТА № 6б «Комплексные соединения»…….. 47 9. ЛАБОРАТОРНАЯ РАБОТА № 7 «Соединения хрома»………………. 51
10. ЛАБОРАТОРНАЯ РАБОТА № 7а «Окислительные свойства пер-манганата калия КМnО4»……………………………………………….. 54
11. ЛАБОРАТОРНАЯ РАБОТА № 8 «Галогены»………………………… 56 12. ЛАБОРАТОРНАЯ РАБОТА № 8а «Сера»……………………………. 58 13. ЛАБОРАТОРНАЯ РАБОТА № 9 «Окислительно-восстановитель-
ные свойства азотной (HNO3) и азотистой (HNO2) кислот, их солей». 60 14. ЛАБОРАТОРНАЯ РАБОТА № 10 «Отношение металлов к кисло-
там и щелочам» …...…………………………………………………….. 63 15. ЛАБОРАТОРНАЯ РАБОТА № 21 «Электрохимические свойства ме-
таллов»……… …………………………………………………………… 67 16. ЛАБОРАТОРНАЯ РАБОТА № 27 «Определение химических харак-
теристик кислотных и щелочных аккумуляторов»……………... 77 17. ЛАБОРАТОРНАЯ РАБОТА № 33В «Изготовление текстолита и ге-
тинакса методом прессования»………………………………………. 87 18. ЛАБОРАТОРНАЯ РАБОТА № 34В «Деструкция пластмасс»………. 98 19. ЛАБОРАТОРНАЯ РАБОТА № 45 «Дисперсные системы и их свой-
ства»…………………………………………………………………. 103 20. ЛАБОРАТОРНАЯ РАБОТА № 46 «Тепловые эффекты реакции гид-
ратации вяжущих веществ»………………………………………… 109
3
ЛАБОРАТОРНАЯ РАБОТА № 1
КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: изучить классификацию неорганических веществ, со-став и отличительные признаки формул соединений, их свойства.
Рабочее задание: на конкретных химических реакциях рассмотреть взаимодействие неорганических веществ различных классов, написать хими-ческие уравнения реакций, обратив внимание на основные, кислые, средние соли. Составить и оформить отчет.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Неорганические вещества делятся на четыре класса: оксиды, основа-ния, кислоты и соли.
1. Оксиды
Оксидами называются соединения, состоящие из кислорода и другого элемента. По своим свойствам оксиды делятся на: кислотные, основные, ам-фотерные, безразличные оксиды и пероксиды.
Кислотными оксидами называются сложные вещества, гидраты кото-рых являются кислотами. Кислотные оксиды взаимодействуют со щелочами, основаниями и основными оксидами с образованием солей.
Например,
CO2 + CaO = CaCО3,
SO2 + 2NaOH = Na2SO3 + H2O.
Большинство кислотных оксидов взаимодействуют с водой, а в резуль-тате их взаимодействия получается кислота.
Например,
SO3 + H2O = H2SO4.
Кислотными оксидами являются оксиды неметаллов и некоторые ок-сиды металлов высшей валентности.
Например, P2O5; CrO3; MnO3; Mn2O7 и т.п.
Основными оксидами называются такие, гидраты которых являются основаниями. Большинство основных оксидов с водой не взаимодействуют и
4

соответствующие им гидраты получаются косвенным путем - действием ще-лочи на раствор соли данного металла.
Например,
MnSO4 + 2NaOH = Mn(OH)2 + Na2SO4.
Все основные оксиды взаимодействуют с кислотами и кислотными ок-сидами с образованием солей.
Например,
MgO + H2SO4 = H2O + MgSO4, FeO + SO3 = FeSO4.
Основными оксидами являются только оксиды металлов, обычно с ва-лентностью 1, 2 и 3: K2O, CaO, FeO, Fe2O3, NiO, Ni2O3, CuO, CdO, MnO, Mn2O3 и т.д.
Амфотерными оксидами называются такие, которые обладают двойст-венными свойствами: и кислотных, и основных оксидов, т.е. они взаимодей-ствуют и с кислотами, и со щелочами с образованием солей. При взаимодей-ствии со щелочами металл амфотерного оксида входит в состав кислотного остатка образовавшейся соли. При взаимодействии с кислотой элемент ок-сида переходит в соль в виде катиона металла.
Например,
ZnO + 2KOH = K2ZnO2 + H2O, ZnO + H2SO4 = ZnSO4 + H2O.
Амфотерными оксидами являются некоторые оксиды металлов. Например, ZnO; BeO; Al2O3 и металлов d-элементов с промежуточ-
ной степенью окисления: Cr2O3, MnO2 и т.д.
Все три типа оксидов являются солеобразующими оксидами. Безразличными оксидами называются такие, которые не взаимодейст-
вуют ни со щелочами, ни с кислотами и не образуют солей. Примером таких оксидов являются NO и N2O, СО.
Пероксиды – соли пероксида водорода (Н2О2). В молекуле перокси-да атомы кислорода связаны между собой, образуя пероксидную группу “-О-О-“.
Например, Na2O2, BaO2, CaO2 и т.д. Графически пероксид натрия может быть изображен следующим образом: Na – O – O – Na.
Все перекиси являются сильными окислителями.
2. Кислоты
Кислоты – это электролиты, диссоциирующие в растворе на катионы водорода и анионы кислотного остатка.
5


Например,
HCl = H+ + Cl–, H2SO4 = 2H+ + SO42- .
Общие свойства кислот - кислый вкус и способность окрашивать лак-
мус, метил-оранж в красный цвет - вызваны наличием в их растворах ионов водорода, Н+.
Большинство кислот растворяют активные металлы с выделением во-дорода.
Например,
Zn + 2HCl = ZnCl2 + H2,
Fe + H2SO4 (разб) = FeSO4 + H2.
Однако некоторые кислоты растворяют активные и неактивные метал-лы без выделения водорода, но с выделением оксида кислотообразующего элемента.
Так ведут себя концентрированная серная кислота и азотная кислота любой концентрации.
Например,
Cu + 2 H2SO4 (конц) = CuSO4 + SO2 + 2 H2O,
8Fe + 30HNO3(разб) = 8Fe(NO3)3 + 3N2O + 15H2O.
Кислоты взаимодействуют с основными оксидами, основаниями и со щелочами с образованием солей и воды.
Например,
H2SO4 + MgO = MgSO4 + H2O, 2HCl + Ca(OH)2 = CaCl2 + 2H2O.
Кислоты могут быть получены взаимодействием кислотного оксида с водой или действием на соль данной кислоты более сильной или менее лету-чей кислотой.
Например,
SO3 + H2O = H2SO4,
2NaCl + H2SO4 = Na2SO4 + 2HCl.
Кроме указанных общих способов существуют еще специфические способы получения некоторых кислот.
3. Основания
Основания – это электролиты, диссоциирующие с образованием гидро-ксид-ионов (ОН−).
Большинство оснований практически нерастворимы в воде. Хорошо растворимые в воде основания называются щелочами. К ним относятся толь-ко гидроксиды щелочных и щелочноземельных металлов.
6
Основания и щелочи взаимодействуют с кислотами и кислотными ок-сидами с образованием солей и воды.
Например,
Ca(OH)2 + CO2= CaCO3¯ + H2O, Ba(OH)2 + H2SO4= BaSO4¯ +2H2O.
Обычно основания получаются косвенным путем - действием щелочи на раствор соли данного металла, например,
CuCl2 + 2KOH = Cu(OH)2¯ + 2KCl.
Щелочи могут быть получены непосредственно взаимодействием ок-сида металла с водой.
Например,
Na2O + H2O = 2NaOH, BaO + H2O = Ba(OH)2.
Гидроксиды тяжелых металлов непрочны и довольно легко выделяют воду, особенно при нагревании.
Например,
0
Cu(OH)2 CuO + H2O.
3.1. Амфотерные основания
Амфотерными основаниями являются такие, которые ведут себя и как основание, и как кислота, т.е. они взаимодействуют и с кислотами и с осно-ванием с образованием соли и воды.
Например,
Cr(OH)3 + 3HCl = CrCl3 + 3H2O, Cr(OH)3 + KOH = KСrO2 + 2H2O.
4. Соли
Солями называются сложные вещества, состоящие из катионов метал-лов и кислотных остатков.
4.1. Средние соли
Средние соли – продукты полного замещения атомов водорода в моле-кулах кислот атомами металлов, или гидроксильных групп в молекулах ос-нований кислотными остатками. Их молекулы не содержат ни катионов во-дорода, ни гидроксогрупп.
Например, Na3PO4, Na2SO4, KNO3 и т.д.
7
t
=
4.2. Кислые соли
Кислые соли (гидросоли) образуются при неполном замещении атомов водорода в молекуле слабой кислоты. Их молекулы содержат катионы водо-рода, соединенные с кислотными остатками.
Например, KHSO4, NaHCO3, K2HPO4 и т.д.
Кислые соли образуются многоосновными слабыми кислотами.
4.3. Основные соли
Основные соли (гидроксосоли) образуются при частичном замещении гидроксильных групп в молекуле основного гидроксида кислотными остат-ками. Их молекулы содержат гидроксогруппы, соединенные с катионами ме-таллов.
Например, FeOHSO4, ZnOHCl, (CuOH)2SO4 и т.д.
Основные соли могут быть образованы только многокислотными сла-быми гидроксидами.
4.4. Двойные соли
Двойные соли состоят из ионов двух разных металлов и кислотного ос-татка.
Например, KCr(SO4)2, KAl(SO4)2 и т.д.
Названия солей составляют из названия аниона в именительном падеже и катиона в родительном.
NaNO3 - нитрат натрия, Al2(SO4)3 - сульфат алюминия.
Если металл проявляет разную степень окисления, то ее указывают в скобках римской цифрой.
NiSO4 - сульфат никеля (II), Ni2(SO4)3 - сульфат никеля (III), K2SO3 - сульфит калия.
В случае бескислородных кислот анион имеет окончание “-ид”. Например,
KCl - хлорид калия, Сu2S - сульфид меди (I), KCN - цианид калия.
Название кислых солей образуют так же, как и средних, но при этом добавляют приставку “гидро-”, а если необходимо, то соответствующими числительными, указывающими число незамещенных атомов водорода. На-пример,
Mg(HCO3)2 - гидрокарбонат магния, KH2PO4 - дигидрофосфат калия, Na4SiO4 - ортосиликат натрия, Cu(HSO3)2 - гидросульфит меди (II), CuHS - гидросульфид меди (I).
8
Название основных солей образуют подобно названиям средних солей, но при этом добавляют приставку “гидроксо-”, указывающую на наличие не-замещенных гидроксогрупп.
MgOHCl - хлорид гидроксомагния, (CuOH)2SO4 - сульфат гидроксомеди (II), [Al(OH)2] 2SO4 - сульфат дигидроксоалюминия.
В двойных солях названия металлов пишутся через дефис, причем оба в родительном падеже. В скобках арабскими цифрами указываются атомные числовые соотношения металлов.
KCr(SO4)2 - сульфат калия-хрома, K2NaPO4 - ортофосфат калия-натрия (2:1).
ПРАКТИЧЕСКАЯ ЧАСТЬ
1. Свойства кислотных оксидов
1.1. Взаимодействие кислотного оксида с водой
Нагрейте на железной ложечке серу до воспламенения и опустите в банку, прикрыв стеклянной пластинкой. После сгорания добавьте в банку во-ды, взболтайте и проверьте реакцию раствора на метилоранж. Напишите уравнения происходящих реакций.
1.2. Взаимодействие кислотного оксида с основанием и со средней со-лью
Налейте в пробирку известковую воду (раствор Са(ОН)2) и пропускай-те СО2 из аппарата Киппа. Наблюдайте образование белого осадка и его рас-творение в избытке СО2. Напишите уравнения происходящих реакций.
2. Свойства основных оксидов
2.1. Взаимодействие основного оксида с водой
Насыпьте в пробирку немного негашеной извести (СаО), очень осто-рожно смочите водой. Напишите уравнение прошедшей реакции. Затем взболтайте часть порошка в пробирке с водой и раствор испытайте метило-ранжем или фенолфталеином.
3. Свойства гидроксидов
3.1. Взаимодействие амфотерного гидроксида с кислотой и щелочью
9
Налейте в пробирку раствор ZnSO4, добавьте немного разбавленной щелочи, взболтайте и разлейте осадок в две пробирки, добавьте в одну про-бирку разбавленную H2SO4, в другую – щелочь до растворения осадка.
Напишите уравнение реакции.
3.2. Разрушение гидроксидов тяжелого металла при нагревании Налейте в пробирку немного раствора хлорида меди, добавьте разбав-
ленной щелочи для образования светло-голубого осадка, нагрейте. Напишите уравнение реакции.
4. Свойства солей
4.1. Взаимодействие соли с другой солью с образованием нераствори-мого соединения
К раствору BaCl2 в пробирке прилейте раствор сернокислого натрия Na2SO4, наблюдайте образование белого осадка и напишите уравнение реак-ции.
4.2. Взаимодействие соли с кислотой
К раствору азотнокислого бария Ba(NO3)2 прибавьте H2SO4, наблюдай-те образование осадка, напишите уравнение реакции.
4.3. Взаимодействие соли со щелочью
4.3.1. В две пробирки, содержащие растворы хлорида магния MgCl2 и хлорида железа (III) FeCl3 прилейте раствор едкого натра NaOH.
Наблюдайте образование осадков, отметьте их цвет и напишите урав-нения реакций.
4.3.2. В две пробирки налейте раствор сернокислой меди CuSO4. В од-ну пробирку добавьте разбавленной, а в другую концентрированной щелочи. Наблюдайте образование основной соли меди в первой пробирке и гидро-ксида меди во второй. Обратите внимание на цвет осадков.
Напишите уравнения реакций; графические формулы основных, сред-них, кислых солей.
4.4. Взаимодействие соли с металлом
В пробирку с раствором медного купороса положите 2-3 кусочка гра-нулированного цинка и нагрейте до обесцвечивания раствора. Наблюдайте выделение металлической меди. Напишите уравнение реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие классы неорганических веществ существуют?
10
2. Какие вещества относятся к оксидам и каковы их химические свой-ства?
3. Какие вещества называются основаниями и каковы их химические свойства?
4. Какие соединения называются кислотами, каковы их отличительные химические свойства?
5. Какие вещества называются солями и каковы их свойства?
6. Чем отличаются по составу основные, кислые, средние соли?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Хомченко Г.П. Пособие по химии для поступающих в вузы. - М.: Новая волна, ОНИКС, 2000. – С. 150-158.
2. Глинка Н.Л. Задачи и упражнения по общей химии. - Л.: Химия, 1980 (81). - С. 34-41.
3. Глинка Н.Л. Общая химия. – М.: Интеграл – Пресс, 2003. – 728 с.
11
ЛАБОРАТОРНАЯ РАБОТА № 2
ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТА МЕТАЛЛА ПО ВОДОРОДУ
Цель работы: изучить тему «Эквивалентная масса вещества, закон эк-вивалентов».
Рабочее задание: опытным путем определить эквивалентную массу предлагаемого металла по объему выделившегося водорода.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Эквивалентом элемента называют массу вещества, которая соединяется с 1 молем атомов водорода в химических реакциях или замещает его в хими-ческих реакциях.
Молярная масса эквивалента (Э) равна молярной массе данного эле-мента (М), деленной на абсолютное значение степени окисления [СО]
Э = [CO] .
Закон эквивалентов: «Вещества соединяются друг с другом и замеща-ют друг друга в весовых количествах, пропорциональных их эквивалентам», то есть
m Э
m2 Э2
где m1 – масса первого вещества, г или кг; m2 – масса второго вещества, г или кг;
Э1 – эквивалентная масса первого вещества, г/моль или кг/моль; Э2 – эквивалентная масса второго вещества, г/моль или кг/моль.
Из закона эквивалентов следует, что один эквивалент одного вещества соединяется с одним эквивалентом другого вещества, в общем случае «n» эк-вивалентов одного вещества соединяется с «n» эквивалентами другого веще-ства.
В тех случаях, когда в реакции участвуют газы, то необязательно выра-жать их эквиваленты при помощи весовых единиц. Так как объем газа при постоянных температуре и давлении прямо пропорционален его массе, то за-кон эквивалентов может быть выражен при помощи объема газа, а именно:
M
1
1
=
,
1
V
Э
1


V
VЭ
= V2 ,
2
12
где V1 – объем первого газа; V2 – объем второго газа;
Vэ1 – объем эквивалентной массы первого газа; Vэ2 - объем эквивалентной массы второго газа..
Большая часть простых веществ взаимодействует либо с водородом, либо с кислородом, или с водородом и кислородом:
а) объем 1 моля водорода занимает объем – 22,4 л (н.у.). Молярная мас-са 1 моля водорода (М) равна 2 г/моль.
Молярная масса эквивалента водорода (Э) равна 1 г/моль и занимает объем в два раза меньше, т.е. 11,2 л.
Н.у. – нормальные условия: при нормальном атмосферном давлении 760 мм. рт. ст. (101,325 кПа,) и температуре 273 К (00С).
Это легко определяется из пропорции:
2 г/моль Н2 занимает объем 22,4 л 1 г/моль Н2 — Х
Х = 11,2 л;
б) объем 1 моля кислорода занимает объем - 22,4 л. Молярная - масса 1 моля кислорода равна 32 г/моль.
Молярная масса эквивалента кислорода равна 8 г/моль и занимает объ-ем в 4 раза меньше, т.е. 5,6 л.
32 г/моль О2 занимает объем 22,4 л 8 г/моль О2 — Х
Х = 5,6 л .
Когда одно из реагирующих веществ является газообразным, а второе твердым, то математически закон эквивалентов выражается следующей зави-симостью
m = V0 , VЭ
где m – вес вещества, г или кг,
Э – эквивалентная масса этого вещества, г/моль или кг/моль; Vо – объем газа при нормальных (стандартных) условиях, л; V0э – объем эквивалентной массы газа, л.
Пример решения
При растворении в кислоте 0,608 г металла было собрано над водой
623,7 мл насыщенного водяным паром водорода при давлении 766,6 мм и температуре 260С. Вычислите эквивалентную массу металла.
766,6 мм – давление водорода и водяного пара, т.е. 766,6 = Рн2 + Рн2о . Для расчета надо знать давление водорода.
Рн2 = 766,6 - Рн2о , находим по таблице 1 значение Рн2о :
при t = 26 С, Рн2о = 25 мм. Отсюда, Рн2 = 766,6 мм – 25 мм = 751,6 мм. Из уравнения газового состояния
13
0
Э
О

PV = P0V0
T
где V - объем водорода при условии опыта; P - давление водорода, мм рт. ст.;
T - температура в градусах Кельвина ( Т= 273 + t); P0 - давление при н.у., 760 мм рт. ст.;
T0 - абсолютная температура в градусах Кельвина.
0 V ×P×T 6237×7516×273 H2 P0 ×T 760 273+26)
,
0
T
,
,
=
= =568мл.
V
.
(
H
=
0,568


Из формулы
m V02
ЭMe VЭ
определяется молярная масса эквивалента
металла
ЭMe = 0,608×11,2 =12(г / моль).
ПРАКТИЧЕСКАЯ ЧАСТЬ
По объему вытесненного водорода можно определить эквивалентные массы активных металлов, способных вытеснять водород из разбавленных кислот: магния, алюминия, хрома, марганца и др. Прибор для определения эквивалента состоит из двух бюреток, А и Б (см. рис.), которые закрепляют в лапках штатива. Бюретки соединяют между собой резиновой трубкой В. К бюретке А присоединяют пробирку. Чтобы подготовить прибор к работе, нужно вынуть пробку из пробирки, бюретку поднять и закрепить в таком по-ложении, чтобы уровень воды в бюретке А оказался на нулевом делении.
Затем проверить герметичность прибора. Для этого нужно закрыть про-бирку пробкой, опустить бюретку Б вниз на 10-15 см и наблюдать за уровнем воды в бюретке А в течение 3-5 минут. Если прибор герметичен, то уровень воды в бюретке А вначале несколько понизившись, остается затем без изме-нения. Если прибор не герметичен, следует плотнее вставить пробки в бю-ретке и пробирке. Убедившись в герметичности прибора, вернуть бюретку Б снова в такое положение, чтобы вода в обеих бюретках была на одном и том же уровне. Закончив проверку прибора, в пробирку налить с помощью воронки 3 – 4 мл разбавленной соляной кислоты (1:3) так, чтобы не смочить раствором углубления в верхней части пробирки.
14
Таблица 1
Давление водяного пара h (в мм рт. ст.) при температуре t (0С)
t h t h 10 9,2 22 19,8 11 9,8 23 21,1 12 10,5 24 22,4 13 11,2 25 23,8 14 12,0 26 25,2 15 12,8 27 26,7 16 13,6 28 28,3 17 14,5 29 30,0 18 15,5 30 31,8 19 16,5 40 55,3 20 17,5 50 92,5 21 18,6 100 760,0
Рис. Прибор для определения эквивалента металла
15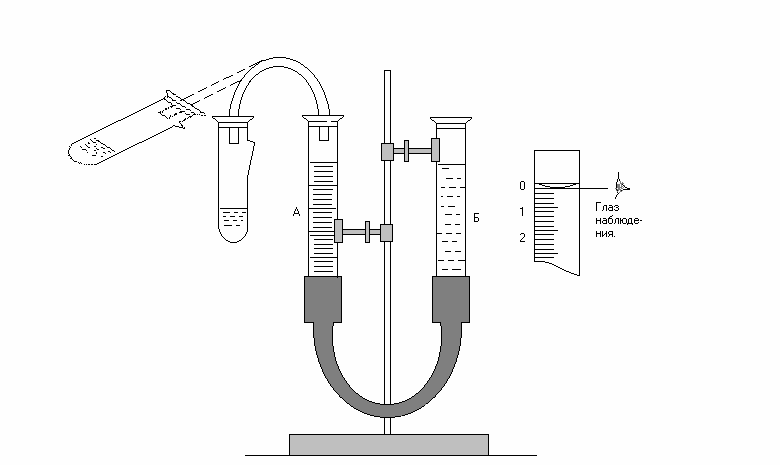
Если кислота все-таки попала в это углубление, ее необходимо выте-реть досуха фильтровальной бумагой.
Получите у преподавателя навеску металла и запишите ее массу в ла-бораторный журнал. Пробирку с кислотой наклоните и осторожно, следя за тем, чтобы кусочки металла не попали в кислоту, положите навеску металла в углубление стенки пробирки (см. пунктир на рис.). Закройте пробирку ре-зиновой пробкой, слегка смоченной водой и снова проверьте герметичность прибора, как указано выше. Закрепите бюретки А и Б так, чтобы положение воды в них было точно на одном уровне. При этом уровень воды в бюретках должен быть около нулевого деления. Отметьте уровень воды в бюретке А и запишите в таблицу с точностью до 0,05 мл (по нижнему мениску (см. рис.)); V1 должен находиться на одном уровне с нижним мениском воды.
Наклоните пробирку так, чтобы металл упал в кислоту. Выделяющийся при взаимодействии металла с кислотой водород вытесняет воду из бюретки А в бюретку Б. Наблюдайте за реакцией. Бюретку Б опускайте вниз так, что-бы уровень воды в обеих бюретках все время находился на одном уровне.
Когда весь металл растворится, и понижение уровня в бюретке А пре-кратится, дайте пробирке охладиться и принять комнатную температуру. За-тем приведите положение воды в обеих бюретках точно к одному уровню, отметьте уровень воды в бюретке А и запишите в таблицу – V2. Разность уровней V2 -V1 равняется объему выделившегося водорода.
Запишите показания термометра – t С, барометра – Р и давление водя-ных паров при температуре опыта (h).
Результаты опыта занесите в таблицу 2.
Таблица 2
0
H
=
V
.
H
Навеска Условия опыта металла,
г Темпе- Атмосфер- Давле-ратура, ное давле- ние во-
t0, С ние, мм дяно-го пара, мм
Положение уровня в бюретке, мл
До опыта После опыта V1 V2
Объем во-дорода,
л
Вычисления
1. Объем выделившегося водорода Vн2 = V2 - V1. 2. Абсолютная температура Т = 273 + t.
3. Давление водорода Рн2 = Р атм. – h водяного пара.
4. Для приведения объема газа к нормальным условиям пользуются уравнением газового состояния
0 VH2 × P 2 ×T 2 P0 ×T
16
5. Эквивалентная масса металла определяется из формулы закона эк-вивалентов
0
=
Э
0
Э
Э
m×VЭH2
VH2
,
где V0 - объем эквивалентной массы водорода, л..
H2
6. Узнайте у преподавателя, какой металл был взят для опыта, и под-считайте процент ошибок
П = (Ээксп. − Этеор. )×100%. теор.
В теоретической части ответьте на контрольные вопросы, произведите расчеты, оформите и сдайте отчет преподавателю.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называется эквивалентом и эквивалентной массой вещества? 2. В чем сущность закона эквивалентов?
3. Чему равен объем эквивалентной массы водорода и кислорода? Под-твердите расчетами.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Глинка Н.Л. Общая химия. - М.: Интеграл-Пресс,2003. - С. 25-26.
2. Коровин Н.В. Курс общей химии. – М.: Высшая школа, 2001.- С. 14-15.
3. Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Высшая школа, 1980. - С. 9 -11.
17
ЛАБОРАТОРНАЯ РАБОТА № 3
