
- •Федеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения
- •Федеральное агентство железнодорожного транспорта Уральский государственный университет путей сообщения
- •Приготовление растворов кислот заданной концентрации и определение концентрации полученных растворов методом титрования
- •Скорость химической реакции и химическое равновесие
- •1. Глинка н.Л. Общая химия. - м.: Интеграл-Пресс, 2003. – с.663-668. 2. Ахметов н.С. Общая и неорганическая химия. – м.: Высшая школа,
- •Окислительно-восстановительные свойства азотной (hno3) и азотистой (hno2) кислот, их солей
- •Определение химических характеристик кислотных и щелочных аккумуляторов
- •Тепловые эффекты реакции гидратации вяжущих веществ
Определение химических характеристик кислотных и щелочных аккумуляторов
Цель работы: изучить особенности процессов разряда и заряда ос-новных промышленных аккумуляторов, научиться снимать электрохимиче-ские характеристики и давать оценку их работоспособности.
Рабочее задание: измерить ЭДС, равновесные и стационарные потен-циалы электродов, получить вольтамперную характеристику и диаграммы поляризации при разряде и заряде аккумулятора, определить область рабочих разрядных токов, емкость и внутреннее сопротивление.
СВЕДЕНИЯ ИЗ ТЕОРИИ
1. Классификация аккумуляторов
Аккумуляторы – это вторичные химические источники тока, (ХИТ) ко-торые допускают многократное использование. Будучи разряженными, они способны восстанавливаться (заряжаться) от внешнего источника постоянно-го тока. Активные массы электродов регенерируются. Классифицируются аккумуляторы по типу электролита: кислотные, щелочные, с твердым и рас-плавленным электролитом. Наиболее широкое применение на практике по-лучили кислотные (свинцовые) и щелочные (никель–кадмивый, никель– железный и серебряно–цинковый) аккумуляторы.
1.1. Кислотные (свинцовые) аккумуляторы
В основе работы свинцового заряженного аккумулятора находится электрохимическая схема
(-) Рв| H2SO4|РвО2 (+).
Конструктивно оба электрода представляют собой свинцовые решетки. Отрицательная заполнена губчатым свинцом, положительная двуокисью свинца. Полярность электродов при разряде и заряде не меняется.
Электролитом служит 28 – 40% - ный раствор серной кислоты (плот-ность d = 1,21 – 1,30 г/см3). Наибольшая электропроводность у 30 % H2SO4 (d = 1,22 г/см ). В зимний период концентрация кислоты выше, чем летом.
В основе механизма токообразующего процесса лежит процесс двой-ной сульфатации, согласно которому, при разряде активные вещества обоих
77
3
электродов переходят в кристаллический сульфат свинца, при заряде идет
обратный процесс
(-) Pb m 2e + SO42– ра ⎯⎯ 4 E0Pb= – 0,36B заряд
(+) PbO2 + 2e + SO42– + 4H+ ⎯⎯⎯⎯® PbSO4 + 2H2O PbPbO2 = 1,68B. заряд
Е0Pb и Е0PbO2 – стандартные электродные потенциалы отрицательного и положительного электрода (при активности всех компонентов, равной еди-нице и температуре 25 0С.)
Суммарное уравнение токообразующего процесса
Pb + PbO2 + 2H2SO4 разряд® 2PbSO4 + 2H2O E0ЭДС = 2,04B. заряд
В реальных условиях ЭДС свежезаряженного аккумулятора может достигать 2,6В (из-за электрохимического разложения при перезарядке). Че-рез некоторое время это значение снижается до 2,1В. При разряде не реко-мендуется снижать напряжение меньше 1,85В во избежание порчи аккуму-лятора.
Как следует из суммарного уравнения, при заряде концентрация ки-слоты увеличивается, а при разряде уменьшается (в конце примерно в два раза до d = 1,08 - 1,17 г/см 3). Поэтому концентрация (плотность) электролита может служить критерием заряженности аккумулятора. Заряд ведут до по-стоянной плотности электролита. Кроме того, часто для получения полного заряда аккумулятору после скачка напряжения до 2,4 – 2,5В (при этом на-блюдается «кипение» электролита, т.е. выделение на отрицательном электро-де Н2 и на положительном О2) сообщают еще примерно 10% емкости. Сила зарядного тока в амперах обычно составляет 0,1 долю от емкости.
Основной недостаток свинцового аккумулятора - сравнительно не-большой срок службы, главным образом, из-за постепенной сульфатации электродов. Сульфатация – это переход сульфата свинца из мелкокристалли-ческого, растворимого состояния в крупнокристаллический, нерастворимый, неэлектропроводный слой (нет полного превращения PbSO4 в Pb и PbO2 при заряде). Внешним проявлением необратимой сульфатации является наличие жесткой, песчанистой поверхности на электродах (на отрицательном элек-троде отсутствует характерный металлический оттенок Рb, на положитель-ном происходит осветление окраски PbO2). Зарядить такие электроды прак-тически невозможно.
Во избежание сульфатации необходимо хранить свинцовый аккумуля-тор с электролитом только в заряженном состоянии и регулярно подзаряжать его. Кроме того, свинцовые аккумуляторы не выдерживают сильных вибра-
78
р
д
я
з
⎯
⎯
®PbSO
¬⎯ ⎯ ⎯
р
я
д
р
а
з
0
⎯
¬⎯
⎯
⎯
⎯
⎯
⎯
¬⎯ ⎯ ⎯

ций, боятся больших перезарядов, длительных коротких замыканий. Идет осыпание активных масс, особенно положительного электрода.
Основное преимущество свинцового аккумулятора перед другими ис-точниками тока – способность вырабатывать большие разрядные токи (более 200А). Поэтому они незаменимы как стартерные батареи для запуска двига-телей внутреннего сгорания.
В зависимости от назначения батареи специально маркируются. На-пример, 6-СТ-60 (стартерная, 6 банок по 2В на 12В и на 60 А·ч). Стартерные батареи используются в тепловозах, автомобилях. Кроме того, на железнодо-рожном транспорте применяют аккумуляторы типа АБН для автоблокиров-ки; ТН - тяговые; в ПМЦ – для освещения вагонов.
1.2. Щелочные аккумуляторы
Наибольшее распространение получили никель–кадмиевые (НК) и ни-кель–железные (НЖ) аккумуляторы. Их электрохимические схемы были предложены в 1900-1901 г.:
(–) Сd| KOH или NaOH|NiOOH (+),
(–) Fe| KOH или NaOH|NiOOH (+).
Активное вещество положительного электрода состоит из смеси гра-фита и гидратированного оксида Ni (III). Активной массой отрицательного электрода служит порошкообразные кадмий или железо. В аккумуляторах большой емкости активные массы заключены в стальные ламели: перфори-рованные пакеты, которые служат токоотводом. Электролит − 23% КОН (d=1,21 г/см3) или NaOH (КОН обладает лучшей электропроводностью при низких температурах).
Электродные реакции при разряде и заряде:
(–) Cd m 2e + 2OH– разряд® Cd(OH)2 E0Cd = – 0,81B заряд
(–) Fe m2e + 2OH– разряд® Fe(OH)2 E0Fe = – 0,87B заряд
(+) NiOOH + e + H2 разряд® Ni(OH)2 + OH– E0NiOOH = 0,49B. заряд
Суммарная токообразующая реакция:
⎯
⎯⎯
⎯
¬⎯ ⎯ ⎯
⎯⎯
⎯
⎯
¬⎯ ⎯ ⎯
⎯
⎯⎯
O⎯
¬⎯ ⎯ ⎯
O⎯
⎯⎯
⎯
¬⎯ ⎯ ⎯
⎯
⎯⎯
⎯
¬⎯ ⎯ ⎯
Cd + 2 NiOOH + 2H2 разряд® заряд
Fe + 2 NiOOH + 2H2O разряд® заряд
Cd(OH)2 + 2Ni(OH)2
Fe(OH)2 + 2Ni(OH)2
E0ЭДС = 1,30В
E0ЭДС = 1,36В.
79
На практике после заряда ЭДС у НКА может достигать 1,34В и у НЖА – 1,48В; через некоторое время эти значения снижаются: у НКА до 1,3-1,33В, у НЖА - до 1,32-1,35В. Разряжаются они до 1В, заряд ведется 1,2−кратным количеством электричества для НКА и 1,5 – для НЖА их емко-сти (ток заряда » 10% от емкости). При этом наблюдается выделение Н2 и О2. Из-за малого перенапряжения на железе заряд НЖА с самого начала сопро-вождается выделением водорода. Выделение же водорода на кадмиевом электроде наблюдается к концу заряда, из-за большого перенапряжения.
По основным характеристикам НК и НЖ аккумуляторы практически не отличаются. НЖ аккумуляторы дешевле, но обладают высоким саморазря-дом. Оба щелочных аккумулятора, в сравнении со свинцовым, характеризу-ются высокой механической прочностью, устойчивостью к вибрациям, большим сроком службы, простотой в обслуживании (не боятся перезаряда, коротких замыканий, хранения в разряженном состоянии). НЖ аккумуляторы применяются в пассажирских вагонах, локомотивах, электрокарах, погрузчи-ках. НК аккумуляторы наряду с перечисленным, широко используются в раз-личной переносной аппаратуре: связи, радио, телефонах, видео и другой электронной технике.
1.3. Основные электрохимические характеристики аккумуляторов 1.3.1. Электродвижущая сила
ЭДС аккумулятора (Е) - это разность его электродных потенциалов в отсутствии внешнего тока, что соответствует напряжению разомкнутой цепи (Uр.ц.):
E = Uр.ц. = Е(+) – Е(–) , (1)
где Е(+) и Е(–) – равновесные потенциалы электродов, В. Электродные потен-циалы измеряют при помощи вспомогательного электрода сравнения, напри-мер, хлорсеребряного (Ехс = 0,2В) и катодного вольтметра с большим внут-ренним сопротивлением (более 10 Ом).
При прочих равных условиях при работе ХИТ предпочтительней ис-точник тока с большей ЭДС. Для водных растворов ЭДС свинцового аккуму-лятора 2,1В одно из наиболее высоких. У щелочных ЭДС существенно мень-ше – 1,3В.
1.3.2. Разрядное напряжение, поляризация и внутреннее сопротивление
Разрядное напряжение (Uр) – это напряжение на клеммах аккумулятора при токе разряда I. Оно соответствует разности потенциалов между электро-дами под током (ЕI )
Uр = ЕI(+) – ЕI(−) = Uр.ц. − DЕ(+) − DЕ(−) − IRвн. , (2)
80
6
где − DЕ(+), DЕ(−) − поляризация соответствующего электрода, В; Rвн. − внут-реннее сопротивление аккумулятора (сумма сопротивлений электролита и электродов), Ом.
Поляризация – это отклонение потенциалов электродов от их равно-весных значений:
DЕ(+) = Е(+) − ЕI(+) (3) DЕ(−) = ЕI(−) −Е(−) (4)
Е(+) и Е(−) – равновесные потенциалы (при I = 0).
Увеличение Uр, а следовательно, и разрядного тока достигается за счет уменьшения DЕ (создаются условия, при которых скорость электродных ре-акций протекает быстро) и уменьшения Rвн. (за счет применения электроли-тов с высокой электропроводностью и конструктивных особенностей акку-мулятора).
Свинцовый аккумулятор характеризуется очень низким Rвн. (менее 0,01 Ом), т.е. более высокими разрядными токами, чем щелочной.
Зависимость между Uр и I называется вольтамперной характеристикой, а зависимость между Е и I – поляризационной диаграммой. Это важнейшие характеристики источника тока (рис. 1, 2).
I




Рис. 1 Поляризационная диаграмма аккумулятора
Рис. 2 Вольтамперная характери-стика аккумулятора
1.3.3. Емкость
Емкость – это количество электричества, которое отдать при разряде до конечного напряжения
Q = I · t ,
источник тока может
(5)
где Q - емкость, А·ч; I – разрядный ток (I = const), А; t - продолжительность разряда, ч.
81
Емкость определяют по кривым разряда (зависимость между Uр и t при I = const). Q зависит от массы активных веществ (по закону Фарадея), а также от конструкции, температуры (с уменьшением температуры Q снижа-ется), тока разряда. На определенный период эксплуатации емкость аккуму-лятора гарантируется изготовителем и входит в обозначение источника тока. Например, для щелочных КН-100 (100 А·ч), для кислотных СТ-54 (54 А·ч).
Эффективность зарядно-разрядного цикла оценивается коэффициентом отдачи по емкости (%)
КQ = Qp ×100%, (6) з
где Qp – емкость, отданная при разряде, Qз - емкость, сообщенная аккуму-лятору при заряде. При заряде, часть тока всегда теряется на побочное газо-выделение, что снижает Кq . У свинцовых аккумуляторов отдача по емкости составляет до 85%, а у щелочных – до 69%.
1.3.4. Энергия и мощность
Энергией аккумулятора называется количество энергии, которое при разряде передается во внешнюю цепь
W = Q · Uср, (7) где W – энергия, Вт·ч; Uср – среднее напряжение разряда, В.
Для сравнительной энергоемкости различных аккумуляторов служит величина удельной энергии (Вт·ч/кг)
Wуд = W/m, (8) где m – масса аккумулятора, кг. У свинцовых аккумуляторов Wуд составляет до 40 Вт·ч/кг, у щелочных она больше.
Мощность аккумулятора – это количество энергии, отдаваемое в еди-ницу времени (ВТ)
Р = W/t = Iср· Uср. (9)
1.3.5. Саморазряд
Саморазряд – уменьшение емкости источника тока при хранении с ра-зомкнутой цепью. Выражается в % от емкости в сутки или месяц.
Наибольший саморазряд у НЖ аккумуляторов 30-40% в месяц. При-чина в том, что порошкообразное железо отрицательного электрода заметно реагирует с водой с выделением водорода (в отличие от кадмия). У НК и свинцового аккумуляторов саморазряд невелик и составляет 3-5% в месяц. Саморазряд увеличивается при повышении температуры и при использова-нии загрязненных электролитов.
82
Q
1.3.6. Срок службы
Продолжительность использования аккумулятора определяется числом циклов заряда и разряда, а также условиями эксплуатации. У старторных свинцовых аккумуляторов он самый низкий – до 4 лет (250-300 циклов); у тя-говых до 6 лет (300-400 циклов). Щелочные аккумуляторы служат 10 и более лет (свыше 1000 циклов). Признаком негодности аккумулятора считается снижение емкости до 40%.
ПРАКТИЧЕСКАЯ ЧАСТЬ
2.1. Подготовка к измерениям
Для определения характеристик аккумуляторов подготовьте установку. Она включает: нагрузочное переменное сопротивление (реостат), вольт-метр (для измерения Uр.ц., Uр и Uз), амперметр, выпрямитель и 3 тумблера (1-й - для переключения режимов заряд-разряд, 2-й - для измерения потен-циалов положительного или отрицательного электрода, 3-й - для размыкания внешней цепи).
К установке необходимо подключить аккумулятор, катодный вольт-метр (для измерения потенциалов электродов) и хлорсеребряный электрод сравнения, предварительно опущенный в электролит аккумулятора.
2.2. Измерение ЭДС и равновесных потенциалов
Измерения производят при разомкнутой внешней цепи (3-й тумблер в положении – выкл.). Значение эдс (Uр.ц.) считывают на вольтметре, встроен-ном в установку. Вольтметром с высоким входным сопротивленим измеряют напряжение между электродами аккумулятора и хлорсеребряным (ХС) элек-тродом сравнения (при положении 2-го тумблера «-» для отрицательного электрода – UPb/хс, при «+» для положительного электрода – UPbO2/хс ).
Затем вычисляют равновесные потенциалы:
Е(–)=0,2 − UPb/хс (10) Е(+) = 0,2 + UPbO2/хс (11)
где 0,2 – потенциал хлорсеребряного электрода, В.
Используя данные раздела 1.2 и 1.3, можно оценить, в каком исходном состоянии находится аккумулятор: в заряженном или разряженном. Для чего сравнить измеренное значение ЭДС с теоретическим (для свинцового акку-мулятора в разряженном состоянии Uр.ц. < 2В, для НЖ и НК < 1,3В). Исходя из этого, дальнейшие измерения начинать с режима разряда или заряда.
83
2.3. Снятие вольтамперной характеристики и поляризацион-ной диаграммы
2.3.1. Разряд аккумулятора
При разряде (1-й тумблер в положении разряд, 3-й – вкл.) увеличивают реостатом силу тока через определенные интервалы (0,1-0,3 А). При каждом значении силы тока измеряют разрядное напряжение аккумулятора (U ) и по-тенциалы электродов под током (ЕI). Разряд проводить у свинцового аккуму-лятора до Uр = 1,8 – 1,85В, а для щелочных до Uр = 0,9 – 1,0В. Результаты опыта сводятся в табл. 1.
Таблица 1 Результаты измерений при разряде
р
Отрицательный электрод I, А Uр, В UPb/хс, В ЕI(−), В DЕ(−), В
Положительный электрод UPbO2/хс, В ЕI(+), В DЕ(+), В
DЕ(−) и DЕ(+) – поляризация электродов (рассчитывается по формулам 3 и 4.).
По данным табл. 1 построить два графика: вольтамперную характе-ристику (зависимость U от I) и поляризационные диаграммы (зависимость Е от I).
Из графических данных найти для исследуемого аккумулятора:
1) область рабочих разрядных токов (разрядные токи могут достигать и больших значений в режиме короткого замыкания, но при этом резко снижается UP);
2) как изменяется поляризация отрицательного и положительного электродов с ростом I?
3) какой из электродов лимитирует (больше поляризуется) работу ак-кумулятора, т.е. в итоге ограничивает емкость источника тока?
4) рассчитать Rвн (формула 2) для нескольких значений I и усреднить.
2.3.2. Заряд аккумулятора
Снятие зарядных кривых провести при тех же значениях силы тока, как при разряде (предварительно включить выпрямитель и 1-й тумблер в поло-жение - заряд). Результаты занести в табл. 2, аналогичную табл. 1 (при этом величину UP заменить на Uз ) и построить поляризационную диаграмму. Сде-лать вывод, какой из электродов больше поляризуется при заряде. Составить электрохимические побочные реакции газовыделения на положительном и отрицательном электродах.
84
2.4. Определение емкости
Перед измерением емкости аккумулятора следует иметь ввиду, что данный опыт довольно продолжительный по времени (30-60 минут на лабо-раторном аккумуляторе и несколько часов на промышленных). Причем ак-кумулятор предварительно должен быть полностью заряжен: 1,1 кратным количеством электричества от емкости для кислотного и 1,2 - 1,5 - кратным количеством для щелочных. Поэтому, по согласованию с преподавателем, исследуемый аккумулятор или сначала подзаряжают или сразу после опыта 2.3.2 проводят разряд при постоянной силе тока.
Сила разрядного тока в амперах составляет обычно 10% от емкости (как и сила зарядного тока). Можно проводить разряд и повышенными тока-ми (для сокращения времени разряда), но при этом можно занизить фактиче-скую емкость источника тока.
В начале опыта включить аккумулятор в режим разряда, установив разрядную силу тока. В ходе опыта силу тока поддерживать постоянной рео-статом и записывать через каждые 10-15 минут величину UP. в табл. 3.
Таблица 3 Результаты определения емкости
Время разряда (t), ч UP, В
Разряд закончить при падении напряжения на свинцовом аккумуляторе до 1,8 – 1,85В и на щелочных до 0,9 – 1,0В, построить график разрядной кри-вой (зависимость UP от t).
Рассчитать емкость по формуле (5). Если на опытном аккумуляторе присутствует маркировка, то рассчитать величину снижения емкости от но-минальной. Сделать вывод о целесообразности дальнейшего использования данного аккумулятора.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие электрохимические процессы протекают на отрицательном и положительном электродах свинцового и никель-кадмиевого аккумулятора: а) при разряде; б) заряде? В каком случае электроды служат катодом и в ка-ком анодом?
2. Как измерить равновесный потенциал электродов? Почему он отли-чается от токового значения потенциала?
3. Какой вид имеет принципиальная электрическая схема при заряде и разряде аккумулятора?
4. Какие основные применения у свинцового аккумулятора и почему? Какие аккумуляторы целесообразней использовать в пассажирских вагонах?
85
5. Какие аккумуляторы не боятся хранения в разряженном состоянии, перезарядки, вибрации и почему?
ЛИТЕРАТУРА
1. Зубрев Н.И. Инженерная химия на железнодорожном транспор-те. – М.: УМК МПС РФ, 1990. – 291 с.
2. Варапаев Н.В., Дасоян М.А., Никольский В.А. Химические источни-ки тока. – М.: Высшая школа. 1990. – 240 с.
86
ЛАБОРАТОРНАЯ РАБОТА № 33В
ИЗГОТОВЛЕНИЕ ТЕКСТОЛИТА И ГЕТИНАКСА МЕТОДОМ ПРЕССОВАНИЯ
Тема: методы получения деталей из сложных пластмасс.
Цель работы: ознакомление с методом получения листового текстоли-та и гетинакса.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Пластмассами называют материалы, изготовляемые на основе органи-ческих высокомолекулярных веществ. Эти материалы способны формоваться при определенных условиях вследствие их пластичности. Пластмассы при обычных условиях являются твердыми веществами.
Высокомолекулярные вещества, используемые для получения пласт-масс, часто называют смолами или полимерами.
Простые пластмассы состоят только из полимера, например, полиэти-лен, полипропилен и др. Но чаще состав пластмасс бывает более сложный. В них входят: связующее вещество – смола, составляющая основу пластмассы; наполнители – древесная мука, ткань, асбест и т.п., повышающие механиче-скую прочность пластмассы; пластификаторы – органические малолетучие жидкости (например, некоторые высококипящие сложные эфиры), придаю-щие материалу большую пластичность и устраняющие его хрупкость; краси-тели, сообщающие материалу требуемую окраску и другие вещества. Приме-ром таких сложных пластмасс являются фенолформальдегидные пластмассы.
По отношению к нагреванию смолы делятся на две группы: термопла-стичные и термореактивные.
Термопластичные смолы при нагревании размягчаются, становятся пластичными. При охлаждении они снова затвердевают, сохраняя при этом прежние свойства. Такие смолы можно использовать при производстве изде-лий неоднократно путем нагревания до пластического состояния, после-дующего формования и охлаждения. К термопластичным смолам относятся полимеры с линейной структурой молекул, например, полиэтилен, полихлор-винил, другие полимеризационные смолы. Их линейные цепи из атомов уг-лерода не связаны химически. Поэтому при нагреве молекулы приобретают возможность относительного перемещения, пластмассы становятся пластич-ными.
Термореактивные смолы при нагревании утрачивают пластичность, они становятся неплавкими и нерастворимыми. Это объясняется тем, что при нагревании происходит химическая реакция образования пространственной
87

структуры из линейных молекул. К термореактивным смолам относится, на-пример, фенолформальдегидная резольная смола.
Термопластичные материалы часто перерабатываются в изделия спо-собом литья под давлением и путем непрерывного выдавливания материала через отверстия соответствующего профиля (метод экструзии).
Термореактивные материалы перерабатываются преимущественно способом горячего прессования.
Сущность литья под давлением состоит в следующем. В цилиндр лить-евой машины поступает из бункера необходимое количество пластмассы в виде порошка или зерен. Так как цилиндр обогревается, то пластмасса раз-мягчается и под давлением плунжера поступает через отверстие в охлаждае-мую пресс-форму. В пресс-форме изделие быстро затвердевает и при обрат-ном ходе плунжера, когда происходит разъединение пресс-формы, автомати-чески выталкивается из нее; затем цикл литья под давлением начинается сно-ва. Длительность одного цикла всего 20-30 сек; за один цикл может быть от-лито несколько изделий по числу гнезд в форме. Поэтому производитель-ность литьевых машин очень высокая.
При переработке по методу экструзии твердый полимер непрерывно подается шнеком через участки высоких температур и давлений, где он пла-вится и превращается в компактную массу, а затем материал выдавливается, образуя требуемое изделие.
Методом экструзии могут быть изготовлены самые разнообразные из-делия: трубы и шланги, листы, имеющие ширину свыше 1 м и толщину бо-лее 6 мм, пленки такой же ширины, но меньшей толщины – вплоть до не-скольких сотых долей миллиметра.
При горячем прессовании в нижнюю половину формы (матрицы), за-крепленную на нижней плите пресса, загружается определенное количество пластмассы. Чтобы обеспечить заполнение формы, в нее загружают пласт-массу с небольшим избытком. Этот избыток выдавливается через зазор меж-ду плитами формы в виде тонкой, легко удаляемой пленки. После этого опускается вторая половина пресс-формы (пуансон) и создается сильное дав-ление на формуемый материал. Пресс-форма одновременно нагревается электрическим током (рис. 2 , с. 86).
Под влиянием нагрева и давления пластмасса хорошо заполняет форму и переходит постепенно в твердое неплавкое состояние. После этого плунжер пресса поднимают, извлекают готовое изделие и форму загружают новой порцией материала.
Если прессуют изделие из термопластичного полимера, то после окон-чания процесса форму охлаждают, давление снимают, из формы извлекают изделие.
Если полимер термореактивен, то форму можно не охлаждать, т.к. вследствие происшедшего структурования изделие из полимера уже не мо-жет течь или изменять полученную конфигурацию.
88
Метод горячего прессования уступает по производительности литью под давлением, т.к. требуется выдерживать изделие в пресс-форме до тех пор, пока оно не затвердеет.
Фенолформальдегидные пластмассы
Фенолформальдегидные пластмассы производятся промышленностью в наибольшем количестве. Основу их составляет фенолформальдегидная смола. Это высокомолекулярное вещество получается реакцией поликонден-сации фенола с формальдегидом. Реакция идет при нагревании смеси в при-сутствии катализатора-кислоты или щелочи. В зависимости от условий реак-ции поликонденсации можно получить три типа смол: новолачные, резоль-ные, резиты.
В бензольном кольце атомы углерода нумеруются по часовой стрелке, начиная с того, у которого есть заместители вместо атомов водорода.
Положение 2, 6 называется орто-положением, 4 – пара и 5, 3 – мета-положением. Атомы водорода в орто и пара-положении подвижны и вступа-ют в реакцию поликонденсации.
Новолачные смолы получают при следующих условиях: берется избы-ток фенола и кислый катализатор. Реакция протекает ступенчато.
При первой ступени происходит присоединение молекул формальдеги-да к молекулам фенола преимущественно по орто-положению. При этом атом водорода из орто-положения переходит к атому кислорода формальде-гида. Его двойная связь (С=О) разрывается и освободившейся связью атом углерода присоединяется по орто-положению к бензольному кольцу. В ре-зультате первой ступени присоединения образуются орто-феноло-спирты
1)
По второй ступени происходит конденсация молекул орто-феноло-спиртов. Спиртовая гидроксо-группа соединяется с атомом водорода по орто-
89



положению с образованием молекул воды. В результате получается новолач-ная смола
2)
Новолачная смола имеет линейное строение, растворяется в органиче-ских растворителях и по отношению к нагреванию является термопластич-ной смолой, которая при нагревании размягчается, становится пластичной, а при охлаждении снова затвердевает, сохраняя при этом прежние свойства.
Резольные смолы получают при следующих условиях реакции: берется избыток формальдегида и щелочной катализатор. Механизм реакции такой же, двухступенчатый. Однако вследствие избытка формальдегида, его при-соединение происходит не только по орто-, но и по пара-положению. В ре-зультате по первой ступени реакции при температуре 20-600С получаются различные орто-пара-феноло-спирты, например
1)
По второй ступени при температуре выше 700С происходит стадия конденсации феноло-спиртов по орто и пара-положению с образованием ре-зольной смолы, имеющей разветвленное строение, и получается вода, напри-мер
2)
90


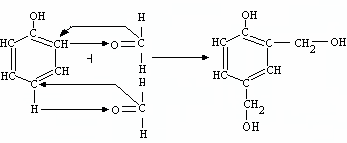

Резольная смола имеет больший молекулярный вес, чем новолачная. Число бензольных колец в ее молекулах колеблется от 6 до 15. Особенность состояния резольной смолы заключается в том, что она содержит активные спиртовые группы (метилольные) – СН2-ОН, способные к дальнейшей реак-ции поликонденсации. При нагреве смолы в пресс-форме происходит третья стадия переработки, дальнейшая реакция поликонденсации за счет активных спиртовых групп. При этом происходит сшивка отдельных молекул резоль-ной смолы метиленовыми мостиками (-СН2-), образуется полимер с про-странственным, сетчатым строением молекул – резит. Поэтому резольная смола является термореактивной, при нагреве затвердевает, при дальнейшем нагреве на размягчается, но при перегреве происходит ее деструкция. Строе-ние резита можно представить следующим образом
Резит не растворяется в органических растворителях, имеет простран-ственное строение, является термостабильной смолой, т.е. такой смолой, ко-торая при нагревании не плавится, а при перегреве разлагается на состав-ляющие элементы. Для изготовления пластмасс используют в основном ре-зольные смолы. Смолу вместе с добавками нагревают до 150-2000С, проис-ходит отвердение резольной смолы, т.е. переход ее в резит. При нагревании фенолформальдегидных смол от 2000 до 3000С происходит их разложение (деструкция).
В качестве наполнителей при получении пластмасс на основе резоль-ных смол применяют древесную муку, ткань, дерево и др.
В последнее время получили распространение древесносложные пла-стики на основе фенолформальдегидной смолы. Получают такие пластмассы путем обработки смолой древесного шпонта тонких листов древесины и по-следующего прессования их. Древесносложные пластмассы прочны, дешевы, используются в качестве конструкционных материалов: для изготовления шестерен и вкладышей подшипников в машиностроении, в производстве ме-бели.
Применяя в качестве наполнителей волокнистые материалы, получают пластмассы - волокниты, обладающие большей прочностью, чем получаемые
91

из пресс-порошка. Горячим прессованием из волокнитов готовят панели, рейки и втулки и др. детали промышленного назначения. При использовании хлопчатобумажной ткани в качестве наполнителя получается особенно проч-ная пластмасса - текстолит (текстильный камень). Процесс изготовления текстолита состоит из следующих операций: подготовка сырья, пропитка ткани на пропиточных машинах с последующей ее сушкой, нарезка ткани и сборка пакетов, прессование текстолита с одновременной его термообработ-кой и окончательная механическая доработка.
Схема технологического производства текстолита представлена на рис. 1 (стр.97).
Процесс подготовки сырья состоит из сшивания длинных отдельных кусков ткани для перемотки их в рулоны определенного веса. Их устанавли-вают на пропиточные машины. Затем производят пропитку ткани, для чего в ванну пропиточной машины загружают связующую смолу в виде раствора с органическим растворителем (спирт, ацетон и др.) заданной концентрации и вязкости, чтобы получить определенное количество связующей смолы в тка-ни. Для уменьшения вязкости пропиточного раствора ванну подогревают. Пропитка ткани производится обычно на вертикальных пропиточных маши-нах, имеющих коробку скоростей, для регулирования скорости движения ткани на шахте машины в пределах от 15 до 100м/ч и выше, а также снаб-женных устройствами для регулирования температуры по зонам. Скорость движения ткани по шахте и температура в шахте по зонам зависит от вязко-сти связующего вида растворителя, требуемого количества связующего в ткани, допустимого количества летучих веществ в ткани. Пропитанная ткань на специальных резательных машинах разрезается на полотнища, из пропи-танной ткани собираются пакеты. Количество слоев ткани в пакете опреде-ляется требуемой толщиной текстолита и давлением прессования. Прессова-ние текстолита производят на многоэтажных гидравлических прессах, снаб-женных паровым или электрическим секционным обогревом и имеющих систему водяного охлаждения. В каждый междуплиточный пролет пресса при небольшой толщине прессуемых листов можно загружать несколько па-кетов. При этом каждый пакет помещается в продольные металлические лис-ты, протертые специальной смазкой (олеиновая кислота и др.) Термообра-ботка производится в термошкафах, снабженных принудительной вентиля-цией и в некоторых случаях в прессах.
Во избежание появления вздутий термообработку проводят постепенно. Из листового и плиточного текстолита механическим путем изготовляют раз-личные детали. Текстолит поддается механической обработке, его можно пи-лить, сверлить, обрабатывать на токарных и фрезерных станках. Пропитан-ная ткань может использоваться для приготовления сложных, но сравни-тельно небольших текстолитовых деталей прессованием в пресс-формах. Ре-жимы прессования изделий отличаются от режимов прессования листового материала. Из текстолита готовят ответственные детали машин – шестерни, вкладыши подшипников, задние бабки для токарных станков и т.д. Шестер-
92
ни из текстолита обеспечивают бесшумность работы машин даже при боль-ших скоростях. Вкладыши из текстолита работают с меньшим коэффициен-том трения, чем из обычных антифрикционных сплавов и не требуют смазки, их достаточно охладить водой. И шестерни, и вкладыши подшипников из текстолита служат значительно более длительный срок, чем металлические. Если в качестве наполнителя используется бумага, получается пластмасса гетинакс. Если в качестве наполнителя используется асбест, получается пла-стмасса, например, с очень высоким коэффициентом трения. Она применяет-ся для изготовления тормозных колодок вагонов, дисков сцепления в авто-машинах и т.д. Текстолит используется в качестве электроизоляционного ма-териала.
В последнее время получили распространение стеклопластики, т.е. пластмассы, содержащие стекловолокнистый наполнитель. Если наполните-лем служит стеклянная ткань, то пластмасса называется стеклотекстолитом. В качестве связующих в производстве стеклопластиков широко используется различный термоактивный и термопластичный материал. Но самое широкое распространение получили связующие на основе полиэфирных смол, обла-дающих различными специфическими физико-механическими и технологи-ческими свойствами. Стеклопластики имеют, прежде всего, высокую меха-ническую прочность, хорошие электроизоляционные свойства (высокие ди-электрические свойства). Стеклопластики на основе эпоксидно-фенольных связующих стойки против комплексного воздействия влажности температу-ры и микроорганизмов, что дает возможность использовать его в тропиче-ских условиях в качестве электроизоляционного материала, значительно по-вышается надежность и срок службы электрооборудования по сравнению с оборудованием, в котором используется изоляция из текстолита и гетинакса. В электрических машинах стеклотекстолиты применяют в виде клиньев для пазовой изоляции статорных обмоток машин переменного тока, роторных обмоток генераторов и асинхронных двигателей, а также якорных обмоток машин постоянного тока. В трансформаторах стеклопластики применяют в виде цилиндров, трубок, листовых материалов и фасонных деталей для изо-ляции обмоток друг от друга и от кожуха трансформатора. Из стеклопласти-ков изготавливаются корпуса специальных электроприборов и генераторов, вентиляторы для электродвигателей, изоляции для электроприводов, кабель-ные наконечники, щиты для высоковольтной арматуры, детали для выключа-телей высокого напряжения. Стеклопластики могут работать при высоких температурах. Возможность применения изделий из стеклопластиков при высокой температуре обусловлена их низкой теплопроводностью, малой го-рючестью, сравнительно высокой теплостойкостью, способностью пластиков выделять газы, образующие теплозащитный слой на поверхности материала. Из стеклопластиков изготавливают ряд элементов конструкции самолета: за-концовки крыльев, винтов, сидения, двери, люки. В реактивных двигателях стеклопластики используются для изготовления направляющих лопаток ком-прессора.
93
В последнее время стеклопластики успешно начинают применяться в производстве ракет. Корпус ракеты из стеклопластика способен выдерживать действия механических и тепловых нагрузок аналогично корпусу из алюми-ниевых сплавов, титана или стали, причем скорость повышения температуры поверхности ракеты значительно меньше, чем при использовании металла. Кроме корпуса ракеты, из стеклопластиков изготавливают направляющее устройство ракетного двигателя, крылышки, хвостовое оперение. Благодаря хорошим радиотехническим свойствам (пропускают электромагнитные вол-ны без искажения, с минимальным поглощением энергии) стеклопластики широко применяются в радиотехнике и в промышленности средств связи.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Содержание работы заключается в изготовлении текстолита методом прессования на лабораторной установке. Прессование производится в пло-ской пресс-форме, состоящей из двух обогреваемых пластин (рис. 2. дет.2, 5), прикрепленных одна к верхнему упору масляного пресса и другая к плунже-ру масляного пресса. Электрообогрев обеих деталей включен последователь-но на 30 В и питается переменным током от трансформатора. Температура нагрева контролируется с помощью термопары, вмонтированной в нижнюю половину пресс-формы. Необходимое усилие для сжатия пресс-формы, рабо-тающей от ручного насоса, создается рукояткой насоса (рис. 2, дет. 11). Дав-ление масла внутри цилиндра пресса контролируется с помощью манометра (рис. 2, дет. 12), а его максимальная величина, 150атм ограничивается редук-ционным клапаном, включенным в маслосистему пресса. Для возвращения плунжера пресса в крайнее нижнее положение необходимо выпустить масло из цилиндра пресса в резерв путем открытия запорного крана (рис. 2, дет. 13). Если плунжер пресса в таких случаях не опускается под действием собствен-ного веса, необходимо сверху нажать с небольшим усилием на его высту-пающие края, с помощью рычажного механизма, смонтированного на прессе.
Последовательность операций при выполнении работы
1. При крайнем нижнем положении плунжера масляного пресса осто-рожно очистите рабочую поверхность пресс-формы от пыли и остатков пре-дыдущего прессования. Для этого пользуются х/б ветошью или, в крайнем случае, деревянными скребками. Ни в коем случае нельзя скоблить поверх-ность пресс-формы металлическими предметами.
2. Проверьте правильность подключения электрообогрева пресс-формы и его исправность.
3. Закройте выпускной масляный кран пресса (рис. 2, дет. 13) с помо-щью ручного масляного насоса, поднимите плунжер пресса вместе с под-вижной частью пресс-формы до полного ее упора (при этом оберегайте
94
пресс-форму от ударов) и включите электрообогрев. Степень нагревания пресс-формы контролируйте по показаниям термопары. Нагрев пресс-формы ведется в течение 40-50 минут до температуры 125-1350С. От степени нагрева пресс-формы зависит качество получаемого изделия и продолжительность прессования.
4. Для прессования необходимо получить у лаборанта уже высушенные (пропитанные резольной смолой) заготовки бумаги или х/б ткани, разрезать их на квадраты 5х5 см, собрать пакет (4-5 шт. заготовок).
5. Пакет вставьте внутрь пресс-формы. Для этого откройте выпускной масляный клапан (рис. 2, дет. 13), опустите плунжер пресса в крайнее поло-жение. Осторожно (чтобы не обжечь руки!) положите пакет на матрицу, за-крыть выпускной клапан и поднимите плунжер пресса с помощью ручного масляного насоса (рис. 2, дет. 11).
6. Доведите давление масла в цилиндре пресса до 150 атмосфер и по-держите его в течение 10-15 минут, изредка подкачивая масло ручным насо-сом. В течение 10-15минут произойдет полная поликонденсация смолы, и этим по существу заканчивается прессование.
7. После прессования открыть пресс-форму (как указано выше), извле-ките из пресс-формы полученный лист гетинакса или текстолита. Выключите обогрев. Очистите пресс-форму.
8. Зачистите напильником края полученного образца, предъявите его преподавателю вместе с отчетом и ответьте на контрольные вопросы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие материалы называют пластмассами? 2. Что такое простые и сложные пластмассы?
3. Каковы условия получения фенолформальдегидных смол, но-волачных, резольных и резитов?
4. В чем сущность механизма реакции поликонденсации?
5. Какие сложные пластмассы изготавливаются на основе ре-зольных смол и каковы их технические достоинства перед другими материалами?
6. Какова технология производства текстолита?
7. Что такое стеклотекстолит? Каковы его свойства и примене-ние?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н.В. Курс общей химии. - М.: Высшая школа, 2001. – С. 450-466.
95
Рис. 1 Схема технологического процесса изготовления текстолита
1 – ткань для пропитки; 2 – раствор смолы; 3 – сушильный шкаф; 4 – пропи-танная ткань; 5 – стол для пакетирования; 6 – подъемник; 7 - гидравлический пресс; 8 – фрезерный станок; 9 – секции пресс-формы для подогрева __________________________________________________________________
1, 7 – плиты;
2, 5 – плиты пресс-формы; 3, 4 – теплоизоляция;
6 – направляющие стержни; 8 – гидравлический плунжер; 9 – гидравлический пресс;
10 – спираль; 11 – насос;
12 – манометр;
13 – запорный кран.
Рис. 2 Схема лабораторной установки для получения текстолита
96


ЛАБОРАТОРНАЯ РАБОТА № 34В
ДЕСТРУКЦИЯ ПЛАСТМАСС
СВЕДЕНИЯ ИЗ ТЕОРИИ
Пластмассами называются материалы, изготовленные на основе орга-нических высокомолекулярных веществ, полимеров, способных при опреде-ленных условиях формоваться вследствие их пластичности. Полимерные соединения (макромолекулы) состоят из очень большого числа атомов угле-рода, и это определяет ряд их физико-химических свойств.
Помимо большого числа положительных качеств, обеспечивших ши-рокое применение пластмасс в различных отраслях народного хозяйства, имеются отрицательные свойства. Одним из них является старение пласт-масс – процесс, при котором под влиянием различных факторов изменяется состав и строение полимерных молекул. Одной из разновидностей старения является деструкция пластмасс. При деструкции происходит разрушение макромолекул высокомолекулярных соединений, сопровождающееся изме-нением их структуры, понижением молекулярного веса, обусловливающим изменение физико-химических, механических, электрических и других свойств.
Деструкция пластмасс может происходить под действием физических факторов: тепла (термическая деструкция); света (фотохимическая деструк-ция); излучения (радиационная деструкция); при механическом разрушении макромолекул (механическая деструкция), например, при дроблении, исти-рании, при действии ультразвука; при действии химических агентов: окисли-телей (окислительная деструкция) и др. веществ.
Деструкция пластмасс часто приводит к ухудшению свойств полимер-ных материалов; однако ее нельзя рассматривать только как отрицательное явление.
Например, она широко используется при совмещении пластмасс с раз-личными веществами, при производстве резины и пластикатов, при получе-нии блок – привитых полимеров и т.д.
Механизм деструкции полимеров чаще имеет радикально цепной ха-рактер. При этом происходит разрыв химической связи между атомами угле-рода, образующих цепь молекулы полимера, и образование всевозможных «осколков» - веществ с малым молекулярным весом.
Частным случаем деструкции пластмасс является образование молекул мономера из полимера. В этом случае происходит реакция деполимеризации.
Деполимеризация полимерных соединений происходит при нагрева-нии, независимо от того, состоят ли цепи только из одних атомов углерода или в них входят также атомы кислорода, азота, серы и других элементов.
97
ОТНОШЕНИЕ РАЗЛИЧНЫХ ПЛАСТМАСС К НАГРЕВАНИЮ
1. Полиэтилен (-СН2-СН2-)n − белое, твердое, но эластичное вещество, легче воды. Размягчается при температуре около 100 С, разлагается при 1150С. Из этого следует, что изделия из полиэтилена следует оберегать от сколько-нибудь значительного нагревания.
2. Поливинилхлорид (винилпласт) (-СН2-СНCl-)n . Порошкообразное, нетоксичное вещество белого цвета. Еще менее термостоек, чем полиэтилен, т.к. размягчается уже при 50-600С, легко сверлится, сваривается при нагрева-нии горячим воздухом до 2000С. При деструкции не образует мономера.
3. Политетрафторэтилен (-СF2-СF2-)n . В России известен под названи-ем фторопласт – 4, в США – тефлон. Это белое порошкообразное вещество, похожее на парафин. Политетрафторэтилен не плавится, но размягчается при температуре около 3000С. Изделия из политетрафторэтилена можно при-менять при температуре от – 700 до 2600С. При нагревании полимера в ва-кууме до 4900С начинается заметный его распад с образованием в основном тетрафторэтилена.
4. Полистирол:
Полистирол нетоксичное вещество. Бывает прозрачный и непрозрач-ный. Прозрачный полистирол внешне похож на полиметилметакрилат, но при постукивании звенит, а пленка из него дребезжит. Полистирол не стоек по отношению к нагреванию: размягчается уже при 80-900; при 1000 – под-вергается деполимеризации.
5. Полиметилметакрилат (акрилат, плексиглас – органическое стекло):
Из всех пластмасс полиметилметакрилат наиболее прозрачен. Поли-мер размягчается при 70-800С и до 100-1250С. При нагревании до 3000С под-вергается деполимеризации с выделением мономера, желтоватой жидкости со специфическим запахом.
6. Капрон (−NH−(CH2)5 −CO−)n. Термопластичный полимер плавится при 215 С. При нагревании свыше 215 С разлагается с выделением аммиака.
Ввиду того, что прядение капронового полотна производится не из рас-твора, а из расплава, капроновые изделия, вышедшие из употребления, снова могут быть использованы для повторной переработки.
7. Фенолформальдегидные пластмассы или фенопласты. Окрашены в темный цвет, от темно коричневого до черного. Неплавки. При нагреве до 3000С подвергаются деструкции с выделением фенола.
98
0
0 0


8. Каучуки. Каучуками, эластомерами называются полимеры, сохра-няющие упругие свойства в пределах широкого интервала температур. В на-стоящее время применяют натуральные и синтетические каучуки. Натураль-ный каучук представляет собой полимер изопрена:
Нагревание натурального каучука приводит к его деполимеризации с выделением изопрена. Из искусственных каучуков самым термостойким яв-ляется силиконовый. Он сохраняет эластичность и механическую прочность при температурах от – 900С до 2600С. Изделия из силиконового каучука мо-гут эксплуатироваться при температурах от – 700С до 2500С.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Содержание работы заключается в осуществлении сухой перегонки пластмасс и позволяет пронаблюдать деструкцию последних. Работа выпол-няется в вытяжном шкафу. Сухая перегонка пластмасс производится в при-боре, состоящем из сосуда (а), где производится нагревание пластмассы (этот сосуд закреплен в лапках штатива). Сосуд при помощи газоотводной трубки (б) соединяется с ловушкой (в), которая в свою очередь сообщается с сосу-дом – сборником продуктов деструкции (г). Назначение ловушки - не допус-тить засасывания раствора из сосуда-приемника в сосуд перегонки. Ловушка находится в резервуаре (д), заполненном водой и играющем роль холодиль-ника. Этот резервуар также закреплен в лапках штатива.
Задание 1. Деструкция полихлорвинила
1. В пробирку для сухой перегонки (а) засыпьте небольшое количест-во (примерно на 1 см по высоте) мелко нарезанного полихлорвини-ла.
2. В пробирку-приемник (г) налейте небольшое количество воды с добавлением индикатора метилоранжа и в этот раствор погрузите конец отводной трубки ловушки.
3. Произведите нагревание пробирки (а) с пластмассой на спиртовке. При этом сразу же, если прибор герметичен, из конца отводной трубки, находящегося в растворе метилоранжа выделяются пузырь-ки воздуха.
При самом непродолжительном нагревании полихлорвинил подверга-ется деструкции с образованием хлористого водорода в виде густых белых паров и смеси различных низкомолекулярных продуктов, среди которых мо-номера не обнаруживается.
99



Когда белые пары HCl достигают сосуда-приемника, в последнем обра-зуется кислая среда, на которую указывает красный цвет раствора. Напишите уравнение происходящей реакции деструкции.
Задание 2. Деструкция полиметилметакрилата (плексиглас)
В чистую высушенную пробирку для перегонки засыпьте 1/3 пробирки стружки полиметилметакрилата, присоедините газоотводная трубка, затем подставьте пустой приемник. Нагревание происходит до тех пор, пока из по-лимера конденсируются и собираются в приемнике пары в виде желтоватой жидкости. Если на эту жидкость подействовать бромной водой, то она обес-цветится, что говорит о наличии двойных связей в получившемся продукте. Имеются ли двойные связи в исходном продукте, подвергающемся деструк-ции, т.е. полиметилметакрилате?
Напишите уравнение деструкции полиметилметакрилата, имея в виду, что при этом получается его мономер, метилметакрилат и взаимодействие метилметакрилата с бромной водой.
Задание 3. Деполимеризация каучука
В чистую сухую пробирку засыпьте примерно 1/8 мелко нарезанного каучука, присоедините газоотводная трубка, в приемник налейте раствор КMnO4 с водой. При довольно продолжительном нагревании (10-15 мин) из каучука выделяется коричнево-желтоватые пары изопрена конденсирующие-ся в жидкость, обесцвечивающие, благодаря наличию двойных связей, рас-твор перманганата в приемнике.
Уравнение деполимеризации натурального каучука:
Напишите реакцию взаимодействия изопрена с бромной водой. Каков ее механизм? Напишите реакцию взаимодействия перманганата калия с изо-преном, составьте электронный баланс этой реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ
3. Что такое пластмассы?
4. Что такое деполимеризация и в каких условиях она осуществ-ляется?
5. Какой продукт получается при деструкции полиметил-метакрилата? Какова его формула?
6. Какой продукт получается при деструкции поливи-нилхлорида? Как это можно проверить? Каковы его формулы?
100

7. Что происходит при сухой перегонке натурального каучука? К каким углеводородам (предельным или непредельным) отно-сится получившийся продукт? Как это проверить?
8. Какое отношение политетрафторэтилена к нагреванию?
9. Почему вышедшие из употребления изделия из капрона могут быть подвергнуты повторной переработке?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н.В. Курс общей химии. – М.: Высшая школа, 2001. – С. 450-466.
а – пробирка для нагревания пластмассы;
б – газоотводная трубка;
в – ловушка;
г – приемник для продуктов деструкции;
д – резервуар для охлаждения.
Рис. Прибор для деструкции пластмасс
101
ЛАБОРАТОРНАЯ РАБОТА № 45
ДИСПЕРСНЫЕ СИСТЕМЫ И ИХ СВОЙСТВА
Цель работы: ознакомление с методами получения дисперсных систем и изучение их поверхностных коллоидно-химических свойств.
Рабочее задание:
1. Конденсационным методом получить гидрозоль гидроксида железа, очистить от примеси электролита методом диализа, изучить коагуляцию гид-розоля под действием электролита.
2. Установить роль поверхностных явлений в дисперсионном методе получения эмульсии керосина в воде.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Дисперсные системы широко распространены в природе, применяются в технике, строительстве в виде пылей, дымов, туманов, пен, тканевой жид-кости растений и живых организмов, а также цементов, в виде эмульсионных смазочно-охлаждающих жидкостей, лаков, красок, тканей, различных по-рошкообразных строительных материалов, пенопластов и т.д.
Классическим примером сложных дисперсных систем являются грунты.
Дисперсными называются гетерогенные системы, содержащие две (или более) фазы, одна из которых в виде частичек распределена в другой. Сово-купность раздробленных частиц называется дисперсной фазой, а фаза, в ко-торой распределены дисперсные частицы – дисперсионной средой.
Системы, содержащие частицы с размером 10-9 – 10-7м, называются коллоидными или золями. К дисперсным системам относятся также эмуль-сии и суспензии, имеющие размер частиц 10-7 – 10-5м и более.
Коллоидные системы могут быть получены конденсационным, диспер-сионным методами и методом пептизации. Для получения устойчивого гид-розоля необходимо выполнить три условия:
1) вещество дисперсной фазы не должно быть растворимо в дисперси-онной среде – в воде;
2) обеспечить коллоидную степень дисперсности частиц; 3) наличие стабилизатора.
Устойчивость золей обеспечивается образованием одноименных заря-дов на поверхности коллоидных частиц и возникновением вследствие этого электрокинетического или дзета z-потенциала. Возникает он вследствие ад-сорбции поверхностью части полярных молекул или ионов из раствора. При
102
этом выполняется правило: адсорбируются те ионы, которые входят в состав ядра мицеллы, или близкие по своей природе к составу ядра и имеются в из-бытке. Поэтому, зная состав ядра, порядок приготовления золя, ионы, содер-жащиеся в растворе, можно показать строение и написать формулу мицеллы, имея в виду, что она должна быть электронейтральной.
Ввиду того, что при получении коллоидных систем с помощью хими-ческих реакций, например путем гидролиза солей, образуется большое коли-чество электролитов, снижающих устойчивость золей, возникает необходи-мость их очистки. Осуществляется она с помощью особого метода, называе-мого диализом. При диализе коллоидная система с примесями истинно рас-творенных веществ отделяется полупроницаемой мембраной от чистого рас-творителя. Коллоидные частицы вследствие больших размеров не проходят через нее, а молекулы и ионы проходят и диффундируют в растворитель. При постоянной его смене можно получить практически чистый золь.
Как известно, коллоидные системы являются термодинамически неус-тойчивыми, так как обладают большим избытком свободной поверхностной энергии. Вследствие этого они имеют низкую агрегативную устойчивость и склонны к коагуляции.
Коагуляция – процесс слипания коллоидных частиц с образованием более крупных агрегатов. Очень часто коагуляция наступает под воздействи-ем электролитов, которые изменяют структуру диффузионного слоя ионов, уменьшая величину z- потенциала до нулевого значения.
Наименьшая концентрация электролита, при которой снижается агре-гативная устойчивость и происходит коагуляция за короткий промежуток времени, называется порогом коагуляции.
Пусть молярная концентрация исходного электролита будет С, моль/л, объем его, вызвавший коагуляцию, - V мл., тогда число миллимолей его бу-дет равняться
VC = 1000 CV/1000.
Порог коагуляции равняется
g = C .V . 1000 мл-молей/л золя, W
где W – объем взятого золя (мл).
Как отмечено выше, широко распространенными представителями дисперсных систем являются эмульсии и суспензии.
Эмульсией называется дисперсная система, состоящая из двух практи-чески взаимно нерастворимых жидких фаз, одна из которых распределена в другой в виде мельчайших капелек. Эмульсии бывают двух типов: масло в воде (м/в) или вода в масле (в/м). Под маслом понимают любую органиче-скую жидкость, несмешивающуюся с водой.
103


Как правило, эмульсии получают диспергированием (дроблением од-ной жидкости в другой). При взбалтывании двух чистых жидкостей обычно не получается устойчивой эмульсии, т.е. образующиеся капельки при стал-кивании друг с другом сливаются, коалесцируют и эмульсия быстро расслаи-вается.
Образование устойчивых эмульсий возможно только в присутствии поверхностно-активных веществ (ПАВ) – стабилизаторов или эмульгаторов. Адсорбируясь на поверхности капелек, они уменьшают избыток поверхност-ной энергии, т.е. поверхностное натяжение, и тем самым увеличивают агре-гативную устойчивость эмульсий. Примером ПАВ является обычное натрие-вое мыло, смесь натриевых солей высших жирных кислот, например, стеарат натрия.
Молекула мыла состоит из полярной и неполярной части – углеводородного радикала R(СnH2n+1). Его молекулы адсорбируются на по-верхности частицы таким образом, что полярной частью обращаются к воде, а углеводородным радикалом к органической фазе (рис.1).
Рис. 1 Схема стабилизации коллоидных частиц
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Опыт 1. Получение коллоидных растворов (гидрозоля гидроксида железа)
Налейте в две конические коблы А и Б по 100мл дистиллированной воды. Воду в колбе А нагрейте до кипения. Затем в каждую колбу прилейте небольшими порциями (в 3-4 приема) по 10мл 2% раствора FeCl3. Как изме-нится окраска раствора? Раствор в кобле А прокипятите в течение 1-2 мин, затем охладите холодной водой под краном. Напишите уравнение реакции гидролиза, дайте схему строения и формулу мицеллы гидрозоля Fe(OH)3. Покажите строение двойного электрического слоя, объясните роль дзета-
104



потенциала в опыте. Каким методом получен коллоидный раствор и в чем его сущность? (Полученные растворы сохраните для следующих опытов).
Опыт 2. Диализ гидрозоля гидроксида железа.
Диализатор представляет собой емкость, разделенную на две части по-лупроницаемой перегородкой (ППП) из целлофана или другого материала. Одну часть заполните гидрозолем, вторую – дистиллированной водой (рис.2.). Уровень гидрозоля должен быть выше уровня воды. Через 15 мин отберите пробы воды в 2 пробирки по 2-3 мл. В первую пробирку добавьте 2-3 капли 0,1н раствора AgNO3, во вторую – 1-2 капли метилоранжа.
Рис. 2. Схема процесса диализа
В отчете объясните причину появления осадка в первой и изменение цвета во второй пробирке.
Какие частицы проходят через мембрану, какие не проникают через нее?
Опыт 3. Определение порога коагуляции золя гидроксида железа
В пять пробирок (табл.) с помощью мерного цилиндра налейте по 10 мл золя Fe(OH)3, из бюретки необходимое количество воды. Затем поочеред-но в каждую пробирку введите указанное количество 0,001М раствора Na2SO4 . Сразу же после прибавления электролита каждая пробирка закрыва-ется пробкой, встряхивается для перемешивания растворов и ставится в шта-тив.
Помутнение отмечается знаком “+” и отсутствие – знаком “–“. Заметьте две соседние пробирки, в одной из которых наблюдается явное помут-нение, а в другой помутнение отсутствует. Для расчета порога коагуляции (см. теоретическую часть) берется среднее значение объема электролита ме-жду ними.
105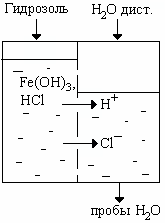
Содержание пробирок
Таблица № пробирок 1 2 3 4 5
Золь 10 10 10 10 10 Вода, мл. 4 3 2 1 0 Электролит, мл 1 2 3 4 5 Общий объем, мл 15 15 15 15 15 Результаты
наблюдения
Опыт 4. Приготовление эмульсии керосина в воде
В пробирку налейте 1 мл приготовленного раствора мыла, а затем туда же прилейте 1 мл керосина. Закройте пробирку резиновой пробкой и со-держимое пробирки сильно встряхните. Когда весь керосин будет смешан с мыльным раствором, к полученной массе прилейте 10 мл дистиллированной воды и, закрыв пробирку пробкой, снова несколько раз встряхните содержи-мое пробирки. Проследите за процессом разрушения эмульсии. Отметьте время начала расслаивания фаз.
В другую пробирку налейте 1 мл дистиллированной воды, а затем туда же прилейте 1 мл керосина. Закройте пробирку резиновой пробкой и содер-жимое пробирки сильно встряхните. Когда керосин будет смешан с водой, к полученной массе прилейте 10 мл дистиллированной воды, и, закрыв про-бирку пробкой, снова несколько раз встряхните содержимое пробирки.
Отметьте и сравните время начала и конца расслаивания эмульсии в каждой пробирке. Объясните причину наблюдаемого различия устойчивости полученных эмульсий, используя знания о поверхностных явлениях.
Оформите и сдайте отчет, изучив лекционный материал.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каково принципиальное различие между коллоидными и истинными растворами?
2. В чем сущность конденсационных и дисперсионных методов полу-чения коллоидных систем? Показать на примерах.
3. В чем причина низкой агрегативной устойчивости коллоидных систем? Как она зависит от величины электрокинетического потенциала (z-потенциала) и поверхностного натяжения?
4. Что такое коагуляция? Какова роль электролита в процессе коагуля-ции? Что такое порог коагуляции?
5. Каким образом достигается устойчивость эмульсии? Какова роль ад-сорбции?
106
ЛИТЕРАТУРА
1. Коровин Н.В. Курс общей химии. – М.: Высшая школа, 1990. – С.172–184.
2. Писаренко А.П., Поспелова К.А., Яковлев А.Г. Курс коллоидной химии.– М.: Высшая школа, 1969. – 248 с.
3. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2003. – 289 с.
107
ЛАБОРАТОРНАЯ РАБОТА № 46
