
- •Раздел I. Механика. Молекулярная физика. Термодинамика 16 глава 1. Законы динамики ньютона. Законы сохранения 16
- •Вопросы и задачи к главе I. 33 глава 2. Молекулярно-кинетическая теория газов
- •Глава 3. Применение первого начала термодинамики к процессам в идеальном газе 52
- •Глава 4. Реальные газы 74
- •Вопросы и задачи и вопросы к главе 4. 82 глава 5. Поверхностное натяжение жидкости 82
- •Вопросы и задачи к главе 5 102
- •Глава 6. Вязкость жидкости 103
- •Вопросы и задачи к главе 6 116
- •Глава 7. Твёрдые и жидкие кристаллы. Стеклообразное состояние вещества. Полимеры 117
- •Глава 8. Процессы переноса 127
- •Раздел II колебания и волны 135
- •Глава 1. Механические колебания 135
- •Вопросы и задачи к главе 1. 153
- •Глава 2. Механические волны 153
- •Вопросы задачи к главе 2. 158
- •Глава 3. Звук 159
- •Вопросы и задачи к главе 3. 167
- •Глава 4. Ультразвук. Его применение в медицине. Инфразвук
- •Вопросы задачи к главе 4 180
- •Глава 5. Электромагнитные колебания и волны 181
- •Вопросы задачи к главе 5 201 глава 6. Оптика 201
- •Вопросы задачи к главе 6 251
- •Раздел III. Атомная, ядерная и квантовая физика
- •Глава 1. Тепловое излучение тел 253
- •Глава 2. Рентгеновское излучение 261
- •Глава 3. Радиоактивность 272
- •Глава 4. Дозиметрия ионизирующих излучений 282
- •Раздел IV. Биофизика 337 глава1 молекулярная биофизика 337
- •Глава 2. Биологические мембраны. 358
- •Глава 3. Термодинамика биологических систем 386
- •Глава 4. Транспорт веществ через биологические мембраны
- •Глава 5. Биопотенциалы 416
- •Глава 6. Биофизика нервного импульса 427
- •Глава 7. Моделирование биологических процессов 446
- •Введение
- •Раздел I механика. Молекулярная физика. Термодинамика.
- •Глава 1 законы динамики ньютона. Законы сохранения.
- •1.1. Законы ньютона. Основные дифференциальные уравнения движения.
- •Здесь аx , аy , аz - проекции вектора ускорения на оси координат X , y и z;
- •1. 2. Законы сохранения импульса и энергии
- •. Задача о центральном ударе шаров: абсолютно упругом и абсолютно неупругом.
- •1.4 Физические основы центрифугирования
- •Глава 2. Молекулярно-кинетическая теория газов
- •2.1 Отличия молекулярной структуры газов, жидкостей и твёрдых тел. Характер молекулярного движения в различных состояниях вещества. Аморфные и кристаллические жидкости и твёрдые тела
- •Примечание 2
- •2.2 Основное уравнение молекулярно-кинетической теории газов. Средняя квадратическая скорость молекул газа.
- •2.3 Средняя кинетическая энергия поступательного движения молекул газа. Распределение энергии по степеням свободы. Внутренняя энергия идеального газа
- •2.4 Распределение Максвелла молекул идеального газа по абсолютным значениям их скоростей.
- •2.5 Распределение Больцмана по потенциальным энергиям молекул идеального газа. Барометрическая формула Больцмана.
- •Глава 3. Применение первого начала термодинамики к процессам в идеальном газе.
- •3.1. Особенности термодинамического метода. Первое начало термодинамики.
- •3.2. Применение первого начала термодинамики к равновесным изопроцессам идеального газа
- •Работа газа при его расширении
- •Теплоёмкость
- •Политропные процессы - процессы с постоянной теплоёмкостью.
- •Глава 4. Реальные газы
- •4.1.Уравнение состояния реального газа Ван - дер - Ваальса и изотермы Ван- дер - Ваальса.
- •4.2. Изотермы Эндрюса
- •Сжижение газов. Получение низких температур.
- •Глава 5. Поверхностное натяжение жидкости
- •5.3 Поверхностные явления на границе твёрдой, жидкой и газообразной фазы. Краевой угол смачивания. Смачивание и несмачивание твёрдой поверхности жидкостью.
- •5.4 Давление Лапласа. Капиллярные явления.
- •5.5 Методы определения коэффициента поверхностного натяжения
- •1. Метод отрыва капель
- •2. Метод отрыва кольца
- •Глава 6. Вязкость жидкости
- •6.1 Вязкость жидкости. Закон ньютона. Ньютоновские и неньютоновские жидкости. Реологические свойства биологических жидкостей в норме и при патологиях
- •6.2 Ламинарное течение жидкостей по цилиндрическим трубам с жёсткими стенками. Формула пуазейля. Закон гагена – пуазейля
- •1. Метод капиллярного вискозиметра (оствальда).
- •2. Метод падающего шарика (стокса)
- •Глава 7 твёрдые и жидкие кристаллы. Стеклообразное состояние вещества. Полимеры.
- •7.1. Фазовые переходы. Плавление, кристаллизация, сублимация.
- •7.2.Кинетические превращения. Стеклование и размягчение
- •7.3. Жидкие кристаллы
- •7.4. Кристаллические модификации твёрдых кристаллов.
- •7.5 Механические свойства твёрдых тел. Закон гука. Упругость и пластичность
- •7.6 Полимеры. Их кристаллическое, стеклообразное, высокоэластическое, вязкотекучее состояние.
- •Глава 8. Процессы переноса
- •8.1. Диффузия
- •8.2. Теплопроводность
- •8.3. Вязкость
- •8.5. Общий вид уравнений процессов переноса
- •Раздел II
- •Глава 1. Механические колебания
- •1.2. Свободные незатухающие механические колебания
- •1.3 Смещение, скорость и ускорение гармонически колеблющегося тела
- •1.4. Энергия гармонически колеблющегося тела
- •1.5. Свободные затухающие колебания
- •1.6 Вынужденные колебания. Резонанс
- •1.7. Автоколебания
- •1.8. Сложения гармонических колебаний, направленных по одной прямой. Теорема фурье. Гармонический спектр сложного колебания
- •Вопросы и задачи к главе 1
- •Глава 2. Механические волны
- •2.1 Механические волны, продольные и поперечные волны
- •2.2. Уравнение и график плоской незатухающей гармонической волны
- •2.3. Энергия волны. Поток энергии. Интенсивность.
- •Вопросы и задачи к главе 2
- •Глава 3. Звук
- •3.1. Субъективные (физиологические) характеритики восприятия звука и их связь с объективными, физическими характеристиками звуковой волны
- •3.2 Область слышимости
- •3.3. Закон вебера-фехнера
- •3.4. Уровень интенсивности
- •Уровень громкости, фон
- •Вопросы и задачи к главе 3
- •Глава 4. Ультразвук. Его применение в медицине инфразвук
- •4.1. Физические свойства ультразвука
- •1. Частотный диапазон ультразвука
- •2. Скорости распространения ультразвука
- •3. Особенности физических свойств ультразвука
- •4. Отражение ультразвука на границе раздела сред
- •5. Поглощение ультразвука
- •4.2 Действие ультразвука на вещество. Биологическое действие ультразвука
- •Механическое действие
- •2..Тепловое действие
- •3. Физико-химическое действие ультразвука
- •4. Биологическое действие ультразвука
- •1. Диагностика.
- •4.4.Источники и приёмники ультразвука
- •1. Пьезоэлектрические излучатели-приёмники
- •2. Магнитострикционные излучатели ультразвука
- •Инфразвук
- •Вопросы и задачи к главе 4
- •Глава 5. Электромагнитные колебания и волны
- •5.1. Некоторые необходимые сведения об основах электричества и магнетизма.
- •Электрические заряды
- •Закон кулона
- •Электроёмкость электрического конденсатора
- •6) Сила ампера -
- •8) Закон электромагнитной индукции фарадея
- •11)Энергия магнитного поля катушки индуктивности
- •5.3. Идеальный колебательный контур
- •5.4. Реальный колебательный контур
- •5.4. Получение незатухающих электромагнитных колебаний
- •5.5. Основные положения теории максвелла
- •Глава 6. Оптика
- •Корпускулярно – волновая природа света
- •6.2. Интерференция света
- •. Разрешающая способность оптических приборов-
- •. Голография
- •Поляризованный свет
- •Естественный и поляризованный свет.
- •2. Поляризатор и анализатор. Закон Малюса.
- •3. Поляризация света при отражении и преломлении. Закон Брюстера.
- •4. Двойное лучепреломление
- •Получение поляризованного света.
- •6. 11 Вращение плоскости поляризации. Оптическая активность. Поляриметрия.
- •Дисперсия света
- •Нормальная дисперсия
- •Качественное объяснение причины нормальной дисперсии
- •Аномальная дисперсия
- •Поглощение света
- •1.Закон Бугера - Ламберта
- •2. Закон Бера
- •Закон Бугера – Ламберта – Бера
- •Коэффициент пропускания и оптическая плотность. Колориметрия
- •2. Два вида рассеяния
- •3. Закон Рэлея
- •4.Турбидиметрия и нефелометрия.
- •6.14. Элементы геометрической оптики
- •Законы отражения и преломления света
- •Явления предельного преломления и полного внутреннего отражения
- •Волоконная оптика. Световоды
- •4.Линзы. Примеры построения изображений в тонких линзах
- •Микроскоп
- •Оптическая система глаза. Некоторые её недостатки, их исправление
- •Рефрактометр
- •Раздел III . Атомная, ядерная и квантовая физика
- •Глава 1. Тепловое излучение тел
- •Основные характеристики теплового излучения. Абсолютно чёрное тело
- •Закон кирхгофа
- •1.2 Спектр теплового излучения абсолютно чёрного тела.Закон вина. Закон стефана-больцмана.
- •1.3 Гипотеза планка. Формула планка
- •1.5. Примеры применения теплового излучения в фармации и медицине
- •Глава 2. Рентгеновское излучение
- •2.1 Простейшая рентгеновская трубка
- •2.2. Основные свойства рентгеновского излучения.
- •Рентгенодиагностика:
- •Рентгенотерапия.
- •Научные исследования.
- •2.4. Природа рентгеновского излучения
- •2.6 Характеристическое рентгеновское излучение
- •Глава 3. Радиоактивность
- •3.1. Радиоактивность. Виды радиоактивных излучений. Основные типы ядерных распадов.
- •3.2 Основной закон радиоактивного распада
- •3.3 Активность радиоактивных препаратов
- •3.4. Ядерные реакции. Меченые атомы
- •Глава 4. Дозиметрия ионизирующих излучений
- •2) Характеристическое рентгеновское излучение.
- •2) Характеристическое рентгеновское излучение.
- •Глава 5. Элементы квантовой механики.
- •5.1. Волновые свойства микрочастиц. Уравнение дё бройля
- •5.2. Электронный микроскоп
- •5.3. Основные положения квантовой механики
- •5.4. Решение уравнения шрёдингера для частицы в потенциальной яме с бесконечно высокими стенками
- •Глава 6. Люминесценция
- •6.1. Виды люминесценции
- •6.2. Фотолюминесценция. Флюоресценция. Фосфоресценция
- •6.3. Спектр фотолюминесценции. Правило стокса
- •6.4. Люминесцентный анализ. Применение в фармации и медицине
- •6.5. Хемилюминесценция
- •Глава 7. Лазер
- •7.1. Вынужденное излучение. Инверсная заселённость. Метастабильные уровни
- •7.3. Свойства лазерного излучения
- •7.4. Применение лазерного излучения в фармации и медицине
- •Глава 8. Оптическая спектроскопия. Ик- спектроскопия. Радиоспектроскопия.
- •8.1. Спектры испускания и спектры поглощения. Спектрографы. Спектрометры. Спектрофотометры
- •8.2. Атомарные спектры. Энергетические уровни атомов
- •8.3. Молекулярные спектры. Энергетические уровни молекул
- •8.4. Спектры комбинационного рассеяния
- •8.5. Радиоспектроскопия
- •Магнитные свойства вещества
- •Раздел IV. Биофизика
- •Глава 1. Молекулярная биофизика
- •Энтропийный характер упругости биополимеров в высокоэластическом состоянии.
- •1.4. Основные типы межатомных и межмолекулярных взаимодействий
- •1.Ионная связь
- •2.Ковалентная связь
- •3.Межатомное отталкивание
- •4. Донорно- акцепторная связь
- •5. Водородная связь
- •1. Ориентационная связь
- •3. Индукционная связь
- •3. Дисперсионная связь
- •4. Межмолекулярное отталкивание
- •5. Гидрофобные взаимодействия
- •Глава 2. Биологические мембраны
- •. Исследование структуры биологических мембран с помощью физических методов.
- •2.3. Жидкостно-мозаичная модель биомембран
- •2.4. Модельные липидные мембраны.
- •2.5. Физические свойства мембран и методы их исследования.
- •2.6. Физическое состояние и фазовые переходы фосфолипидного бислоя
- •Глава 3. Термодинамика биологических систем.
- •3.1 Применение первого начала термодинамики к биологическим системам. Прямая и непрямая калориметрия. Энергетический баланс организма.
- •3.2. Применение второго начала термодинамики к живым системам. Уравнение пригожина.
- •3.3 Сопряженные процессы. Сопряженные процессы созидания и разрушения
- •3.4 Стационарное состояние. Теорема пригожина. Аутостабилизация. Адаптация.
- •Глава 4. Транспорт веществ через биологические мембраны.
- •4.1 Пассивный и активный транспорт веществ
- •Глава 5. Биоэлектрические потенциалы
- •5.1Виды биопотенциалов. Их виды: покоя, действия. Природа биопотенциалов
- •5.2. Методы регистрации биопотенциалов. Микроэлектроды.
- •5.3 Биопотенциалы покоя. Уравнение Гольдмана, уравнение Нернста. Роль ионных насосов в создании биопотенциала покоя
- •Глава 6. Биофизика нервого импульса
- •6.1. Потенциал действия и его свойства
- •Уравнение Ходжкина-Хаксли
- •6.3.Метод фиксации мембранного потенциала. Ионные токи. Ионные каналы
- •Глава 7. Моделирование биофизических процессов
- •7.1 Моделирование биологических процессов. Моделирование физическое, аналоговое, математическое. Основные требования к моделям.
- •Математические модели роста популяции
- •7.3 Фармакокинетическая модель
Политропные процессы - процессы с постоянной теплоёмкостью.
![]()
Все рассмотренные нами изопроцессы - политропные. В переводе с греческого, «политропические» - разнонаправленные.
Уравнения всех политропных процессов имеет вид:
![]() (3.25)
(3.25)
Где n - показатель политропы разный для разных процессов.
При изотермичесом
процессе T=const
теплоёмкость ![]() ,
уравнение процесса
,
уравнение процесса
![]()
Следовательно, показатель политропы n=1
При адиабатическом (изоэнтропийном) процессе S=const теплоёмкость С=0 уравнение процесса
![]()
При изобарическом
процессе: p=const
теплоёмость ![]() , уравнение процесса
, уравнение процесса
p=const
или
![]()
Наконец, при
изохоричесом процессе V=const
теплоёмкость ![]() ,
уравнение процесса:
,
уравнение процесса:
V=const
или
![]()
![]() V=const
V=const
Поэтому
![]()
Графики различных политропных процессов представлены на рис.3.9
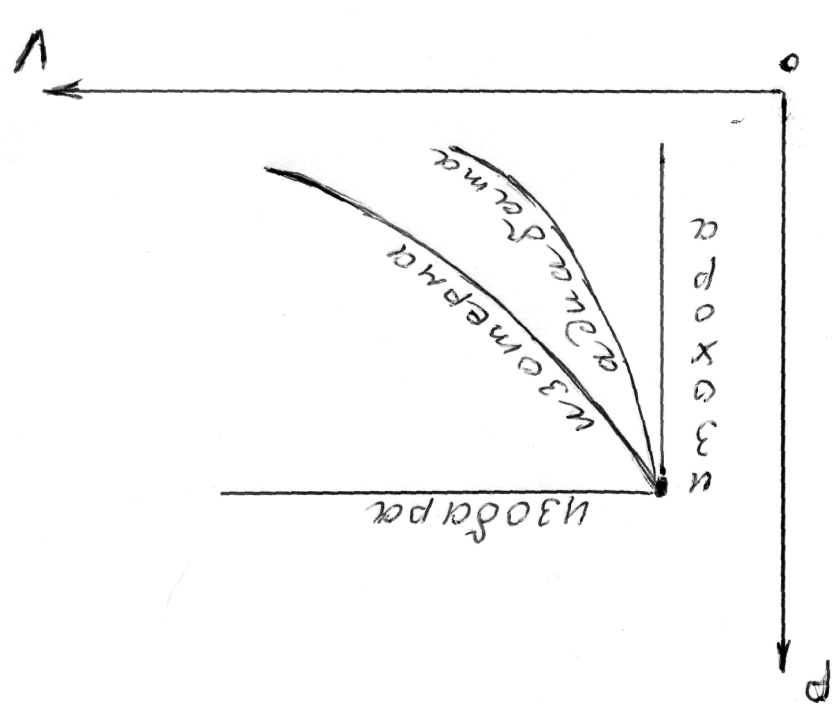
Рис.3.9. Графики различных политропных процессов.
3. 3.МОЛЯРНЫЕ ТЕПЛОЁМКОСТИ ИДЕАЛЬНЫХ ГАЗОВ
Согласно выводам, полученным при применении первого начала термодинамики к процессам в идеальном газе, теплоёмкость идеального газа при постоянном объёме (3.10):
![]()
а при постоянном давлении (3.16.):
Воспользовавшись результатами молекулярной физики, получили
(3.13, 3,17)
![]()
и
![]()
В
таблице 3.1 представлены значения числа
степеней свободы , а также теплоёмкости
при постоянном объёме ![]() , при постоянном давлении
и показатели адиабаты
различных идеальных газов.
, при постоянном давлении
и показатели адиабаты
различных идеальных газов.
ТАБЛИЦА 3.1. ТЕПЛОЁМКОСТИ И ПОКАЗАТЕЛИ АДИАБАТЫ ИДЕАЛЬНЫХ ГАЗОВ
газ |
i |
|
|
|
Соответствие эксперимен-тальным данным |
одноатомный |
3пост |
|
|
|
хорошее |
двухатомный |
5=3пост+2вр |
|
|
|
Удовлетвори -тельное |
трёхатомный |
6=3пост+3вр |
3R |
4R |
|
неважное |
Многоатом-ный |
6=3пост+3вр |
3R |
4R |
|
плохое |
Недостаточно хорошее соответствие экспериментальным данным результатов молекулярной физики и термодинамики, для не одноатомных газов объясняется тем, что модели "жёстких" молекул с определённым числом степеней свободы, принятые в молекулярной физике, которая основывается на классической механике, более или менее применимы в достаточно узком температурном интервале при средних температурах. Они не применимы при низких и высоких температурах. Дело в том, что классическая механика, основанная на законах динамики Ньютона, мало применима к микроскопическим объектам - атомам и молекулам. В микромире действуют другие законы- законы квантовой механики. А согласно квантовой механике число степеней свободы молекулы меняется при изменении температуры.
Так теплоёмкость двухатомных газов при постоянном объёме только при средних температурах
.
![]() R
R
Согласно классическим представлениям у молекулы двухатомного газа число степеней свободы постоянно (5 степеней свободы: 3 -поступательных и 2- вращательных), и его теплоёмкость R
,а на самом деле
при низких температурах теплоёмкость
уменьшается до ![]() и двухатомный газ ведёт себя как
одноатомный. Две вращательных степени
свободы молекулы "замораживаются".
При дальнейшем понижении температуры
теплоёмкость продолжает уменьшаться
и при стремлении к абсолютному нулю
и двухатомный газ ведёт себя как
одноатомный. Две вращательных степени
свободы молекулы "замораживаются".
При дальнейшем понижении температуры
теплоёмкость продолжает уменьшаться
и при стремлении к абсолютному нулю
![]() ,
тоже стремится к нулю
,
тоже стремится к нулю ![]() .
А вот при повышении температуры T
увеличивается до
.
А вот при повышении температуры T
увеличивается до ![]() . "Размораживается" колебательная
степень свободы колебаний атомов
двухатомной молекулы относительно друг
друга. На колебательную степень свободы
молекулы приходится не только средняя
кинетическая энергия
. "Размораживается" колебательная
степень свободы колебаний атомов
двухатомной молекулы относительно друг
друга. На колебательную степень свободы
молекулы приходится не только средняя
кинетическая энергия ![]() ,
но и равная ей средняя потенциальная
энергия
, всего kT.
,
но и равная ей средняя потенциальная
энергия
, всего kT.
И, таким образом, колебательная степень свободы вносит в теплоёмкость газа такой же вклад, как и две поступательные или вращательные.
На рис.3.10 схематически показано изменение теплоёмкости при постоянном объёме двухатомного идеального газа при изменении температуры и модели его молекулы, применимые при разных температурах: при некоторых средних температурах – это «гантели» – два маленьких, жёстко соединённые друг с другом шарика», при более низких – «одиночные шарики», при более высоких – «два шарика, соединённые пружинкой».
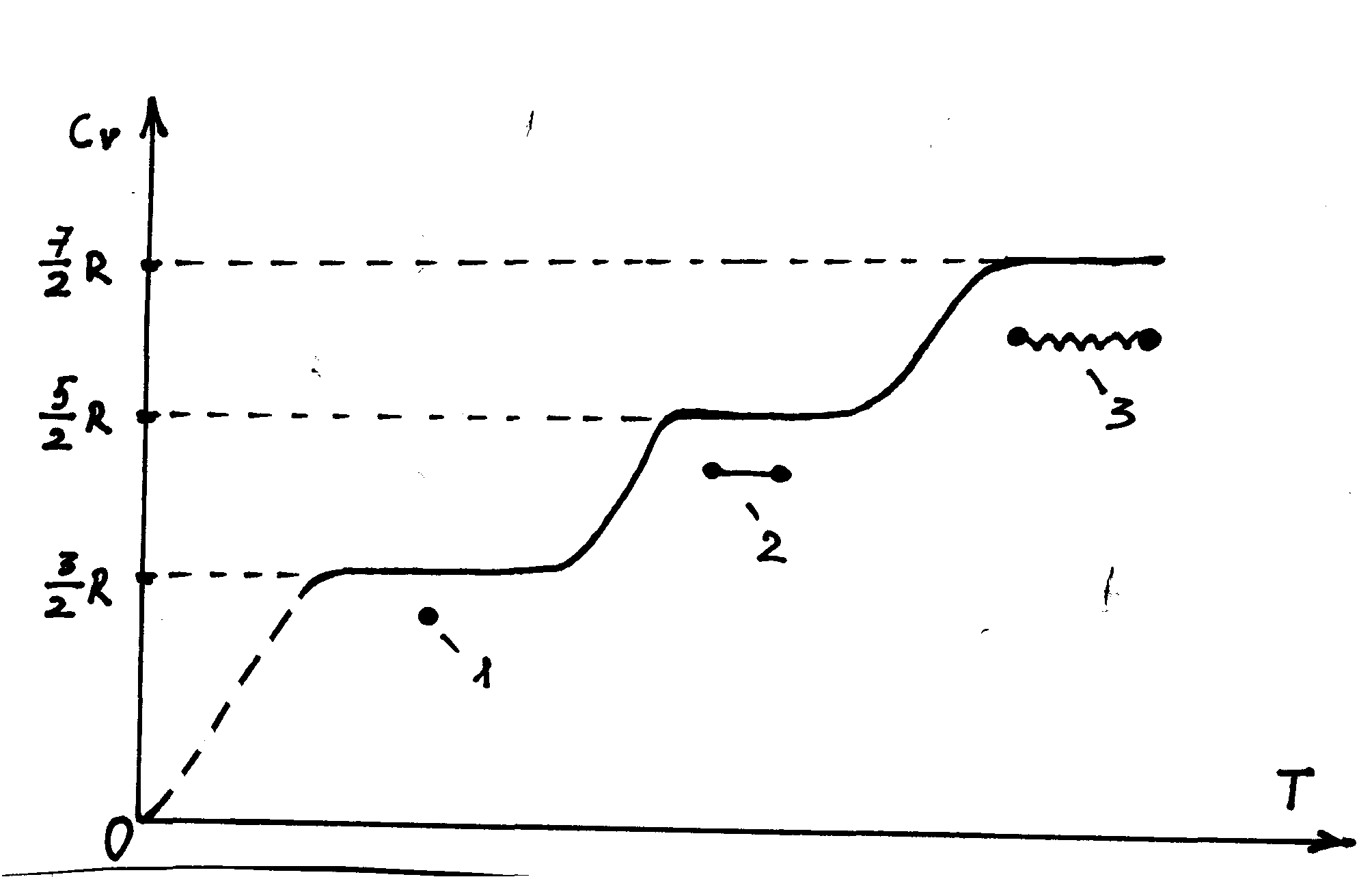
Рис. 3.10. Температурная зависимость теплоёмкости при постоянном объёме двухатомного идеального газа и и модели его молекулы, применимые при разных температурах: «гантели» – 2, «одиночные шарики» - 1, «два шарика, соединённые пружинкой» - 3.
ВОПРОСЫ И ЗАДАЧИ К ГЛАВЕ 3
1.Идеальный газ переходит из состояния 1 в состояние 2 (рис.3.11) по двум путям: 1а2 и 1в2. В каком случае больше количество работы A и количество теплоты Q , какого они знака?
Каковы A и Q ,если совершаются циклические процессы: 1а2в1 и 1в2а1?

Рис.3.11. К задаче 2.
2.Идеальный газ совершает циклический процесс 123416541 (рис.3.12)

Рис.3.12. К задаче 3.
Найдите количества
теплоты Q
и работы A
в этом процессе. Чему равны ![]() ,
Q
и A
в процессах12341 и 16541?
,
Q
и A
в процессах12341 и 16541?
3. Найдите изменение внутренней энергии и количество теплоты Q при изохорическом нагревании 1 м3 воздуха от 20о С до 30о С. Начальное давление р = 103 Па. Считать воздух двухатомным газом с молярной массой М=29г/моль.
4.Найдите удельные теплоёмкости воздуха при изохорическом и изобарическом процессах, считая воздух двухатомным идеальным газом с молярной массой М = 29 г/моль.
5.Феном - называется тёплый ветер на средиземноморском побережье, дующий с высоких и, часто, заснеженных гор. Почему ветер тёплый?
6.Почему обитатели Арктики вынуждены потреблять много животной пищи, богатой белками и жирами, а жители некоторых жарких стран обходятся жареными бананами?
