
- •Определение отношения теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме
- •Составители Валишев м.Г., Гребенкина о.Г., Повзнер а.А., Саввин в.С.
- •1. Некоторые сведения из теории
- •2. Метод клемана - дезорма
- •3. Работа при адиабатическом процессе
- •4. Усовершенствованный вариант метода
- •5. Описание установки. Порядок выполнения работы
- •Контрольные вопросы
- •Определение отношения теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме
- •Определение отношения теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме
- •620002, Екатеринбург, Мира, 19
- •620002, Екатеринбург, Мира, 19
Министерство образования и науки Российской Федерации
Уральский федеральный университет
имени первого Президента России Б.Н. Ельцина
Определение отношения теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме
Методические указания к лабораторной работе № 7
Екатеринбург
УрФУ
2010
УДК 553.41.(075.8)
Составители Валишев м.Г., Гребенкина о.Г., Повзнер а.А., Саввин в.С.
Научный редактор доцент, канд. техн. наук В.П. Левченко
Определение отношения теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме: методические указания к лабораторной работе № 7 / Валишев М.Г., Гребенкина О.Г., Повзнер А.А., Савин В.С. Екатеринбург: УрФУ, 2010. 28 с.
Методические указания предназначены для выполнения лабораторной работы в студенческом лабораторном практикуме. Теоретическая часть содержит общие сведения, относящиеся к свойствам идеального газа. Приведено описание экспериментальной установки, методики проведения опытов, измерений и обработки результатов. Приведена форма отчета.
Подготовлено кафедрой физики
© УрФУ, 2010
1. Некоторые сведения из теории
Теплоемкостью тела называется физическая величина, численно равная количеству тепла, которое необходимо сообщить телу, чтобы повысить его температуру на один кельвин.
Теплоемкость единицы массы называется удельной теплоемкостью, а теплоемкость одного моля вещества – молярной теплоемкостью. Таким образом,
![]()
 (1)
(1)
где
C
и CM
–
удельная и молярная
теплоемкости;
![]() – количество
тепла, сообщенного телу;
– количество
тепла, сообщенного телу;
![]() – приращение температуры;
– приращение температуры;
![]() – масса тела; M
– молярная масса.
– масса тела; M
– молярная масса.
Величина теплоемкости вещества в общем случае зависит от условий нагревания и температуры. Поэтому вводят понятие молярной теплоемкости при постоянном объеме СV и при постоянном давлении Cp.
Рассмотрим теплоемкости идеального газа при его изобарическом и изохорическом нагревании.
Из первого начала термодинамики следует, что при изобарическом процессе (p = const) подведенное к газу тепло затрачивается на увеличение его внутренней энергии и на совершение работы против внешних сил
![]()
Приращение внутренней энергии идеального газа равно
![]()
Элементарная работа газа при равновесном изобарическом расширении равна
![]()
Таким образом,
![]() (2)
(2)
Из формул (1) и (2) получается выражение для молярной теплоемкости идеального газа при постоянном давлении
![]() (3)
(3)
где i – число степеней свободы молекул газа; R – универсальная газовая постоянная.
При
изохорическом нагревании газа (V
= const)
его работа против внешних сил равна
нулю
![]() ,
все подведенное тепло идет на приращение
внутренней энергии газа
,
все подведенное тепло идет на приращение
внутренней энергии газа
![]() и молярная теплоемкость равна
и молярная теплоемкость равна
![]() (4)
(4)
Таким образом, теплоемкость газа не зависит от температуры, определяется только числом степеней свободы молекул газа и является функцией процесса. Из выражений (3) и (4) следует, что отношение теплоемкости СP к теплоемкости CV равно
![]() (5)
(5)
Величину γ называют коэффициентом Пуассона, или показателем адиабаты. Определение величины γ важно потому, что она входит в уравнения, описывающие адиабатические процессы и процессы, близкие к ним, такие, как распространение звука, течение газов со звуковыми и сверхзвуковыми скоростями и т.п.
Таким образом, значение γ определяется числом и характером степеней свободы молекул идеального газа.
В табл. 1 даны значения CV/R, Cp/R и γ, вычисленные для различных молекул по формулам (3), (4) и (5). Как теория согласуется с экспериментом, позволяют судить табл. 1 и рис. 1.
Таблица 1
Теоретические значения теплоемкости идеального газа
Молекула |
Число степеней свободы |
i |
CV/R |
Cp/R |
γ |
||
поступа-тельных |
враща-тельных |
колеба-тельных |
|
|
|
|
|
Одноатомная Двухатомная жесткая Двухатомная упругая Трехатомная жесткая |
3
3
3
3 |
-
2
2
3
|
-
-
1
- |
3
5
7
6 |
3/2
5/2
7/2
6/2 |
5/2
7/2
9/2
8/2 |
1,67
1,40
1,29
1,33 |
Таблица 2
Экспериментальные значения Cp/R для газов при 25ºС и атмосферном давлении
Газ |
Число атомов в молекуле |
Cp/R |
Газ |
Число атомов в молекуле |
Cp/R |
Водород (H) Азот (N) Кислород (O) Неон (Ne) Аргон (Ar) Криптон (Kr)
|
1 1 1 1 1 1 |
2,50 2,50 2,63 2,50 2,50 2,50 |
Водород (H2) Азот (N2) Кислород (O2) Хлор (Cl2) CO2 C3O2 |
2 2 2 2 3 5
|
3,47 3,50 3,53 4,07 4,47 7,91 |
Из табл. 2 на первый взгляд следует, что согласие теории с экспериментом, хотя бы для одно- и двухатомных молекул, вполне удовлетворительное. Однако на самом деле это не так. В соответствии с теорией теплоемкость газов должна быть целой кратной R/2, поскольку число степеней свободы может быть только целым: степень свободы либо есть, либо её нет. Поэтому даже очень малые отклонения теплоемкости от значений, кратных R/2, играют принципиальную роль. В таблице же наблюдается много таких отклонений, причем заведомо превышающих погрешности измерений.
Особенно
разительным становится расхождение
между теорией и экспериментом, если
обратиться к рис. 1, на котором показана
зависимость
![]() аргона, водорода и азота от температуры.
Даже у одноатомного аргона в температурном
интервале от 100 до 200 К наблюдается
заметное изменение теплоемкости.
аргона, водорода и азота от температуры.
Даже у одноатомного аргона в температурном
интервале от 100 до 200 К наблюдается
заметное изменение теплоемкости.
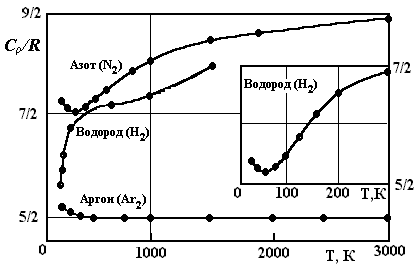
Рис.
1. Зависимость
![]() от температуры для аргона, водорода и
азота. Кружками отмечены экспериментальные
точки. Справа в рамке дан начальный
участок кривой для водорода
от температуры для аргона, водорода и
азота. Кружками отмечены экспериментальные
точки. Справа в рамке дан начальный
участок кривой для водорода
У азота лишь на участке от 200 до 400 К теплоемкость остается приблизительно постоянной и соответствующей пяти степенями свободы (i = 5). Затем теплоемкость монотонно растет, достигая при 3000 К значения, примерно соответствующего i = 7 (т.е. шести степеням свободы, из которых одна колебательная). Водород при 40–70 К ведет себя как одноатомный газ с i = 3. Затем число степеней свободы как бы непрерывно растет, достигает при 400 К значения, равного пяти (молекулы движутся поступательно и вращаются), и продолжает расти.
Полное согласие с экспериментом было достигнуто в квантовой теории теплоемкости газов. В дальнейшем мы ограничимся рассмотрением двухатомных молекул. Согласно квантовой механике энергия вращательного и колебательного движений молекул может иметь гне любые, а лишь дискретные значения (т.е. значения, отличающихся друг от друга на конечную величину). Поэтому энергия, с этими видами движения, может изменятся только скачками. Для энергии поступательного движения такого ограничения не существует – она может изменятся непрерывно, сколько угодно малыми порциями.
Интервалы
между уровнями (т.е. допустимыми
значениями) энергии для колебательного
движения много больше, чем для
вращательного:
![]() (рис. 2).
(рис. 2).
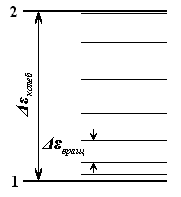
Рис. 2. схема энергетических уровней двухатомной молекулы: 1 – основной (т.е. самый низкий) колебательный уровень, 2 – первый возбуждённый уровень; следующие за ним колебательные уровни не показаны. В промежутке между колебательными находятся вращательные уровни
Подавляющая
часть молекул газа обладает энергией,
близкой к средней энергии <ε>,
которая имеет значение порядка kT.
Если эта энергия заметно меньше, чем
![]() ,
то вращательное движение возбудиться
не может и двухатомные молекулы ведут
себя как одноатомные (см. на рис. 1 значение
,
то вращательное движение возбудиться
не может и двухатомные молекулы ведут
себя как одноатомные (см. на рис. 1 значение
![]() для водорода при 50 К). при повышении
температуры и соответственно увеличении
<ε>
всё большая часть молекул оказывается
вовлечённой во вращательное движение.
На рис. 1 этому процессу соответствует
участок кривой для водорода в интервале
от 50 до 400 К.
для водорода при 50 К). при повышении
температуры и соответственно увеличении
<ε>
всё большая часть молекул оказывается
вовлечённой во вращательное движение.
На рис. 1 этому процессу соответствует
участок кривой для водорода в интервале
от 50 до 400 К.
При
kT
порядка
![]() начинают возбуждаться колебания молекул.
Число молекул вовлечённых в колебательное
движение, с повышением температуры
растёт. На рис.1 этому процессу соответствует
участок начинающийся при 600 К, на кривой
для водорода и участок от 300 до 3000 К на
кривой для азота.
начинают возбуждаться колебания молекул.
Число молекул вовлечённых в колебательное
движение, с повышением температуры
растёт. На рис.1 этому процессу соответствует
участок начинающийся при 600 К, на кривой
для водорода и участок от 300 до 3000 К на
кривой для азота.
Подводя итог, можно сказать, что классическая теория теплоёмкости даёт удовлетворительные результаты для одноатомных молекул (это связано с тем, что поступательное движение не имеет квантовых ограничений). Для многоатомных молекул классическая теория приближенно верна лишь для отдельных температурных интервалов, причём каждому интервалу соответствует своё число степеней свободы молекул.
В классической теории теплоемкости, зная число степеней свободы молекул однокомпонентного газа, легко рассчитать коэффициент γ. Однако для смеси газов расчет осложняется тем, что нужно знать процентное содержание каждого газа в смеси. Поэтому практически удобнее не производить вычисления, а определить γ непосредственно на опыте.
Целью настоящей работы является определение γ воздуха весьма простым экспериментальным методом Клемана-Дезорма (1819 г.).
