
- •Теоретические основы энерго- и ресурсосбережения в химических технологиях.
- •Курс лекций.
- •Москва 2004.
- •Содержание
- •Введение.
- •Горячий воздух
- •Влажный воздух
- •Сухой воздух
- •Горячий кокс
- •Холодный кокс
- •II. Процессы преобразования энергии в сберегающих устройствах химических технологий.
- •Теоретические основы процессов тепломассопереноса в энерго- и ресурсосберегающих устройствах.
- •1. Теплопроводность
- •Тепловой поток через плоскую стенку.
- •2. Конвекция
- •Теплоотдачи в замкнутом объёме.
- •2.3. Теплопередача от основания теплообменника через оребренную поверхность.
- •2.4 Тепловой расчёт рекуператоров.
- •2.5. Аэродинамический (гидравлический) расчёт теплообменных устройств.
- •Излучение.
- •3.2. Лучистый теплообмен тел в прозрачной среде.
- •Лучистый теплообмен между двумя серыми телами, произвольно размещёнными в пространстве.
- •Формулы для расчётов коэффициентов облучённости и взаимных поверхностей для замкнутой системы двух излучающих тел.
- •Результативное излучение.
- •Действие экранов.
- •3.3. Лучистый теплообмен в поглощающей среде.
- •Серая среда.
- •Излучение газов.
- •- Тепловая мощность излучения
- •Поправка на парциальное давление водяных паров, при .
- •Поправка на взаимное перекрытие полос излучения углекислоты и водяных паров.
- •Приближённый метод расчёта .
- •Излучение запылённых потоков газа.
- •Теплообмен в топках котельных агрегатов.
- •3.4. Совместные действия излучения, конвекции и теплопроводности.
- •Механизм переноса тепла.
1 тн/час,
1000°С
Перегретый пар
0,5 тн/час,
450°С
4 МПаГорячий кокс
















 8
8
Насыщ. пар
250°С





1
3
2





азот 800 0С



























Азот
170 0С
Пыль
Пыль
7









































































































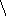



















































4
10
9
12
5
11
6




питат. вода
0,5 тн/час,
20 0С

0,95 тн/час,
200 0С
200 0СХолодный кокс
Пыль
Рис. 9. Схема утилизации теплоты горячего кокса при его сухом тушении (подавление реакции горения) инертным газом (азотом) в герметичном устройстве.
1 – форкамера;
2 – камера тушения;
3 – система отверстий;
4 – пылеосадительная камера;
5 – котёл-утилизатор;
6 – циклон;
7 – вентилятор;
8 – барабан котла;
9 – циркуляционный контур (пучок труб);
10 – пароперегреватель;
11 – водяной экономайзер (подогреватель воды)
12 – футеровка.
Схемы установок для получения ценных вторичных продуктов при огневой переработке отходов химических производств.
Получение соляной кислоты и хлора при переработке хлорорганических отходов.
1
пар





в
отходы










2






в

т




















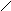





































































10




NaOH
вода
6
3








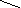

8
5















7
в кана-
лизацию









вода


9




4




вода





12
11
13
соляная кислота
концентрир.


Рис.10 Схема установки получения соляной кислоты из хлорорганических отходов.
1 - горелка для отходов;
2 - огневой реактор;
3 - закалочная камера;
4,5 - изотермические абсорберы;
6 - насос;
7 - ёмкость с раствором NaOH;
8 - двухступенчатый абсорбер (санитарный);
9 – вентилятор-дымосос;
10 - дымовая труба;
11 - насос;
12 - ёмкость разбавленной соляной кислоты;
13 - продуктовая ёмкость (в ней находится концентрированая соляная кислота).
Т - добавочное топливо;
В - воздух.
На рис.10 представлена одна из возможных принципиальных технологических схем получения товарной соляной кислоты из хлорорганических отходов с высоким содержанием хлора.

 Отходы с помощью
горелочного устройства 1 вводят в огневой
реактор 2.
Отходы с помощью
горелочного устройства 1 вводят в огневой
реактор 2.
В случае негорючих отходов в реакторе сжигают дополнительное топливо. Отходящие газы подвергают закалке в закалочной камере 3 путем распыливания в ней разбавленной соляной кислоты.
Охлажденные газы поступают в систему абсорбции, состоящую из двух изотермических пленочных абсорберов 4 и 5 , представляющих собой графитовые трубчатые теплообменники. Абсорберы включены последовательно по ходу газов. Во второй по ходу абсорбер 5 подают разбавленную соляную кислоту из санитарного абсорбера 8, которая в трубчатке движется противотоком к газам. Из абсорбера 5 кислота поступает в абсорбер 4. Оба абсорбера охлаждаются водой. В них происходит конденсация влаги из дымовых газов и поглощение стекающей жидкостью хлористого водорода из газовой фазы. Из первой ступени абсорбции выходит продуктовая 30%—ная соляная кислота.
После системы абсорбции газы направляются в двухступенчатый санитарный абсорбер 8. В нижней насадочной ступени, орошаемой разбавленной соляной кислотой, осуществляется очистка газов от HCl до концентрации порядка 500 млн-1. Часть рециркулирующей кислоты из емкости 12 насосом 11 подается в закалочную камеру 3 и на орошение абсорбера второй ступени изотермической абсорбции. Система рециркуляции кислоты в санитарном абсорбере пополняется водой. Нижняя ступень санитарного абсорбера, по существу, является адиабатическим аппаратом, в котором осуществляется третья ступень абсорбции HCl. В верхней насадочной ступени санитарного абсорбера, орошаемой рециркулирующим 5%ным раствором NaOH , происходит дальнейшая очистка газов от HCl до остаточной концентрации ниже 10 млн–1. Одновременно газы очищаются от элементного хлора.
Получение серной кислоты при переработке кислых гудронов.
Серная кислота занимает основное место в числе продуктов химической промышленности. Её потребитель- химическая и нефтехимическая промышленность, металлургия, машиностроение, сельское хозяйство. Отходы процессе производства серной кислоты: отработанная серная кислота (ОСК), кислые гудроны (КГ), сточные воды(содержащие 10%масс серной кислоты).Различают малоконцентрированные (до 60%H2SO4) и высококонцентрированные (60%) ОСК.
Кислые гудроны – это высоковязкие смолообразные жидкости с большим содержанием органических веществ; содержание в них не менее 50% серной кислоты и более 50% органических веществ соответственно определяют их как высокосодержащие органические вещества и высокосодержащие серную кислоту.
Получаются кислые гудроны (КГ) в результате очистки и сульфирования нефтепродуктов и индивидуальных углеводородов серным ангидридом (SO3), олеумом3и серной кислотой. Компоненты КГ: 10—76% сульфокислот (сульфоновые кислоты: RSO2OH—органические соединения, содержащие сульфогруппу SO2OH и органический радикалR. Получают сульфированием углеводородов, гидролизом4 сульфохлоридовRSO2Cl . Сульфокислоты используются в производстве моющих средств, красителей, ионообменных смол, лекарств) и 90—24%H2SO4.
ОСК содержит органические вещества – от 1 до 10% иH2SO4oт 90 до 10%. Органические вещества в зависимости от технологии представлены эфирами5, спиртами6, альдегидами7, кетонами8, карбоновыми кислотами9.
В состав ОСК могут входить металлы в виде продуктов коррозии либо в виде металлоорганических соединений.
По данным на 1983 год объем ОСК в СССР составил 2 млн. т., что составило 10% от общего производства H2SO4; при этом число видов ОСК составило более 200, с содержанием около 100 видов примесей.
Известны три направления обезвреживания и использования сернокислотных отходов:
— нейтрализация либо огневое обезвреживание без использования образующихся продуктов;
— непосредственное (иногда включая упаривание) использование отходов в некоторых технологических процессах;
— регенерация (возвращение отработавшему продукту исходных качеств) отходов с получением товарной серной кислоты или олеума в качестве целевых продуктов, при использовании огневого метода.
H2SO4 идет на производство: минеральных удобрений(суперфосфат, сульфат аммония), различных кислот и солей, лекарств, моющих средств, красителей, искусственного волокна, взрывчатых веществ; применяется в металлургии (например: разложение урановых руд), для очистки нефтепродуктов, в качестве осушителя.
Себестоимость H2SO4, полученной из отходов, на 25—30% ниже, чем при ее производстве из традиционного сырья – элементной серы.

Рис. 11 Схема установки получения серной кислоты из отходов методом термического расщепления.
1 - огневой реактор; 7 - газодувка;
2 - воздуходувка; 8 - узел получения кислоты;
3 - пароперегреватель; 9 -дымосос;
4 - воздухоподогреватель; 10 - дымовая труба;
5 - котел – утилизатор; Т - топливо;
6 - система очистки газов; В - воздух.
Принципиальная технологическая схема установки регенерации серной кислоты термическим разложением отработанной серной кислоты (ОСК) и кислых гудронов (КГ) показана на рис.11.
Сернокислотные растворы с помощью форсунок распыляют в потоке продуктов сгорания топлива в огневом реакторе 1. При этом органические примеси окисляются с образованием СО2и Н2О, а серная кислота расщепляется с образованиемSO2. Далее сернистый газ из огневого реактора поступает в котел-утилизатор 5, а из него - в систему очистки газов 6, где очищается от пыли, сернокислотного тумана и подвергается сушке. После этого очищенный и осушенный сернистый газ газодувкой 7 подают в узел получения кислоты 8 , где диоксид серы в контактном аппарате окисляется до триоксида, а затем триоксид серы подвергается абсорбции с получением товарных продуктов ( чистой стандартной серной кислоты, олеума). Надо отметить, что в котле утилизаторе 5 поверхности нагрева труб со стороны сернистого газаSO2должны иметь температуру, более высокую, чем температура конденсации сернистого газаSO2: во избежание коррозии и образования конденсата. Поэтому недопустима работа котла в качестве экономайзера: котел должен работать в режиме кипения воды, а температура кипения (парообразования) должна быть выше температуры конденсации сернистого газаSO2, что обеспечивается давлением паров воды внутри труб. Для упаривания сернокислотных растворов применяются погруженного горения ?
В том случае, когда огневой регенерации должны подвергаться разбавленные сернокислотные растворы, необходимо их концентрировать методом упаривания. Простым упариванием концентрацию серной кислоты в растворе можно довести до 80%. При этом в паровую фазу переходит практически только вода. Для упаривания сернокислотных растворов применяются аппараты погружного горения.
Регенерация отработанных травильных растворов.
А) регенерация сернокислотных растворов.
При сернокислотном травлении металлов (удаление окалины) образуются травильные растворы с содержанием 2,5—11% H2SO4и15—28%FeSO4*7H2O( в пересчете наFeSO4). В производстве титановых белил образуется отход—гидролизная серная кислота , состоящая из : 16—20% Н2SO4, 15%FeSO4 , 2%Fe2(SO4)3, примесей сульфатовMg,Ti,Al,Ca; остальное—вода.
Эти отходы практически не содержат органических примесей. Из них осуществляется регенерация серной кислоты(целевого продукта).
При огневой переработке отработанных травильных растворов и гидролизной серной кислоты кроме сернистого газа получают второй побочный продукт—порошкообразный оксид железа(целевой продукт).Последний находит применение в качестве красного пигмента в производстве красителей, в изготовлении активных катодных масс (источника электронов) , ферритныхпорошков ( ферромагнетики: соединения железа с переходными металлами ), полирующих порошков . При переработке сильно загрязненной гидролизной серной кислоты получается недостаточно чистый оксид железа, используемый как металлургическое сырье; либо при дополнительной обработке получают более ценное металлургическое сырье—губчатое железо.
В случае регенерации
сернокислотных растворов используются
схемы, представленные на рис. 12,13.
Регенерация имеет целью получение
сернистого газа
![]() (а затем товарной серной кислоты) и
порошкообразного железа.
(а затем товарной серной кислоты) и
порошкообразного железа.
По схеме рис.13 в качестве дополнительного топлива используют элементную серу.

Рис. 12. Схема установки огневой переработки отработанных травильных растворов:
1 - огневой реактор;
2 – циклон-пылеуловитель;
3 - насадочный скруббер – испаритель;
4,5 - насос.
В огневом реакторе 1 сжигают топливо. В поток продуктов горения топлива распыливают предварительно упаренный сернокислотный раствор. Серная кислота и сульфаты железа подвергаются термическому расщеплению с образованием SO2,SO3и окиси железаFe2O3. Запыленный сернистый газSO2очищается от пыли в циклоне-пылеуловителе 2, а затем направляется в насадочный (или другого типа ) скруббер-испаритель 3, в котором упаривается исходный сернокислотный раствор. Упаренный раствор насосом 4 подается в огневой реактор 1.
Содержание воды в упаренном растворе зависит от температуры отходящих из огневого реактора газов и от состава исходного раствора, в первую очередь от содержания в нем воды. При содержании 60—70% воды и при tотх.газов=950—1000 С содержание воды снижается до 35—40%.
Огневая
переработка сульфатов железа, содержащихся
в травильных растворах. 
Рис. 13 Схема установки огневой переработки сульфатов железа.
1 - бак для приготовления пульпы;
2 - напорный бак;
3 - насос;
4 - огневой реактор;
5 - циклон возврата;
6 - воздуходувка;
7 - воздухоподогреватель;
8 - батарейный циклон;
9 - транспортер;
10 - электрофильтр.
Согласно принципиальной схеме рис.13 сульфаты железа в виде осадка и вода (или промывная кислота) поступают в емкость 1, где при нагревании до 350 К и перемешивании приготовляется пульпа (суспензия с размером частиц 1 мм). Из емкости 1 насосом 3 пульпа перекачивается в напорный бак 2, откуда самотеком через форсунки поступает в огневой реактор 4 с кипящем слоем. В реакторе поддерживается температура на уровне 900—1000С за счет сжигания элементной серы. Газообразные продукты сгорания пульпы и серы - это смесь сернистого газа с водяными парами и избытком воздуха, подаваемого на горение. В результате горения получается также оксид железаFe2O3, находящийся в смеси с пылью. Очистка газа (содержащего сернистый газ) от пыли осуществляется в циклоне возврата 5. Уловленная в циклоне пыль вновь возвращается в огневой реактор. Газы из циклона направляются на охлаждение в воздухоподогреватель 7, а затем на тонкую очистку от пыли в батарейный циклон 8 и сухой электрофильтр 10, откуда сернистый газ при температуре 290—300С направляется на переработку в серную кислоту по классической схеме. Воздух из воздухоподогревателя используется в огневом реакторе. Оксиды железа из огневого реактора, а также пыль, уловленная в воздухоподогревателе и аппаратах газоочистки, выводятся на транспортер 9.
Б. Регенерация солянокислотных растворов.
При соляной кислотной травлении стали имеют место следующие реакции:

Кроме того, протекают реакции:
![]()
Для поддержания необходимой концентрации соляной кислоты в травильном растворе необходимо напрерывное выведение из травильной ванны FeCl2 и FeCl3, которые подвергаются регенерации для получения целевого продукта - ( HCl), возвращаемой обратно в ванну.
В большинстве случаев для травления металлов используют неингибированную соляную кислоту. Ингибированную кислоту применяют для травления металлов, длительно пребывающих в ванне. В качестве ингибитора применяют гексометилентетрамин** (уротропин) с концентрацией 0,5—1г/л травильной кислоты. Хлориды железа FeCl2 и FeCl3 в присутствии водяных паров подвергаются высокотемпературному гидролизу с образованием HCl и окислов железа:
![]()
Эти реакции
осуществляются в огневом реакторе и
получается побочный целевой продукт
![]() .
.

Рис. 14. Схема установки регенерации солянокислотного травильного раствора.
1 - травильная ванна;
2, 6, 9, 12 - насосы;
3 - огневой реактор;
4 - циклон-пылеуловитель;
5 - охладитель газов;
7 - абсорбцонная колонна;
8 - скруббер;
10 - промывная ванна;
11 - емкость с раствором щелочи;
13 - дымосос;
14 - дымовая труба.
На рис.14 представлена одна из схем огневой регенерации травильного солянокислого раствора. Раствор при температуре 80С из травильной ванны 1 насосом 2 подают в охладитель обжигового газа 5, где он охлаждается с 450 до 80С, а травильный раствор упаривается и нагревается примерно от 80 до 95С. При этом из обжигового газа раствором поглощается частьHCl. Кроме того, при промывке обжигового газа травильным раствором из него вымывается тончайшая пыль оксида железа, которая, реагируя сHCl, превращается в хлорат железаFeCl3и возвращается с травильным раствором в огневой реактор 3. Таким образом, в огневой реактор 3 на регенерацию поступает хлорид железаFeCl2 из первоначального травильного раствора и дополнительно хлорат железаFeCl3, образовавшийся из железооксидной пыли.
Из охладителя обжигового газа травильный раствор насосом 6 подается в огневой реактор 3, где распыливается в потоке продуктов сгорания топлива. Капли травильного раствора в огневом реакторе полностью испаряются, а образующиеся мелкие частицы FeCl2 с примесьюFeCl3подвергаются высокотемпературному гидролизу с образованиемHClиFe2О3. Основная массаFe2О3 улавливается в огневом реакторе. Запыленный обжиговый газ из огневого реактора поступает в циклон—пылеуловитель 4, откуда уловленная пыль возвращается в огневой реактор, а обжиговый газ направляется в охладитель газа 5. Из огневого реактора порошок оксида железа через затвор выводится в узел охлаждения, затем упаковывается в мешки и отправляется к потребителям. Этот порошок отличается высокой степенью чистоты, зависящей в основном от содержания примесей в протравливаемой стали. Охлажденный и очищенный от пыли обжиговый газ из охладителя 5 направляется в абсорбционную колонну 7, орошаемую промывочной водой из ванны 10. Из нижней части колонны выводится 16—20%ная соляная кислота с небольшим содержанием хлоридов железа (около 2%), возвращаемая в травильную ванну. Обжиговый газ из абсорбционной колонны поступает в санитарный насадочный скруббер 8, орошаемый раствором каустической соды. Здесь газ очищается от остатковHClи элементного хлора, появление которого в газе возможно за счет окисленияHClи диссоциацииFe2О3в огневом реакторе наFe2О2иCl2. Обжиговый газ после очистке в санитарном скруббере дымососом 13 выбрасывается в атмосферу через дымовую трубу 14. Все аппараты технологической схемы, включая огневой реактор, работают под разрежением, создаваемым дымососом.
Получение фосфорной кислоты при переработке фосфоросодержащего шлама.
На предприятиях производства и переработки фосфора образуются отходы—вязкие неоднородные жидкости, называемые фосфорными шламами; последние содержат 65—70% фосфора, 5—10% минеральных веществ и 25% воды.
Фосфорные шламы—это коллоидные системы*(гели, золи). В этих системах нерастворимые частицы имеют в качестве основы оксиды щелочно-земельных** металлов (Ca,Sr,Ba,Ra—сообщают воде щелочную реакцию), тонкодисперсный углерод и др.; эти компоненты связаны абсорбционными силами с фосфором: образуют мицеллы—частицы дисперсной фазы золя, окруженные слоем молекул или ионов фосфора.
Основной источник фосфорных шламов—желтый фосфор, потери которого составляют 6—20% его производства. Переработка шламов из соображений экологии и снижения потерь фосфора—в основном огневая переработка, с получением фосфорной кислоты и нетоксичного твердого остатка. При этом получаются вторичные шламы и исключается необходимость их дальнейшей переработки. Эффективная огневая переработка обеспечивается при повышенных температурах сжигания фосфора ( выше 1000С), при этом обеспечиваются: наиболее полное окисление фосфора, жидкое шлакоудаление (температура жидких шлаков 950-1000С),высокая температура отходящих газов(950-1000С). Установки с твердым шлакоудалением (барабанные или шахтные реакторы) менее надежны и эффективны: температура процесса ниже 1000С , что приводит к образованию метафосфорной кислоты НРО3 с высокой (800С) температурой кипения . Это в свою очередь приводит к конденсации ее паров на более холодных поверхностях частиц и шлака и изолирует их от доступа кислорода (соответственно –неполный выжиг фосфора). Конденсация на стенках реактора приводит к образованию настылей , а целевой продукт—фосфорная кислота—содержит нежелательный компонент, отогнавшийся из шлаков смолы.
Целевой продукт - ортофосфорная кислота Н3РО4 получается при осуществлении стадий: сжигание шлама, охлаждение газов, гидратация и абсорбция фосфорного ангидрида Р4О10 , Н3РО4—это полупродукт в производстве удобрений, фармацевтических препаратов, кормовых концентратов.
Существует вероятность разрушения реакторов с кирпичной футеровко (защитная внутренняя облицовка) стенок, так как силикатные элементы, взаимодействуя с Р4О10 , образуют лекгоплавкие соединения. Поэтому обычно применяются более надежные циклонные реакторы с кислотостойкими водохлаждаемыми стенками с гарниссажной набивной защитной футеровкой.

Рис.15. Схема установки получения фосфорной кислоты при переработке фосфоросодержащего шлама.
1 - емкость для шлама;
2 - воздуходувка;
3, 7 - насосы;
4 - огневой реактор;
5 - узел грануляции шлака;
6 - башня охлаждения, гидратации и абсорбции;
8 - сборник циркулирующей кислоты;
9 - поверхностный теплообменник;
10 - мокрый электрофильтр;
11 - вентилятор;
12 - выхлопная труба;
В - воздух.
На рис.15 приведена одна из возможных принципиальных технологических схем переработки фосфорных шламов. Фосфорный шлам поступает в емкость 1, оборудованную мешалкой и водяной рубашкой. С помощью мешалки предотвращается расслоение шлама на чистый фосфор и бедный шлам. Водяная рубашка обеспечивает необходимую температуру шлама для его эффективного распыливания. Из емкости 1 с помощью насоса 3 шлам подается к форсункам огневого реактора 4. Распыленный шлам вводится в огневой реактор совместно с воздухом, необходимым для горения фосфора. В огневом реакторе осуществляется сжигание фосфора, расплавление и улавливание шлака, который подвергается грануляции в узле 5.
Продукты сгорания фосфора поступают в башню 6, где происходит охлаждение газов, образование в газовой фазе кислот, конденсация кислот и абсорбция фосфорного ангидрида 75—80%-ной фосфорной кислотой, циркулирующей с помощью насоса 7 через башню 6, емкость 8, теплообменник 9. Охлаждение циркулирующей кислоты производится водой в поверхностном теплообменнике 9. Башня 6 имеет водяное охлаждение. Поэтому охлаждение газов происходит как за счет отвода тепла через стенки башни с охлаждающей водой, так и за счет нагрева циркулирующей фосфорной кислоты. Необходимую концентрацию циркулирующей и получаемой продуктовой кислоты можно регулировать путем добавления в циркуляционный контур воды. Степень улавливания фосфорного ангидрида в башне обычно составляет 70—75%, а остальные 25—30% P4O10в виде тумана фосфорной кислоты при температуре 150—170С улавливаются в мокром электрофильтре 10. Уловленная кислота поступает в сборник 8. Электрофильтр выполняет одновременно роль санитарного аппарата. После него очищенный газ вентилятором 11 через выхлопную трубу 12 выбрасывается в атмосферу. Из сборника 8 часть кислоты по мере накопления периодически направляется на склад.
Получение минеральных солей при переработке жидких отходов.
Получение
сульфата натрия (![]() ).
).
Большие количества сульфата натрия содержатся: в отходах нефтеперерабатывающей промышленности ( при очистке нефтяных фракций от органических кислот); в отходах производства вискозного волокна и целлофана ( отработанные растворы в осадительных ваннах); в отходах производств: синтетических жирных кислот (СЖК); сульфатной целлюлозы; азотной кислоты; капролактама10,-нафтола (оксинафталин, т.е. фенол нафталинового ряда, кристаллы с температурой плавления 123С, применяемые для производства красителей, душистых веществ , стабилизаторов каучуков и резины - С10Н7ОН).
Как правило, отходы указанных производств содержатся в сточных водах, обезвреживание которых совмещается с получением сульфата натрия. Поэтому получение Na2SO4 в этом случае сложнее и дороже, чем из природного сырья. Это связано с наличием в отходах органических примесей, и выделение сульфата натрия организуется в процессах кристаллизации, сушки, высаливания органическими растворителями - кальцинированой и каустической содой и др. Применение этих методов затруднено при высокой концентрации органических веществ в сточных водах, когда указанные выше маточные растворы не могут быть возвращены в основное производство. Поэтому указанные физико-химические методы переработки дополняют термическими с целью окисления органических примесей.
Например, сульфатные сточные воды в производствах синтетических жирных кислот (СЖК) обезвреживаются в реакторах с кипящим слоем (КС) или в циклонных реакторах.
В реакторах КС происходят процессы выпаривания воды, выпаривания и разложения органических примесей. Окисление последних происходит при температурах , более низких, чем температура плавления сульфата натрия (900-950С). Переработка сточных вод при температуре 650С гарантирует от плавления сульфата натрия, однако приводит к разрушению гранул высококипящих многоатомных соединений и твердого углерода, образующихся при разложении органических примесей: увеличивается степень уноса гранул с уходящими газами. Поэтому оптимальным является низкотемпературный (300-350С) процесс выпаривания воды; при этом сульфат натрия не плавится, но органические примеси слабо окисляются, уходящие газы требуется очищать от паров органических примесей ; а содержащие органику гранулы дополнительно прокаливают во вращающейся барабанной печи с собственным топочным устройством.

Рис.16. Схема установки огневой переработки нейтрализованных сульфатных сточных вод производства СЖК.
1 - циклонный реактор;
2- воздуходувка;
3 - скруббер Вентури;
4 - каплеуловитель;
5 - насос;
6 - емкость упаренной воды;
7 - поверхностный теплообменник;
8 - дымосос;
9 - дымовая труба;
10 - кристаллизатор расплава;
11 - транспортер;
12 - вагонетка для сульфата натрия;
Т - топливо;
В - воздух.
Одна из возможных технологических схем установки для переработки сульфатных сточных вод производства СЖК с предварительным упариванием сточной воды за счет теплоты дымовых газов представлена на рис. 16. Исходную сульфатную сточную воду предварительно подвергают нейтрализации едким натром. При этом летучие карбоновые кислоты превращаются в нелетучие натриевые соли. Это позволяет применить предварительное упаривание сточной воды перед ее огневой переработкой в контактном теплообменнике за счет теплоты отходящих из огневого реактора дымовых газов. Исходная сточная вода, содержащая 11—12% Na2SO4, 2—2,5% натриевых солей карбоновых кислот и около 0,2%NaCl, поступает в емкость 6, откуда насосом 5 подается в скруббер Вентури 3, где происходит упаривание сточной воды дымовыми газами.
После упаривания концентрация сульфата натрия в сточной воде повышается до 26—28%. Скруббер Вентури работает по рециркуляционной схеме. Наряду с упариванием сточной воды в нем осуществляется тонкая очистка газов от пыли. После Скруббера Вентури газы направляются в каплеуловитель 4. Для предотвращения конденсации влаги в дымососе и дымовой трубе и парения при выходе в атмосферу дымовые газы из каплеуловителя подаются в поверхностный теплообменник 7, где из них выводится часть влаги; затем газы разбавляются подогретым воздухом и с помощью дымососа 8 через дымовую трубу 9 выбрасываются в атмосферу. Уловленный в теплообменнике 7 конденсат при достаточной чистоте может быть использован в технологическом процессе или направлен в оборотный цикл водоснабжения.
Упаренная сточная вода из емкости 6 насосом 5 подается в циклонный реактор 1, где осуществляется окисление органических примесей сточной воды и образование расплава сульфата натрия. В образующемся расплаве кроме сульфата натрия содержится и карбонат натрия, образующийся при окислении натриевых солей карбоновых кислот. Расплав, выводимый из циклонного реактора, подвергается грануляции в кристаллизаторе 10, охлаждаемом водой. Из кристаллизатора продукт в виде пластинок транспортером 11 подается в вагонетку 12 и затем отправляется на склад, где в случае необходимости может подвергаться дроблению. В соответствии с составом сточной воды получаемый продукт имеет следующий состав: 90—91% Na2SO4, 7—8%Na2СO3, около 1,5%NaClи 0,5% других нерастворимых минеральных примесей. Такой продукт удовлетворяет требованиям ряда потребителей, в частности крупного потребителя—стекольной промышленности. Наличие соды в продукте повышает эффективность его использования в производстве стекла.
